Rhinolophe
Rhinolophus • Fer à cheval

Le genre Rhinolophus regroupe des chauves-souris connues sous le nom de rhinolophes, rhinolophes vrais[1] ou chauves-souris fer à cheval. Ce genre est le seul de la sous-famille des Rhinolophinés (Rhinolophinae) et même de la famille des Rhinolophidae depuis que les Hipposiderinae sont traités comme une famille à part entière, celle des Hipposideridae.
Les espèces de rhinolophes sont réparties dans tout l’Ancien Monde, de l’Europe et l’Afrique jusqu’à l’Asie et l’Australie. Elles se caractérisent par les membranes nasales contournées qui entourent leur nez et en particulier par la membrane inférieure en forme de fer à cheval. Ces membranes serviraient à focaliser l’onde ultrasonore émise par leurs narines, et leurs grandes oreilles serviraient à capter l’onde d'écho. Elles utilisent ce système d’écholocation sophistiqué pour naviguer et chasser la nuit.
Les chauves-souris fer à cheval sont des réservoirs importants de coronavirus. Les destructions de leur habitat naturel tendent à les rapprocher des implantations humaines. De plus, si les Rhinolophus sont rarement consommés comme viande de brousse (ou yewei, 野味, au sud de la Chine), certaines d'entre elles, comme Rhinolophus thomasi, sont vendues à des fins médicinales en Chine et en Asie du Sud-Est. Ces contacts accroissent les risques de transmission de pathogènes à l'humain[2].
Étymologie
Le nom de genre Rhinolophus vient du grec rhis ΄ρις, « nez » et lophos λόφος « crête, panache », pour évoquer leur nez bordé de membranes.
En 1765, Buffon écrivait dans le chapitre sur la Chauve-souris de son Histoire naturelle des animaux t. 13 : « il y en a une que nous avons appelée le Fer-à-cheval, parce qu’elle porte au-devant de sa face un relief exactement semblable à la forme d’un fer à cheval »[3].
Taxonomie
Histoire de la taxonomie
.jpg.webp)
La première étude de synthèse et de recherche sur les chauves-souris fut donnée par Daubenton en 1759 dans un mémoire présenté devant l’Académie royale des sciences. Pour la première fois, par l’usage du pluriel générique, ces animaux sont rassemblés dans un groupe particulier. Il décrit 7 espèces de la faune européenne, en faisant jouer à la denture un rôle de choix[4].
En 1799, Lacépède publie une Table des divisions, sous-divisions, ordre et genres des mammifères dans lequel est introduit le genre Rhinolophus. Les chauves-souris se trouvent dans la seconde division des mammifères alors que la quasi-totalité du monde scientifique les plaçait encore dans les « quadrupèdes ». Dans la première sous-division, intitulée Chiroptère, on trouve les genres:
- 63e Chauves-souris (Vespertillo) : 2 ou 4 incisives supérieures, 6 ou 8 incisives inférieures
- ...
- 65e Rhinolophes (Rhinolophus) : 2 ou 4 incisives supérieures, 4 incisives inférieures
- 1 La chauve-souris fer-à-cheval Rhinolophus ferrum-equinum
- 2 La chauve-souris musaraigne Rhinolophus soricinus
En 1825, le zoologiste britannique Gray divise les Vespertilionidae en sous-familles dont la Rhinolophina. Il est aussi considéré comme le créateur de la famille des Rhinolophidae[5]. En 1907, le genre des Hipposideros des Rhinilophidae est monté au niveau d’une nouvelle famille, les Hipposideridae.
Nombreuses espèces encore inconnues
Selon Nancy Simmons, conservatrice au musée américain d'histoire naturelle de New York, les rhinolophes forment encore en 2022 un groupe complexe encore incomplètement échantillonné. Une étude des données appels d'écholocation et des données génomiques (ADN mitochondrial) acquises dans le sud de la Chine et en Asie du Sud-Est de 2015 à 2020 (publiée dans Frontiers in Ecology and Evolution le 29 mars 2022) laissent penser que plusieurs dizaines d'espèces de rhinologies sont encore inconnues de la science en Asie du Sud-Est on feraient parti d'un complexe d'espèces cryptiques). Comme les plus proches parents connus du SRAS-CoV-2 ont été trouvés chez des chauves-souris Rhinolophus affinis dans la province du Yunnan (sud-ouest de la Chine)[6], et chez trois espèces de Rhinolophes au Laos[7], il semble urgent de mieux connaitre et comprendre ce taxon. Rien qu'en Chine, plus de 11 espèces nouvelles ont été identifiées par ce travail[8].
Le taxon Rhinolophus sinicus pourrait par exemple en réalité être composé de six espèces distinctes. Dans l'ensemble, ils ont estimé qu'environ 40% des espèces en Asie n'ont pas été formellement décrites[8].
Histoire évolutive
L'ancêtre commun le plus récent de Rhinolophus vivait il y a environ 34 à 40 millions d'années[9] en se séparant de la lignée hipposidéride pendant l'Éocène.
Une étude de 2016 utilisant l' ADN mitochondrial et nucléaire a placé les chauves-souris fer à cheval au sein des Yinpterochiroptera en tant que sœur des Hipposideridae[10].
| Chiroptera |
| |||||||||||||||||||||||||||||||||||||||
La famille des Rhinolophidae est représentée actuellement par un seul genre, les Rhinolophus. La famille et le genre sont monophylétiques (tous leurs membres et rien qu’eux descendent d’un ancêtre commun). En 2019, il y avait 106 espèces décrites de Rhinolophus - ce qui en fait le genre le plus riche en espèces après les Myotis.
Les Rhinolophidae ont possédé un second genre, les Palaeonycteris, maintenant éteint. Il était représenté par Palaeonycteris robustus, du Miocène inférieur, dont les restes fossilisés ont été trouvés à Saint-Gérand-le-Puy, près de Vichy[11].
Les Rhinolophidae sont distribués dans tout l’Ancien Monde : de l’Europe occidentale et de l’Afrique jusqu’à l’Asie orientale, Chine, Japon, Philippine et Australie[12]. Elles ne sont pas présentes en Amérique.
Caractéristiques communes
_and_holotype_(ZSI_Reg._No._15561)_(D).tif.jpg.webp)
.jpg.webp)
Morphologie
Les chauves-souris fer à cheval (Rhinolophus) sont considérées comme des Microchiroptera de taille moyenne ou petite (mais le sous-ordre des Microchiroptera a laissé la place au Yinpterochiroptera). Elles ont une longueur totale (tête et corps) allant de 35 à 110 mm.
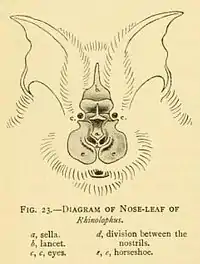
Le nez des Rhinolophes est placé dans une cavité bordée de membranes en forme de fer à cheval, au-dessus duquel s’élève une feuille nasale postérieure, dressée, triangulaire, pointant entre les yeux, nommée le fer de lance. La selle est une membrane plate en forme de crête au centre du nez, s’élevant de derrière les narines et pointant perpendiculairement au crâne[13].
La formule dentaire des rhinolophes est 1123/2133=32, c’est-à-dire que la demi-mâchoire supérieure comporte 1 incisive, 1 canine, 2 prémolaires, et 3 molaires et la demi-mâchoire inférieure possède en plus 1 incisive et 1 prémolaire. Les jeunes perdent leurs dents de lait alors qu’ils sont encore in utero. Ils naissent avec les 4 canines sorties qui leur servent à s’accrocher à leur mère. Les femelles possèdent, en plus des deux mamelles pectorales, une paire de mamelles inguinales non fonctionnelles qui permettent aux jeunes de s’accrocher fermement pendant les premières semaines, en particulier pendant le vol de leur mère[14].
Les oreilles sont grandes, à peu près aussi larges que longues ; elles manquent d’oreillons (ou tragus). Les yeux sont très petits. Les fers à cheval émettent des ultrasons par les orifices nasaux et non par la bouche. Les échos sont perçus par les oreilles. Ce système d’émetteur-récepteur d’ultrasons leur permet de localiser les proies et les obstacles durant la nuit. L’écholocalisation est utilisée par les microchiroptères, des cétacés (dauphin, orques...), des musaraignes, etc.
Les chauves-souris volent grâce à une fine membrane, nommée Patagium, qui s’étend depuis leurs flancs jusqu’au bout des doigts et inclut également la queue et les pattes postérieures.
Les rhinolophes ont un pelage de couleur très variable suivant les espèces, allant du noirâtre au brun rougeâtre à la fourrure dorsale rouge-orange vif.
Biologie et écologie
Ils gîtent dans des grottes ou des cavités plus étroites ; certaines espèces sont seules sur les sites, d’autres se rassemblent en colonie de quelques dizaines de milliers d’individus.
Dès que la température extérieure descend en dessous de 10 °C, les chauves-souris doivent entrer en hibernation. Les rhinolophes dorment dans des cavités où règne une température de 5 à 10 °C et une hygrométrie d’au moins 75 %. Les grottes d’hibernation sont en général grandes.
Dans beaucoup d’espèces de Rhinolophes, il y a un délai important entre l’accouplement et la naissance : les femelles stockent le sperme dans leur utérus jusqu’à ce que les conditions soient optimum pour la gestation et la parturition. Pour les espèces qui hibernent, la période de stockage correspond à la période d’hibernation. En général, les femelles donnent naissance à un seul petit.

Les chauves-souris fer à cheval ont de très petits yeux, ayant un champ de vision limité par leurs feuilles nasales. Il est donc probable que leur vue ne joue pas un rôle important. Pour naviguer, elles utilisent un système d’écholocation qui chez certaines espèces est très sophistiqué. Alors que certaines chauves-souris utilisent une écholocation modulée en fréquence, les chauves-souris à fer à cheval utilisent une écholocation à fréquence constante (également appelée écholocation à fréquence unique[15])
Régime alimentaire et recherche de nourriture

Les fers à cheval sont des insectivores, consommant aussi à l’occasion des araignées. Il existe deux stratégies de recherche de nourriture :
- soit la chauve-souris vole lentement et bas au-dessus du sol, en passant au milieu des arbres et des buissons. À proximité d’une proie, elle fond sur elle pour la capturer
- soit la chauve-souris s’installe aux aguets sur un perchoir et lorsqu’une proie passe alentour, elle s’envole pour la capturer.
Les rhinolophes ont des ailes larges et de grande surface par rapport à leur masse corporelle. Ces facteurs leur donnent une agilité accrue qui leur permet de faire des virages rapides et serrés à vitesses lentes[16].
Relations avec les humains
Réservoirs de coronavirus et d’autres virus
Les chauves-souris fer à cheval sont des réservoirs importants de coronavirus[17] - [18](abr. CoV). Depuis les années 2000, plusieurs épidémies de maladies virales sont apparues en Asie où les coronavirus sont passés des chauves-souris à l’humain. À la suite du passage du virus de l’animal à l’humain (ou zoonose), l’épidémie peut se propager à des millions de personnes si une transmission interhumaine s’établit (en l’absence de vaccins).
Entre 2003 et 2017, trois coronavirus zoonotiques ont été identifiés comme la cause d’épidémies de grande envergure : le Syndrome respiratoire aigu sévère (SRAS en français, SARS en anglais), le Syndrome respiratoire du Moyen-Orient (MERS) et le Syndrome de diarrhées porcines (SADS).
L’épidémie mondiale de SRAS a débuté en Chine dans la ville de Foshan (province de Guangdong) en 2002. Le coronavirus responsable de l’épidémie du SRAS qui a affecté 11 pays a été identifié en 2003[19] et nommé SARS-CoV. Rapidement, il a pu être établi que la source de ces coronavirus se trouvait chez des chauves-souris[20]. Par la suite des CoV liés au SRAS (SARSr-CoV) ont été trouvés dans des civettes palmistes communes provenant de marchés d’animaux vivants de la province de Canton et dans divers espèces de chauves-souris fer à cheval, réservoir premier des SARS-CoV[21].
Quinze ans après, une diarrhée épidémique porcine SADS (Severe Acute Diarrhea Syndrome) dévaste la production porcine chinoise. Cette seconde épidémie qui est partie à nouveau de la province de Canton, a été aussi été provoquée par un coronavirus, nommé le SADS-CoV.
Entre-temps, au Moyen-Orient, le Syndrome respiratoire du Moyen-Orient (MERS, Middle East Respiratory Syndrome) s’étend à 27 pays, en 2012. Il est lui aussi causé par un coronavirus, nommé MERS-CoV[22] dont les plus proches parents connus sont les coronavirus de chauve-souris HKU4 et HKU5 et dont l’hôte intermédiaire est le dromadaire.
En , soit huit mois avant la nouvelle épidémie de coronavirus de Wuhan, Zhou Peng et Shi Zhengli[23] de l’Institut de virologie de Wuhan prévenaient les épidémiologistes qu'« il est généralement admis que les CoV transmis par les chauves-souris réapparaîtront pour provoquer la prochaine épidémie. À cet égard, la Chine est un « point chaud » probable [zone à haut risque]. Le défi consiste à prévoir quand et où de telles épidémies surviendront pour les prévenir au mieux ».
En , une maladie infectieuse émergente nommée COVID-19, causée par un nouveau coronavirus, le SARS-CoV-2, apparaît comme prévu par l'institut de Wuhan, et se propage en Chine puis dans le monde entier. Ce nouveau coronavirus est apparenté au coronavirus responsable du SARS et comme eux, il possède des similitudes avec les Betacoronavirus des chauves-souris fer à cheval[17].
Plusieurs chauves-souris fer de cheval ont été testées séropositives pour les SARSr-CoV : Rhinolophus pusillus, R. macrotis, R. sinicus, R. pearsoni[21]…
Outre les coronavirus, les chauves-souris sont aussi un réservoir naturel du virus Marburg et des virus Nipah et Hendra, qui ont provoqué des maladies humaines et des épidémies en Afrique, en Malaisie, au Bangladesh et en Australie. Elles peuvent cependant héberger ces virus sans tomber malade. On pense qu'elles sont le réservoir naturel du virus Ebola. Elles sont également porteuses du virus de la rage, mais dans ce cas, elles sont touchées par la maladie[24]. Les chauves-souris hébergent une proportion significativement plus élevée de zoonoses que tous les autres mammifères. Le Dr Peter Daszak souligne qu'il est essentiel d'arrêter la vente d'animaux de la faune sauvage sur les marchés pour limiter les futures épidémies.
| ÉMERGENCES INFECTIEUSES À CORONAVIRUS | ||||||
| Épidémie | Lieu d’origine | Espèce source | Espèce intermédiaire | Coronavirus humain | Récepteur | Taux de mortalité |
|---|---|---|---|---|---|---|
| SARS, 2002-2003 | Guangdong | Rhinolophus sinicus[25] | Civette palmiste commune Paradoxurus hermaphroditus | SARS-CoV-1 | ACE2 | 10 % |
| MERS, 2012 | Moyen-Orient | Rhinolophe | Dromadaire | MERS-Cov | DPP4 (CD26) | 35 % |
| COVID-19, 2019-2020 | Wuhan | Rhinolophus | pas d'hôte connu (Pangolin un temps suspecté) | SARS-CoV-2 | ACE2 | 1-2 % ? |
Trois hypothèses liant l’émergence du coronavirus aux activités humaines ont été avancées :
- l’anthropisation globale du monde, la destruction des habitats naturels, l’intensification agronomique et d’élevage
- les marchés d’animaux sauvages, la consommation de « viande de brousse » de yewei (civettes, pangolins, etc.) et l’utilisation de substances animales dans la pharmacopée traditionnelle chinoise (aile de chauve-souris, excrément de chauve-souris du Shennong bencao jing)
- l’accident de laboratoire : en , les réseaux sociaux chinois ont accusé l’Institut de virologie de Wuhan d’avoir laissé échapper le coronavirus responsable d’épidémie du Covid-19. Les attaques se sont focalisées sur une chercheuse Shi Zhengli, surnommée « batwoman » par ses collègues parce qu’elle avait passé les 16 dernières années à explorer les grottes de 28 provinces chinoises pour échantillonner les virus portés par les chauves-souris[26] - [27]. Avec son équipe, elle a découvert des centaines de coronavirus transmis par les chauves-souris dans une grotte près de Kunming, la capitale de Yunnan, dont certaines souches sont très proches du coronavirus du SARS de 2002-2003[25] (portées par des rhinolophes). Puis en , après la publication de la séquence du génome du nouveau coronavirus apparu fin 2019 à Wuhan, son équipe a établi que ce nouveau coronavirus SARS-Cov2 est identique à 96 % à une souche de coronavirus de chauves-souris Rhinolophus affinis, trouvée dans le Yunnan[17]. En réponse aux accusations, Shi a alors affirmé : « Je jure sur ma vie, que [le virus] n'a rien à voir avec le laboratoire », elle précisa que « Le nouveau coronavirus 2019 c’est la Nature qui punit les humains pour avoir gardé des habitudes de vie non civilisées »[28], ce qui dans la phraséologie chinoise doit vouloir dire des « habitudes archaïques », comme continuer à avoir des marchés de faune sauvage yewei, vendant des civettes, pangolins, blaireaux et crocodiles pour la consommation comme des alicaments.
Autres virus
Les rhinolophes sont également associés à les orthoreovirus, flavivirus et hantavirus. Ils ont été testés positifs pour les orthoreovirus mammaliens (Mammalian orthoreovirus, abr. MRV), y compris un MRV de type 1 isolé de la petite chauve-souris fer à cheval (Rhinolophus hipposideros), et un MRV de type 2 isolé de la Rhinolophus pusillus. Les MRV spécifiques trouvés dans les rhinolophes n’ont pas été liés à une infection humaine bien que les humains puissent tomber malades par exposition à d’autres MRV[29]. La Rhinolophus rouxii a été testée positive pour la fièvre de Kyasanur, une fièvre hémorragique virale d’Inde, transmise à l’humain par piqûres de tiques. Le taux de mortalité est de 2 à 10 %. Le virus de Longquan, un genre d’hantavirus, a été détecté chez des rhinolophes fer de cheval asiatiques (R. sinicus, R. cornutus)[30].
Usages alimentaires et médicinaux
- Les rhinolophes consommés comme viande de brousse
Les médias se sont fait l’écho qu’à l’origine des épidémies de sida et d’Ebola se trouvait la consommation de viande de brousse en Afrique. Les virus VIH seraient ainsi passés du chimpanzé à l’humain, et ceux d’Ebola des Mégachiroptères (chauves-souris frugivores) à l’humain. Mais une étude globale de Mickleburgh et al. de 2009[31] a montré que la consommation de viande de brousse ne se limitait pas à l’Afrique tropicale et concernait aussi toute la zone tropicale de l’Ancien Monde : en particulier, des niveaux élevés de prélèvement de chauves-souris sont signalés dans toute l’Asie, les îles du Pacifique et de l’océan Indien occidental.
En Chine, avant l’épidémie de SRAS de 2002-2003, la consommation de viande de chauve-souris était répandue dans les provinces de la Chine du Sud : Guangdong, Guangxi, Sichuan, Hainan et le Sud-Ouest. Beaucoup de restaurants de Canton et des grandes villes du sud de la Chine (Guangdong, Guanxi) avaient les chauves-souris à leur menu. En outre, des chauves-souris vivantes étaient vendues dans les marchés de produits frais[31]. Dans les villages reculés, les gens ont l’habitude de capturer des chauves-souris pour les manger. Après l’épidémie de SARS, la Chine avait interdit la consommation et le commerce d’animaux sauvages, « avant de les réautoriser trois mois plus tard » nous indique Le Monde[32]. Lorsque Kerry Bowman, un bioéthicien canadien, a visité le marché de fruits de mer de Wuhan en 2017, il a dénombré la présence de 56 espèces animales vivantes dont les deux tiers étaient des espèces sauvages[33]. À la suite de la dernière émergence de coronavirus à Wuhan fin 2019, le gouvernement chinois a fait fermer 20 000 fermes d’élevages d’animaux sauvages, paons, civettes, porcs-épics, autruches, etc. Un rapport officiel de 2017 a évalué le secteur d’élevage de la faune sauvage à 520 milliards de yuans, soit 67 milliards d’euros[34]. Mettre fin à un secteur économique de cette importance, employant 14 millions de personnes, ne peut se faire sans efforts pour changer les croyances traditionnelles des gens et sans fournir des moyens alternatifs de subsistance[35].
Dans les autres pays d’Asie tropicale moins développés que la Chine, la chasse et le commerce de viande de brousse reste des activités marginales. En Birmanie, les chauves-souris Rhinolophus marshalli, sont vendues localement pour fournir quelques revenus d’appoint. La population de chauves-souris n’est pas menacée par la chasse. En Guinée, toutes les espèces de chauves-souris sont chassées dans les grottes pour la consommation ; les prélèvements de Rhinolophus maclaudi en Haute Guinée ont beaucoup augmenté. Toute la population de chauves-souris d’une grotte peut être décimée en une fois. En Nouvelle-Calédonie, la chasse aux chauves-souris est autorisée seulement les week-ends du mois d’avril, avec un maximum de 5 prises par personne et par jour[31].
- Remèdes traditionnels
La pharmacopée traditionnelle chinoise utilise depuis l’Antiquité, beaucoup de substances animales et continue de le faire malgré les dangers de contaminations par des agents infectieux et la menace qu’elle fait peser sur la survie des espèces sauvages utilisées (ex : rhinoceros). Le premier manuel de matière médicale, le Shennong bencao jing ou celui du très célèbre médecin du XVIe siècle, le Bencao gangmu de Li Shizhen, prônent l’utilisation d’excréments de chauves-souris (天鼠屎 Tiānshǔ shǐ) ou l’aile de chauve-souris (伏翼 fú yì)[36] - [37]. Li Shizhen examine les effets de chaque partie de l'animal : sa chair, son cerveau, son sang et sa bile, ses excréments. Certains morceaux considérés comme puissants (youdu) sont utilisés pour leurs effets thérapeutiques, d’autres non toxiques (wudu) servent plutôt dans les régimes diététiques, ce qui encourage leur consommation régulière.
La pharmacopée gréco-romaine de Dioscoride (Ier) qui fera référence en Europe pendant 1 500 ans, comporte des fiches sur 583 plantes médicinales, 84 animaux ou productions animales et 89 minéraux ou substances inorganiques. Aucune chauve-souris n’est mentionnée. Par contre dans l’Histoire naturelle de Pline[38], les chauves-souris sont mentionnées dans quelques sections sur des exemples « de tromperie des mages » qui « vantent aussi son sang, avec du cardon, parmi les principaux remèdes contre les morsures de serpents » (HN, XXIX, 83). Au XVIe siècle, le zoologue suisse Conrad Gesner, mentionne une onction d’huile de chauve-souris (bouillie avec du millepertuis, du beurre rance, de l’aristoloche et de l’huile de ricin) contre les rhumatismes[39]. Puis à partir du XVIIe siècle, avec les débuts de la chimie et de la biologie modernes, l’ouvrage de Dioscoride cessa d’être le manuel de référence pour la matière médicale européenne. L'objet de la recherche passa de la matière médicale aux principes actifs, de l'écorce de quinquina à la quinine, du pavot à la morphine.
La pharmacopée arabe la plus célèbre est de celle de Ibn al-Baitar (ca 1190-1248) ; elle énumère 1 400 matières médicales, prolongeant ainsi les nombreux remèdes de l’Antiquité gréco-romaine. Elle indique « une chauve-souris tuée et frottée sur la région pubienne d’un enfant empêche la croissance des poils. Cuite avec de l’huile de sésame, c’est une embrocation pour la sciatique... »[39]. La cervelle et le cœur de chauve-souris ont aussi leurs usages spécifiques.
La pharmacopée indienne de la médecine Yunâni reconnait 200 drogues d’origine animale dont la chauve-souris[39].
Noms vernaculaires

Quelques espèces ont un nom français.
Note : certaines espèces ont plusieurs noms.
- Grand fer à cheval - Rhinolophus ferrumequinum
- Grand rhinolophe[1]
- Grand rhinolophe fer à cheval[40]
- Grand rhinolophe obscure[40]
- Petit fer à cheval[41] - [42]
- Petit rhinolophe - Rhinolophus hipposideros[1]
- Petit rhinolophe fer à cheval[40]
- Rhinolophe de Blasius - Rhinolophus blasii[40]
- Rhinolophe euryale - Rhinolophus euryale
- Rhinolophe de Maclaud - Rhinolophus maclaudi[41]
- Rhinolophe de Mehely - Rhinolophus mehelyi[41]
- Rhinolophe de Roumanie - voir Rhinolophe de Mehely[41]
- etc.
Listes d'espèces
Espèces d'Europe
Toutes les espèces
Le système d'information taxonomique intégré (ITIS) liste les espèces suivantes[44] :
- Rhinolophus acuminatus Peters, 1871
- Rhinolophus adami Aellen & Brosset, 1968
- Rhinolophus affinis Horsfield, 1823
- Rhinolophus alcyone Temminck, 1853
- Rhinolophus arcuatus Peters, 1871
- Rhinolophus beddomei K. Andersen, 1905
- Rhinolophus belligerator Patrick, McCulloch & Ruedas, 2013
- Rhinolophus blasii Peters, 1867
- Rhinolophus bocharicus Kastschenko & Akimov, 1917
- Rhinolophus borneensis Peters, 1861
- Rhinolophus canuti Thomas & Wroughton, 1909
- Rhinolophus capensis Lichtenstein, 1823
- Rhinolophus celebensis K. Andersen, 1905
- Rhinolophus chiewkweeae Yoshiyuki & Lim, 2005
- Rhinolophus clivosus Cretzschmar, 1826
- Rhinolophus coelophyllus Peters, 1867
- Rhinolophus cognatus K. Andersen, 1906
- Rhinolophus cohenae Taylor, Stoffberg, Monadjem, Schoeman, Bayliss & Cotterill, 2012
- Rhinolophus convexus Csorba, 1997
- Rhinolophus cornutus Temminck, 1834
- Rhinolophus creaghi Thomas, 1896
- Rhinolophus damarensis Roberts, 1946
- Rhinolophus darlingi K. Andersen, 1905
- Rhinolophus deckenii Peters, 1868
- Rhinolophus denti Thomas, 1904
- Rhinolophus eloquens K. Andersen, 1905
- Rhinolophus euryale Blasius, 1853
- Rhinolophus euryotis Temminck, 1835
- Rhinolophus ferrumequinum (Schreber, 1774)
- Rhinolophus formosae Sanborn, 1939
- Rhinolophus fumigatus Rüppell, 1842
- Rhinolophus guineensis Eisentraut, 1960
- Rhinolophus hildebrandtii Peters, 1878
- Rhinolophus hilli Aellen, 1973
- Rhinolophus hillorum Koopman, 1989
- Rhinolophus hipposideros (Bechstein, 1800)
- Rhinolophus horaceki Benda & Vallo, 2012
- Rhinolophus huananus Wu, Motokawa & Harada, 2008
- Rhinolophus imaizumii Hill & Yoshiyuki, 1980
- Rhinolophus inops K. Andersen, 1905
- Rhinolophus kahuzi Fahr & Kerbis Peterhans, 2013
- Rhinolophus keyensis Peters, 1871
- Rhinolophus landeri Martin, 1838
- Rhinolophus lepidus Blyth, 1844
- Rhinolophus luctus Temminck, 1834
- Rhinolophus mabuensis Taylor, Stoffberg, Monadjem, Schoeman, Bayliss & Cotterill, 2012
- Rhinolophus maclaudi Pousargues, 1897
- Rhinolophus macrotis Blyth, 1844
- Rhinolophus madurensis K. Andersen, 1918
- Rhinolophus maendeleo Kock, Csorba & Howell, 2000
- Rhinolophus malayanus Bonhote, 1903
- Rhinolophus marshalli Thonglongya, 1973
- Rhinolophus mcintyrei Hill & Schlitter, 1982
- Rhinolophus megaphyllus Gray, 1834
- Rhinolophus mehelyi Matschie, 1901
- Rhinolophus microglobosus Csorba & Jenkins, 1998
- Rhinolophus mitratus Blyth, 1844
- Rhinolophus monoceros K. Andersen, 1905
- Rhinolophus montanus Goodwin, 1979
- Rhinolophus mossambicus Taylor, Stoffberg, Monadjem, Schoeman, Bayliss & Cotterill, 2012
- Rhinolophus nereis K. Andersen, 1905
- Rhinolophus osgoodi Sanborn, 1939
- Rhinolophus paradoxolophus (Bourret, 1951)
- Rhinolophus pearsonii Horsfield, 1851
- Rhinolophus philippinensis Waterhouse, 1843
- Rhinolophus proconsulis Hill, 1959
- Rhinolophus pusillus Temminck, 1834
- Rhinolophus rex G. M. Allen, 1923
- Rhinolophus robinsoni K. Andersen, 1918
- Rhinolophus rouxii Temminck, 1835
- Rhinolophus rufus Eydoux & Gervais, 1836
- Rhinolophus ruwenzorii J. Eric Hill, 1942
- Rhinolophus sakejiensis Cotterill, 2002
- Rhinolophus schnitzleri Wu & Thong, 2011
- Rhinolophus sedulus K. Andersen, 1905
- Rhinolophus shameli Tate, 1943
- Rhinolophus shortridgei K. Andersen, 1918
- Rhinolophus siamensis Gyldenstolpe, 1917
- Rhinolophus silvestris Aellen, 1959
- Rhinolophus simulator K. Andersen, 1904
- Rhinolophus sinicus K. Andersen, 1905
- Rhinolophus smithersi Taylor, Stoffberg, Monadjem, Schoeman, Bayliss & Cotterill, 2012
- Rhinolophus stheno K. Andersen, 1905
- Rhinolophus subbadius Blyth, 1844
- Rhinolophus subrufus K. Andersen, 1905
- Rhinolophus swinnyi Gough, 1908
- Rhinolophus tatar Bergmans & Rozendaal, 1982
- Rhinolophus thailandensis Wu, Harada & Motokawa, 2009
- Rhinolophus thomasi K. Andersen, 1905
- Rhinolophus trifoliatus Temminck, 1834
- Rhinolophus virgo K. Andersen, 1905
- Rhinolophus willardi Kerbis Peterhans & Fahr, 2013
- Rhinolophus xinanzhongguoensis Zou, Guillén-Servent, Lim, Eger, Wang & Jiang, 2009
- Rhinolophus yunanensis Dobson, 1872
- Rhinolophus ziama Fahr, Vierhaus, Hutterer & Kock, 2002
Annexes
Articles connexes
Liens externes
- (en) Référence Mammal Species of the World (3e éd., 2005) : Rhinolophus Lacépède, 1799
- (en) Référence Catalogue of Life : Rhinolophus Lacépède, 1799 (consulté le )
- (en) Référence Fauna Europaea : Rhinolophus Lacepede, 1799 (consulté le )
- (en) Référence Paleobiology Database : Rhinolophus Lacépède 1799
- (fr+en) Référence ITIS : Rhinolophus Lacépède, 1799
- (en) Référence Animal Diversity Web : Rhinolophus
- (en) Référence NCBI : Rhinolophus (taxons inclus)
- (fr+en) Référence CITES : genre Rhinolophus (sur le site de l’UNEP-WCMC)
Notes et références
Notes
Références
- Meyer C., Dictionnaire des Sciences Animales [On line], Cirad, Montpellier, France, (lire en ligne)
- Marc Gozlan, « Des coronavirus de chauves-souris très proches du SARS-CoV-2 identifiés au Laos », sur Réalités Biomédicales (consulté le )
- Georges-Louis Leclerc Buffon, contributeurs : Daubenton, Guéneau de Montbeillard, Lacépède, Brexon, Histoire naturelle, générale et particulière. Tome 13, Paris, (lire en ligne)
- Yves Tupinier, « Les tribulations des chauves-souris à travers les classifications », Publications de la Société Linnéenne de Lyon, vol. H-S 1, , p. 26-40 (lire en ligne)
- Malcolm C. McKenna, Susan K. Bell, Classification of Mammals : Above the Species Level, Columbia University Press, , 640 p. (lire en ligne)
- (en) Xiaoxu Lin et Shizhong Chen, « Major Concerns on the Identification of Bat Coronavirus Strain RaTG13 and Quality of Related Nature Paper », Nature, (DOI 10.20944/preprints202006.0044.v1, lire en ligne, consulté le ).
- (en) Sarah Temmam, Khamsing Vongphayloth, Eduard Baquero et Sandie Munier, « Bat coronaviruses related to SARS-CoV-2 and infectious for human cells », Nature, (ISSN 0028-0836 et 1476-4687, DOI 10.1038/s41586-022-04532-4, lire en ligne, consulté le ).
- (en) Smriti Mallapaty, « Dozens of unidentified bat species likely live in Asia — and could host new viruses », Nature, , d41586–022–00776-2 (ISSN 0028-0836 et 1476-4687, DOI 10.1038/d41586-022-00776-2, lire en ligne, consulté le )
- Terrence C. Demos, Paul W. Webala, [...], and Bruce D. Patterson, « Molecular phylogenetics of the African horseshoe bats (Chiroptera: Rhinolophidae): expanded geographic and taxonomic sampling of the Afrotropics », BMC Evolutionary Biology, vol. 19, (lire en ligne)
- Amador et al, « Bat systematics in the light of unconstrained analyses of a comprehensive molecular supermatrix », ournal of Mammalian Evolution, vol. 25,
- W. Bogdanowicz, R.D. Owen, « Phylogenetic analyses of the bat family Rhinolophidae », Z. zool. Syst. Evo1ut.-forsch, vol. 30, , p. 142-160 (lire en ligne)
- G. Csorba, P. Ujhelyi, N. Thomas, Horseshoe Bats of the World (Chiroptera : Rhinolophidae), Alana Books,
- Jonathan Kingdon, Mammals of Africa, Vol 4, Hedgehogs, Shrews and Bats, A & C Black,
- J. Haussser et al., Säugetiere der Schweiz / Mammifères de la Suisse : Mammiferi della Svizzera, Springer-Verlag, (lire en ligne)
- Dieter Vanderelst, Reijniers Jonas, Peremans Herbert, « The furrows of Rhinolophidae revisited », J R Soc Interface, vol. 7, no 9, , p. 2012 (lire en ligne)
- U. M. Norberg et J. M. V. Rayner, « Ecological Morphology and Flight in Bats (Mammalia; Chiroptera): Wing Adaptations, Flight Performance, Foraging Strategy and Echolocation », Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, vol. 316, no 1179, , p. 335-427
- Peng Zhou,... Shi Zhengli, « A pneumonia outbreak associated with a new coronavirus of probable bat origin », Nature, vol. 579, (lire en ligne)
- Marc Gozlan, « Des coronavirus de chauves-souris très proches du SARS-CoV-2 identifiés au Laos », sur lemonde.fr, Le Monde,
- Drosten C1, Günther S, Preiser W...Doerr HW, « Identification of a novel coronavirus in patients with severe acute respiratory syndrome. », N Engl J Med., vol. 348, no 20, (lire en ligne)
- Li Wendong, Shi Zhengli, M. Yu, C. Smith, J. E. Epstein et al, « Bats Are Natural Reservoirs of SARS-Like Coronaviruses », Science, vol. 310, no 5748,
- Hayes KH Luk, Xin Li, et al, « Molecular epidemiology, evolution and phylogeny of SARS coronavirus », Infection, Genetics and Evolution, vol. 71, , p. 21-30 (lire en ligne)
- Zaki AM, van Boheemen S, Bestebroer TM, Osterhaus AD, Fouchier RA., « Isolation of a novel coronavirus from a man with pneumonia in Saudi Arabia », N Engl J Med., vol. 367, no 19, (lire en ligne)
- Fan Yi, Kai Zhao, Shi Zhengli et Zhou Peng, « Bat Coronaviruses in China », Viruses, vol. 11, no 3,
- James Gorman, « How Do Bats Live With So Many Viruses? », The New York Times, vol. Janv 28,
- Xingyi Ge,... Peter Daszak, Zhengli Shi, « Isolation and characterization of a bat SARS-like coronavirus that uses the ACE2 receptor », Nature, vol. 503, , p. 535-538 (lire en ligne)
- Jane Qiu, « How China’s ‘Bat Woman’ Hunted Down Viruses from SARS to the New Coronavirus », Scientific American, vol. June, (lire en ligne)
- Stephen Chen, « Coronavirus: bat scientist’s cave exploits offer hope to beat virus ‘sneakier than Sars’ », South China Morning Post, vol. 6 Feb, (lire en ligne)
- Samantha Maiden, « Coronavirus: Chinese ‘batswoman’ scientist Shi Zhengli’s chilling prediction », The Daily Telegraph, vol. April 30, (lire en ligne)
- Lisa A. Beltz, Bats and Human Health : Ebola, SARS, Rabies and Beyond, John Wiley & Sons, , 416 p.
- Guo, Lin,... Zhang, « Phylogeny and Origins of Hantaviruses Harbored by Bats, Insectivores, and Rodents », PLoS Pathogens, vol. 9, no 2,
- Simon Mickleburgh, K. Waylen, P. Racey, « Bats as bushmeat : a global review », Oryx, vol. 43, no 2, , p. 217-234
- Sylvie Lemmet, Olivier Blond, Yann Arthus Bertrand, « Coronavirus : « La Chine a une responsabilité dans cette épidémie transmise par un animal sauvage interdit de commerce » », Le Monde, vol. 8 avril, (lire en ligne)
- Kerry Bowman (University of Toronto), « COVID-19 outbreak: How we deal with animals and the environment threatens human health » (consulté le )
- Michael Standaert, « Coronavirus closures reveal vast scale of China’s secretive wildlife farm industry », The Gardian, vol. 25 Feb, (lire en ligne)
- Jane Qiu, « How China’s “Bat Woman” Hunted Down Viruses from SARS to the New Coronavirus », Scientific American, vol. 27 April, (lire en ligne)
- (transl.) Sabine Wilms, The Divine Farmer’s Classic of Materia Medica, Happy Goat Productions, , 550 p.
- 張浩, 本草綱目, 元文創, (lire en ligne)
- Pline l'Ancien, Histoire naturelle (traduit, présenté et annoté par Stéphane Schmitt), Bibliothèque de la Pléiade, nrf, Gallimard, , 2131 p.
- Marco Riccucci, « Bats as materia medica : an ethnomedical review and implications for conservation », Vespertilio, vol. 16, , p. 249-270
- (en) Derwent, Thesaurus of agricultural organisms: pests, weeds and diseases, Volume 1. Derwent Publications, Ltd. Éditions CRC Press, 1990. 1529 pages. (ISBN 0-412-37290-8), 9780412372902. Rechercher dans le document numérisé. Consulté en mai 2010.
- (en) Murray Wrobel, 2007. Elsevier's dictionary of mammals: in Latin, English, German, French and Italian. Elsevier, 2007. (ISBN 0-444-51877-0), 9780444518774. 857 pages. Rechercher dans le document numérisé. Consulté en mai 2010.
- Petit fer à cheval sur Animaux.org
- Les chauves-souris d'Europe sur le site du Museum d'histoire naturelle de Bourges consulté en novembre 2010.
- ITIS Report, « Rhinolophus Lacépède, 1799 » (consulté le )
_2.jpg.webp)