Rhinolophus sinicus
Chauve-souris rousse chinoise en fer à cheval

| Règne | Animalia |
|---|---|
| Embranchement | Chordata |
| Sous-embr. | Vertebrata |
| Classe | Mammalia |
| Sous-classe | Placentalia |
| Ordre | Chiroptera |
| Famille | Rhinolophidae |
| Sous-famille | Rhinolophinae |
| Genre | Rhinolophus |
Répartition géographique
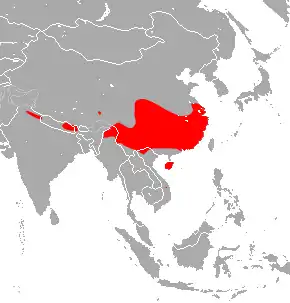
La Chauve-souris rousse chinoise en fer à cheval (Rhinolophus sinicus) est une espèce de chiroptères, de la famille des Rhinolophidae, vivant en Asie[1] et réservoir naturel de coronavirus et source de zoonoses.
Taxonomie
Rhinolophus sinicus fut décrit comme une sous-espèce de Rhinolophus rouxi par Anderson en 1905. Il a été élevé au rang d'espèce sur la base de 23 mesures morphologiques des crânes de R. sinicus provenant de Hainan, Guangdong, Chuanyu (Sichuan et Chongqing)[2].
Description
Rhinolophus sinicus est facilement confondue avec R. affinis, dont elle se distingue le mieux par sa lancette à bord droit et une seconde phalange relativement courte (<66% de la longueur du métacarpien: Csorba et al.[3], 2003) et surtout sa répartition géographique.
Cette espèce est de taille moyenne, semblable à celle de R. rouxii ou de R. thomasi, mais avec des ailes relativement plus longues que celles de rouxii[4]. Le crâne est massif. Les oreilles sont petites. La queue fait 19,5 à 30 mm[3]
- Ailes : la seconde phalange du troisième doigt est plus petite ou proche de 1,5 fois la taille de la première phalange, la membrane alaire s’attache au talon, les métacarpes sont longs, le 3e d’environ 33-38 mm.
- Feuilles nasales[n 1] : chaque côté de la feuille nasale en fer à cheval a une adhérence, la largeur de cette feuille nasale est de 8-9,2 mm, les marges latérales de la selle sont parallèles et l’extrémité arrondie. Le fer de lance est relativement pointu.
- Denture : la canine supérieure est bien développée, plus grande que la prémolaire postérieure (P4), la petite prémolaire (P2) de la mâchoire supérieure est non alignée.
- Fourrure : est semblable à la phase sombre de R. rouxii, les poils baso-dorsaux sont blanc brunâtre, les pointes des poils brun rougeâtre et le ventre blanc brunâtre.
Aire naturelle de répartition
Habitats
Selon une modélisations construite à partir de donnés acquises dans les montagnes de Wuling par télédétection et une analyse des facteurs prédictifs de distribution biogéographie de R. sinicus, les principaux facteurs prédictifs étaient dans cette région le degré de pente, la température moyenne annuelle et la distance aux routes, aux cours d'eau et aux terrains résidentiels[5].
Ce chiroptère a une préférence marquée pour les zones à la fois éloignées des routes et des zones résidentiels et proches de cours d'eau. Elle semble aussi apprécier les fortes pentes et des températures moyennes annuelles plus élevées[5].
Pour la survie et la reproduction des populations de cette espèce, les auteurs de cette modélisation recommandent de protéger les zones humides entourant ses habitats naturels et d'y limiter les activités humaines[5].
Sous-espèces
- R. s. septentrionalis, Sanborn, 1939, petite zone de la province du Yunnan
- R. s. sinicus, Anderson 1905, Himalaya, Vietnam du Nord, Chine (Anhui, Zhejiang, Jiangsu, Hubei, Guangdong, Guizhou, Xizang, Fujan, Sichuan).
Sous-groupes « culturels » ?
Après avoir largement échantillonné les signaux ultrasoniques de R. sinicus dans toute la Chine et au Vietnam, des chiroptérologues et éthologues ont constaté au sein de cette espèce des différences géographiques aux signaux acoustiques, ce qui pourrait traduire une dérive génétique et/ou résulter de facteurs de sélection naturelle[6].
L'écholocation est un trait phénotypique qui joue chez les chiroptères un rôle dans l'organisation sociale et la reconnaissance des individus et des espèces. Les enregistrements d'ultrasons de nombreux individus de diverses origines géographiques ont permis de reconstruire une phylogénie au sein de l'espèce ; ils ont aussi permis de montrer que la fréquence de repos des appels variait selon la latitude, le sexe et la distance aux emplacements de colonies[6]. Ces variations de fréquences ne semblent pas corrélées à la distance génétique (mesurée sur un seul locus nucléaire et le locus mitochondrial), ni aux facteurs climatiques (température et précipitions annuelles moyennes), ni à la taille de l'individu, même si la différence dans les cris augmentent avec la distance séparant les différentes populations étudiées[6].
Les auteurs en concluent qu'une « dérive culturelle » pourrait mieux expliquer ces différences géographiques qu'une dérive génétique et que l'adaptation acoustique de l'espèce à ses divers types d'habitats[6].
État des populations, pressions, menaces
Rhinolophus sinicus n'est pas considérée en tant qu'espèce en situation préoccupante, selon la Liste rouge des espèces menacées (UICN) car sa distribution est assez large et car elle est encore localement commune en Asie du Sud-Est.
L'espèce ne figure pas sur la liste des espèces protégée de la République populaire de Chine (législation sur la protection de la faune sauvage en 1989)[7].
Aspects écoépidémiologiques
Cette espèce est considérée susceptible de jouer un rôle écoépidémiologique important, en tant qu'espèce-réservoir d'une grande diversité d'espèces et de souches de virus du genre coronavirus, dont certaines sont identiques ou proches des coronavirus humains[8] - [9] - [10] - [11], notamment en raison d'un récepteur (l'ACE2, ou Enzyme de conversion de l'angiotensine 2), récepteur biochimiquement très proche de celui que le virus cible chez l'humain et d'autres mammifères[12]. D’après la base de données Virus-Hôtes, le R. sinicus hébergerait 11 types de virus différents : des circovirus, mastadenovirus, picornavirus, et coronavirus liés au SARS[13]. Le génome complet de ces virus sont connus et stockés.
L'épidémies de SRAS (2002-2003) a lancé une recherche du réservoir naturel du coronavirus en cause. A cette occasion de nombreux alphacoronavirus et bétacoronavirus ont été trouvés chez des chauves-souris sur toute la planète, montrant que les chauves-souris sont probablement le réservoir naturel de ce deux catégories (alpha- et béta- coronavirus), peut être en raison de la diversité et de la distribution mondiale des chiroptères[14]. Rhinolophus sinicus fait partie des espèces concernées. Les coronavirus ont ainsi été inventoriés de 2012 à 2013 dans le contexte anthropique d'un puits de mine abandonné du comté de Mojiang (province du Yunnan, Chine) utilisé comme habitat par six espèces différentes de chauves-souris, fréquemment détectées dans la grotte (Rhinolophus sinicus, Rhinolophus affinis, Hipposideros pomona, Miniopterus schreibersii, Miniopterus fuliginosus et Miniopterus fuscus) ; un groupe diversifié de coronavirus a été trouvé dans ces différentes espèces. A cette occasion, deux bétacoronavirus encore non-classés ont été trouvés et même une nouvelle souche de coronavirus de type SRAS ainsi qu'une espèce potentiellement nouvelle de bétacoronavirus[14]. A noter aussi qu'une co-infection par plusieurs coronavirus a été détectée chez des individus de ces six espèces de chauves-souris, favorisant a priori la recombinaison virale et donc l'émergence de nouvelles souches virales. Ce travail a confirmé que les chiroptères sont un réservoir naturel de coronavirus et source potentiellement zoonotique d'agents pathogènes viraux[14].
Au début de la pandémie de maladie à coronavirus de 2019-2020, ce Rhinolophe a été suspecté d'être le réservoir du nouveau virus SARS-CoV-2, cause de la Covid-19[15], mais il s'est ensuite avéré que le Pangolin abritait un virus, le GDP2S dont la protéine virale de reconnaissance cellulaire de l'hôte présente 99 % de similitudes avec le nouveau virus humain. La similitude totale des viromes étant entre 75 et 82% entre le SARS-COV-2 et des coronavirus de pangolins, un animal couramment braconné en Asie et vendu sous le manteau en Chine[16]. Le SARS-CoV-2 pourrait néanmoins avoir un ancêtre commun à la souche infectant le Pangolin et aux souches pandémiques qui se sont répandues sur la planète fin 2019 et en 2020.
Notes
- voir les descriptions et schéma à la page Rhinolophe#Morphologie
Références
- Xiuguang Mao, Guimei He, Junpeng Zhang et Stephen J. Rossiter, « Lineage Divergence and Historical Gene Flow in the Chinese Horseshoe Bat (Rhinolophus sinicus) », PLoS ONE, vol. 8, no 2, (ISSN 1932-6203, PMID 23451086, PMCID 3581519, DOI 10.1371/journal.pone.0056786, lire en ligne, consulté le ).
- Xu, W., Zhou, Z., Zhang, J., Wu, Y., Li, Y., & Hu, J. (2005) Study on geographical variations of skull morphology of {\sl Rhinolophus sinicus}. Sichuan journal of zoology, 24(4), 469-472. (résumé)
- G. Csorba, P. Ujhelyi, N. Thomas, Horseshoe Bats of the World (Chiroptera : Rhinolophidae), Alana Books,
- Andrew T. Smith, Yan Xie, Robert S. Hoffmann, Darrin Lunde, John MacKinnon, Don E. Wilson, W. Chris Wozencraft, A Guide to the Mammals of China, Princeton University Press,
- Liang, L., Luo, X., Liu, Z., Wang, J., Huang, T., & Li, E. (2019). Habitat selection and prediction of the spatial distribution of the Chinese horseshoe bat (R. sinicus) in the Wuling Mountains. Environmental monitoring and assessment, 191(1), 4 (résumé)
- Xie, L. F., Sun, K. P., Jiang, T. L., Liu, S., Lu, G. J., Jin, L. R., & Jiang, F. (2017). The effects of cultural drift on geographic variation in echolocation calls of the Chinese rufous horseshoe bat (Rhinolophus sinicus). Ethology, 123, 532–541 ().
- Sun K., « Rhinolophus sinicus. Liste rouge de l'UICN des espèces menacées 2019: »
- Junfa Yuan, Chung-Chau Hon, Yan Li et Dingming Wang, « Intraspecies diversity of SARS-like coronaviruses in Rhinolophus sinicus and its implications for the origin of SARS coronaviruses in humans », Journal of General Virology,, vol. 91, no 4, , p. 1058–1062 (ISSN 0022-1317, DOI 10.1099/vir.0.016378-0, lire en ligne, consulté le )
- Lau, S. K., Feng, Y., Chen, H., Luk, H. K., Yang, W. H., Li, K. S.,... & Fan, R. Y. (2015). Severe acute respiratory syndrome (SARS) coronavirus ORF8 protein is acquired from SARS-related coronavirus from greater horseshoe bats through recombination. Journal of virology, 89(20), 10532-10547.
- Yang, X. L., Hu, B., Wang, B., Wang, M. N., Zhang, Q., Zhang, W.,... & Wang, L. F. (2016). Isolation and characterization of a novel bat coronavirus closely related to the direct progenitor of severe acute respiratory syndrome coronavirus. Journal of virology, 90(6), 3253-3256.
- Yuan, J., Hon, C. C., Li, Y., Wang, D., Xu, G., Zhang, H.,... & Poon, L. L. Lam 509 TT, Leung FC, Shi Z. (2010) Intraspecies diversity of SARS-like 510 coronaviruses in Rhinolophus sinicus and its implications for the origin of 511 SARS coronaviruses in humans. J Gen Virol, 91, 1058-1062.
- GAO-Jun, X. X., & Hong-guang, X. I. A. O. (2009) Amplification and cloning of angtiotension-coverting enzyme 2 gene from Rhinolophus sinicus by RACE Technique. China Tropical Medicine, (4),6 (résumé).
- Virus-Host DB, « Rhinolophus sinicus » (consulté le )
- (en) Xing-Yi Ge, Ning Wang, Wei Zhang et Ben Hu, « Coexistence of multiple coronaviruses in several bat colonies in an abandoned mineshaft », Virologica Sinica, vol. 31, no 1, , p. 31–40 (ISSN 1995-820X, DOI 10.1007/s12250-016-3713-9, lire en ligne, consulté le )
- Xiuguang Mao, Guimei He, Junpeng Zhang et Stephen J. Rossiter, « Lineage Divergence and Historical Gene Flow in the Chinese Horseshoe Bat (Rhinolophus sinicus) », PLoS ONE, vol. 8, no 2, (ISSN 1932-6203, PMID 23451086, PMCID 3581519, DOI 10.1371/journal.pone.0056786, lire en ligne, consulté le )
- Hervé Morin, « Coronavirus : le Pangolin a-t-il pu servir d’hôte intermédiaire ? », Le Monde, (lire en ligne, consulté le ) ; d'après Chine nouvelle, l'agence de presse officielle, le .
- (en) Référence UICN : espèce Rhinolophus sinicus (consulté le )
Voir aussi
Bibliographie
- Mao, X., Tsagkogeorga, G., Bailey, S. E., & Rossiter, S. J. (2017). Genomics of introgression in the Chinese horseshoe bat (Rhinolophus sinicus) revealed by transcriptome sequencing. Biological Journal of the Linnean Society, 121(3), 698-710.
- Sun, H., Dong, J., Shi, H., Ren, M., & Hua, P. (2016) The complete mitochondrial genome of a Chinese rufous horseshoe bat subspecies, Rhinolophus sinicus sinicus (Chiroptera: Rhinolophidae). Mitochondrial DNA Part A, 27(5), 3301-3302.
- Xie, L., Sun, K., Jiang, T., Liu, S., Lu, G., Jin, L., & Feng, J. (2017) The effects of cultural drift on geographic variation in echolocation calls of the Chinese rufous horseshoe bat (Rhinolophus sinicus). Ethology, 123(8), 532-541 (résumé).
- Xie, L. F., Sun, K. P., Jiang, T. L., Liu, S., Lu, G. J., Jin, L. R., & Jiang, F. (2017). The effects of cultural drift on geographic variation in echolocation calls of the Chinese rufous horseshoe bat (Rhinolophus sinicus). Ethology, 123, 532–541 ().