Nobilétine
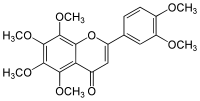
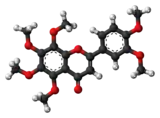
La nobilétine est un composé de la famille des flavones. C'est plus précisément une flavone O-methylée (flavone polymethoxylatée ou PMFs, synonyme 3',4',5,6,7,8-Hexamethoxyflavone) que l'on trouve dans l'écorce de certains fruits du genre Citrus[3].
| Nobilétine | ||
| ||
 | ||
| Identification | ||
|---|---|---|
| Nom UICPA | 2-(3,4-diméthoxyphényl)-5,6,7,8-tétraméthoxychromèn-4-one | |
| No CAS | ||
| PubChem | 72344 | |
| SMILES | ||
| InChI | ||
| Propriétés chimiques | ||
| Formule | C21H22O8 [Isomères] |
|
| Masse molaire[1] | 402,394 6 ± 0,020 7 g/mol C 62,68 %, H 5,51 %, O 31,81 %, |
|
| Propriétés physiques | ||
| T° fusion | 135,5 °C[2] | |
| Unités du SI et CNTP, sauf indication contraire. | ||
Elle est présente à un niveau élevé dans des petits agrumes coréens et japonais (Iles Ryūkyū) ce qui a suscité de nombreuses études coréennes et japonaises sur ses effets sur la santé. Très tôt ses capacités bioactives (fongicide) ont été montrées chez les agrumes, plus tard chez l'humain où son action antioxydante et anti-inflammatoire prévient et améliore certaines pathologies dégénératives. Comme la flavanone, la tangéritine, la 6-hydroxyflavanone et la 7-hydroxyflavone, elle a une faible solubilité[4] qui limite sa biodisponibilité, diverses méthodes sont proposées pour le pallier[5] - [6], dont l'obtention de nobilétine très pure depuis l'huile essentielle de shikuwasa, de mandarine[7] ou en émulsion dans des l'huile essentielle de bergamote par exemple[8]. Une méthode de conservation a été testée avec succès au Japon en 2022: la dispersion solide nanocristalline par broyage humide du zeste suivi d'une lyophilisation, les auteurs ont testé la biodisponibilité orale du résidu et montrent que cette méthode accroit notablement le potentiel nutraceutique[9].
Histoire
La nobilétine a été isolée et nommée en 1938 comme nouvelle hexaméthoxy-flavonone par un scientifique chinois Kwong-Fong Tseng[10], qui l'a isolé en utilisant du méthanol froid depuis le chenpi mandarine chinoise cultivar Chunking (Robinson et Tseng, 1938)[11], dont le nom botanique usuel était Citrus nobilis, Lour[12] à l'époque d'où son nom: nobilis > nobilétine[13].
Une action fongicide chez les agrumes est publiée en 1967[14] puis en 1971 sur Deuterophoma tracheiphila[15]. En 1998, l'action fongicide est étendue à Phytophthora citrophthora, Penicillium digitatum et aux Geotrichum[16].
En 2012, une activité bactéricide a été démontrée in vitro sur Pseudomonas fluorescens et Pseudomonas aeruginosa[17].
Présence chez les agrumes
Présence dans le péricarpe
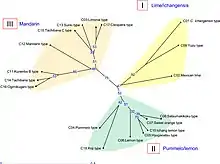
La nobilétine n'est pas présente dans le péricarpe (flavédo ou exocarpe et l'albédo ou mésocarpe) de tous les agrumes et l'est inégalement chez divers cultivars d'agrumes (mesurée en poids : mg/g). Yiochi Nogata et al. (2006) donnent des concentrations maximales dans les flavédos des mandarines Dancy (50 ‰), Shikaikan C. suhuiensis (31,5 ‰), Tachibana (23 ‰), Ponkan (19 ‰) alors que la clémentine n'est qu'à (1,4 ‰), mais aussi chez la bigarade C. shunkokan (14 ‰). Le flavédo des citrons et des limes n'en contiennent pas[19].
Les mesures coréennes (2006) donnent la même tableau d'ensemble avec des écarts, elle est fortement présente chez une tangerine Sunki, qui est le Jinguang (陳橘 (jingyul) coréen (16,4 ‰) et chez le shikuwasa (Citrus depressa) 15,6 ‰ (il est à 12,2 ‰ dans la publication japonaise), Citrus tachibana 15,2 ‰, moyennement chez certains hybrides comme le coréen Byeonggyul (Citrus platymamma) (11,1 ‰), Setoka (9,2 ‰), Dekopon (8,3 ‰), la Koji (Citrus leiocarpa) (7,9 ‰) faiblement chez les autres mandarines (autour de 4 ‰), le yuzu (2,1 ‰), et enfin faible ou indétectable chez les autres agrumes mesurés[20]. Elle est donnée présente dans l'huile essentielle de bergamote[21], d'orange douce (qui est un hybride de C. nobilis) et de mandarine, à des niveaux variables selon la couleur du fruit et la méthode d'extraction[22]. Dans la dernière synthèse disponible (2022) les auteurs écrivent «la nobilétine n'est pas présente chez les espèces Fortunella et Poncirus»[23].
Ces résultats ont conduit à des recherches sur la valorisation du shikuwasa comme source de nobilétine, elles ont montré :
- que le prétraitement des peaux par ultrason pendant plusieurs minutes donne un rendement plus élevée de flavonoïdes totaux par rapport au prétraitement aux micro-ondes et à la combinaison des deux méthodes ;
- des différences importantes dans la teneur en flavonoïdes selon la maturité du fruit. Les teneurs en flavonoïdes les plus élevées ont été obtenues à partir d'extraits de peau verte de shikuwasa, bien davantage que chez le fruit mûr jaune (couramment utilisé dans les huiles essentielles japonaises)[24].
Présence dans la pulpe et le jus
La présence dans la pulpe du fruit est très faible à indétectable mis à part le shikuwasa (Citrus depressa) où elle atteint 0,25 ‰[25]. La teneur en nobilétine (et autres flavones polyméthoxylées) du jus de shikuwasa est d'autre part stable et indifférente à la méthode d'extraction, ce jus put se conserver jusqu'à 3 mois à 5°C[26].
Présence dans d'autres plantes
Le nobilétine est aussi présente dans le racines d'arisème (Arisaema franchetianum)[27] et chez Ageratum conyzoides[28], chez Conoclinium coelestinum (Asteraceae)[29]. On en trouve des traces à la surface des fruits tels le raisin[30].
Pharmacologie
La nobilétine est un antioxydant et un anti-inflammatoire naturel qui fait l'objet de nombreuses recherches.
Action sur le cerveau, le métabolisme humain, la dégénérescence articulaire
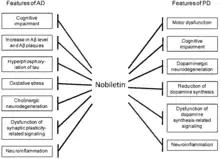
Comme d'autres PMF, la nobilétine a des effets bénéfiques sur la fonction cognitive dans de nombreux modèles expérimentaux (maladie d'Alzheimer, la maladie de Parkinson et la démence[31]) par son action sur le stress oxydatif, la neuro-inflammation et l'amélioration de la plasticité synaptique.
L'extrait de zeste d'agrumes riche en nobiletine améliore la fonction cognitive humaine (étude réalisée avec le ノビレックス Nobilex® qui contient notamment des extraits secs de zeste de C. depressa): amélioration de la mémoire à court terme, de l'attention, de la capacité de calcul et de l'expression chez les participants âgées de 60 à 85 ans. Les effets antioxydants et anti-inflammatoires préviennent la démence sénile (démonstration en modèle murin en 2014[32]).
La nobilétine et l'hespéridine affectent le métabolisme de la glycémie et des lipides via l'activation des voies de signalisation AMPK et PPARγ[23]. La nobilétine régulerait à la hausse la transmission synaptique via les récepteurs AMPA post-synaptiques au moins partiellement par stimulation de la phosphorylation du récepteur GluR1 dans l'hippocampe (2007)[33].
Dégénérescence osseuse et articulaire
A. R. Sharma et al. (2023) écrivent « Les flavonoïdes, à savoir le kaempférol, la nobiletine, l'icaridine et la myricétine, ciblent le récepteur de la protéine morphogénétique osseuse » et signalent un potentiel de prévention de l'ostéoporose[34].
Dans un essai clinique chez des patients souffrant d'arthrose, l'extrait aqueux des feuilles de Ageratum conyzoides (riche en nobilétine) a montré une réduction substantielle de la douleur chronique et une amélioration de la mobilité articulaire (2015)[35]. La description des mécanismes d'action des flavones dont la nobilétine avait été passée en revue en 2012, dès 2008 on savait que la nobilétine réprime l'induction par l'IL-1 de MMP9 dans les cellules synoviales, qu'elle est active dans les chondrocytes, quelle inhibe les aggrécanases ADAMTS4 et ADAMTS5[36] actives sur des composants des tissus conjonctifs du cartilage[37].
Elle est admise comme un appoint utile en association dans les thérapies standards des polyarthrite rhumatoïde, arthrose et d'autres maladies inflammatoires et immunitaires (2012)[38].
4′-déméthylnobilétine
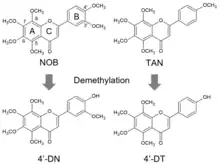
La nobilétine déméthylée en 4′-déméthylnobilétine inhibe plus activement que la nobilétine simple la différenciation et la fonction des ostéoclastes résorbant les os, in vitro et en modèle murin. Les chercheurs japonais (2023) y voient un candidat - seule ou en association avec la 4′-déméthyltangérétine - pour la prévention des maladies osseuses métaboliques (ostéoporose)[39].
Médicaments auto-microémulsifiants
La nobilétine est un modèle dans le cadre de la mise au point des systèmes de médicaments auto-microémulsifiants qui répondent au besoin d'administration orale des médicaments. Sa solubilité dans l'eau est extrêmement faible (estimée à 13,39 mg/l à 25 °C[40]) d'où une faible biodisponibilité par voie orale (la concentration maximale après administration orale est comprise entre 8 et 10 h. alors qu'elle est de 6 à 8 h après l'injection[41]). Son administration transdermique est possible à l'aide de choline et d'acide géranique[42]. En 2012, une équipe mexicaine montre qu'il est possible d'encapsuler la nobilétine dans des nanoparticules de chitosane[43]. Elle est utilisée comme bioactifs hydrophobes modèle dans la conception de médicaments auto-nanoémulsifiants visant à améliorer la bioaccessibilité des substances peu solubles[44] sous forme de nano-émulsions encapsulées[45]. L'efficience de ces auto-microémulsions à la nobilétine a été mesurée au niveau de la perméabilité intestinale qui se trouve améliorée[46].
Des traitements de la polyarthrite rhumatoïde réfractaire par administration de médicament auto-nanoémulsifiant à base de nobilétine sont efficaces[47].
Autres actions mises en évidence in-vitro ou en modèle murin

Dans ce cadre expérimental, on note des actions inhibitrices de la propagation des métastases tumorales[48] - [49] - [50], une action inhibitrice de la dermatite aux UV érythème cutané[51], une action inhibitrice de l'hépatite[52], etc.
Il a également été rapporté qu'elle avait pour effet de supprimer la dégradation du cartilage chez l'animal et procure des bénéfices sanitaires, physiologiques ou fonctionnels sur l'arthrose[53], réduit la résorption osseuse source notamment de l'ostéoporose et de la polyarthrite rhumatoïde[54].
Chez le rat, la nobilétine supprime l'apoptose des cellules pancréatiques induite par le stress résultant de l'exposition chronique élevée au glucose (2022)[55]. L'action hépatoprotectrice de la nobilétine a été décrite chez la souris : la ferroptose hépatique et l'inflammation se fait par une action sur le microbiote intestinale (2023)[56].
Xuekai Xiong et al. (2023) ont montré chez la souris que la nobilétine agit sur l'horloge circadienne et via l'activation d'un Wnt qu'elle contrôle affiche des propriétés anti-adipogéniques, l'administration de nobiletine à la souris obèse provoque une perte importante de masse grasse et une perte de poids, elle inhibe la maturation des préadipocytes primaires[57].
Toxicité
Les publications sont rares. Une évaluation de la génotoxicité et de la toxicité subchronique de l'extrait de peau du ponkan Ohta chez le rat a été publiée en 2020. Les auteurs n'observent aucune activité mutagène, aucune génotoxicité, avec la dose forte (540 mg/j et par kg de poids corporel), elle engendre la néphropathie des gouttelettes d'hyalines (phénomène spécifique du rat adulte) sans qu'aucun autre effet indésirable n'ait été observé dans l'étude de 90 jours[58].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) N Mak, « Isolation of anti-leukemia compounds from Citrus reticulata », Life Sciences, vol. 58, no 15, , p. 1269-1276 (DOI 10.1016/0024-3205(96)00088-4).
- (en) Antonio Montanari, Jie Chen et Wilbur Widmer, « Citrus Flavonoids: A Review of Past Biological Activity Against Disease », dans Flavonoids in the Living System, Springer US, (ISBN 978-1-4615-5335-9, DOI 10.1007/978-1-4615-5335-9_8), p. 103–116.
- (en) Masaki Ota, Megumi Sato, Yoshiyuki Sato et Richard L. Smith, « Measurement and correlation of flavanone, tangeritin, nobiletin, 6-hydroxyflavanone and 7-hydroxyflavone solubilities in supercritical CO2 », The Journal of Supercritical Fluids, vol. 128, , p. 166–172 (ISSN 0896-8446, DOI 10.1016/j.supflu.2017.05.024, lire en ligne, consulté le )
- (en) Lingling Lei, Yazhen Zhang, Lingling He et Shan Wu, « Fabrication of nanoemulsion-filled alginate hydrogel to control the digestion behavior of hydrophobic nobiletin », LWT - Food Science and Technology, vol. 82, , p. 260–267 (ISSN 0023-6438, DOI 10.1016/j.lwt.2017.04.051, lire en ligne, consulté le )
- (en) Shyi-Neng Lou, Yu-Shan Lin, Ya-Siou Hsu et E-Ming Chiu, « Soluble and insoluble phenolic compounds and antioxidant activity of immature calamondin affected by solvents and heat treatment », Food Chemistry, vol. 161, , p. 246–253 (ISSN 0308-8146, DOI 10.1016/j.foodchem.2014.04.009, lire en ligne, consulté le )
- (en) Marina Russo, Francesca Rigano, Adriana Arigò et Danilo Sciarrone, « Rapid isolation, reliable characterization, and water solubility improvement of polymethoxyflavones from cold-pressed mandarin essential oil: Liquid Chromatography », Journal of Separation Science, vol. 39, no 11, , p. 2018–2027 (DOI 10.1002/jssc.201501366, lire en ligne, consulté le )
- (en) Rujun Wei, Shaojie Zhao, Liping Feng et Guifang Tian, « Influence of triacylglycerol on the physical stability and digestion fate of triacylglycerol–bergamot mixed-oil emulsions with nobiletin », LWT, vol. 144, , p. 111253 (ISSN 0023-6438, DOI 10.1016/j.lwt.2021.111253, lire en ligne, consulté le )
- (en) Atsushi Uchida, Kayo Yuminoki, Naofumi Hashimoto et Hideyuki Sato, « Novel nano-crystalline solid dispersion of nobiletin with improved dissolution behavior and oral absorption », Journal of Drug Delivery Science and Technology, , p. 104013 (ISSN 1773-2247, DOI 10.1016/j.jddst.2022.104013, lire en ligne, consulté le )
- (en) Poonam Jaglan et Harpal S. Buttar, « Nobiletin Prevents Obesity-Related Complications and Neurological Disorders: An Overview of Preclinical and Clinical Studies », International Journal of Scientific Research in Engineering and Management (IJSREM), vol. 7, no 2, , p. 23 (lire en ligne [PDF])
- (en) Robert Robinson et Kwong-Fong Tseng, « 191. Nobiletin. Part II », Journal of the Chemical Society (Resumed), no 0, , p. 1004–1006 (ISSN 0368-1769, DOI 10.1039/JR9380001004, lire en ligne, consulté le )
- « CITRUS NOBILIS », sur sites.unice.fr (consulté le )
- (en) Henry Lester Institute of Medical Research Division of Physiological Sciences, Collected Papers, (lire en ligne)
- (en) A. Ben-Aziz, « Nobiletin Is Main Fungistat in Tangerines Resistant to Mal Secco », Science New Series, Vol. 155, No. 3765, , p. 1026-1027 (2 p.) (lire en ligne).
- M. Piattelli et G. Impellizzeri, « Fungistatic flavones in the leaves of citrus species resistant and susceptible to deuterophoma tracheiphila », Phytochemistry, vol. 10, no 11, , p. 2657–2659 (ISSN 0031-9422, DOI 10.1016/S0031-9422(00)97261-3, lire en ligne, consulté le )
- (en) J. A. Del Río, M. C. Arcas, O. Benavente-García et A. Ortuño, « Citrus Polymethoxylated Flavones Can Confer Resistance against Phytophthora citrophthora , Penicillium digitatum , and Geotrichum Species », Journal of Agricultural and Food Chemistry, vol. 46, no 10, , p. 4423–4428 (ISSN 0021-8561 et 1520-5118, DOI 10.1021/jf980229m, lire en ligne, consulté le ).
- (en) Xiaolin Yao, Xinrong Zhu, Siyi Pan et Yapeng Fang, « Antimicrobial activity of nobiletin and tangeretin against Pseudomonas », Food Chemistry, 6th International Conference on Water in Food, vol. 132, no 4, , p. 1883–1890 (ISSN 0308-8146, DOI 10.1016/j.foodchem.2011.12.021, lire en ligne, consulté le )
- (en) Tokurou Shimizu, Akira Kitajima, Keisuke Nonaka et Terutaka Yoshioka, « Hybrid Origins of Citrus Varieties Inferred from DNA Marker Analysis of Nuclear and Organelle Genomes », PLOS ONE, vol. 11, no 11, , e0166969 (ISSN 1932-6203, PMID 27902727, PMCID PMC5130255, DOI 10.1371/journal.pone.0166969, lire en ligne, consulté le )
- (en) Yoichi NOGATA, Koji SAKAMOTO, Hiroyuki SHIRATSUCHI, Toshinao ISHII, Masamichi YANO, Hideaki OHTA, « Flavonoid Composition of Fruit Tissues of Citrus Species », Bioscience, biotechnology, and biochemistry v.70 no.1, , pp. 178-192 (lire en ligne)
- (ko-Hani) Kim Se-jae (Jeju National University Industry-University Cooperation Foundation Jeju National University), « 항염활성을 갖는 감귤 유래 노빌레틴과 그 분리.정제방법 Nobilétine dérivée d'agrumes ayant une activité anti-inflammatoire et sa méthode d'isolement et de purification », Office coréen de la propriété intellectuelle Publication de brevet enregistrée, , p. 32 (lire en ligne)
- (en) Paola Donato, Ivana Bonaccorsi, Marina Russo et Paola Dugo, « Determination of new bioflavonoids in bergamot (Citrus bergamia) peel oil by liquid chromatography coupled to tandem ion trap-time-of-flight mass spectrometry: New bioflavonoids in bergamot oil », Flavour and Fragrance Journal, vol. 29, no 2, , p. 131–136 (DOI 10.1002/ffj.3188, lire en ligne, consulté le )
- (en) Paola Dugo, Luigi Mondello, Eugenia Cogliandro et Ildefonsa Stagno d'Alcontres, « On the genuineness of citrus essential oils. Part XLVI. Polymethoxylated flavones of the non-volatile residue of Italian sweet orange and mandarin essential oils », Flavour and Fragrance Journal, vol. 9, no 3, , p. 105–111 (DOI 10.1002/ffj.2730090304, lire en ligne, consulté le )
- (en) Kentaro Matsuzaki, Akira Nakajima, Yuanqiang Guo et Yasushi Ohizumi, « A Narrative Review of the Effects of Citrus Peels and Extracts on Human Brain Health and Metabolism », Nutrients, vol. 14, no 9, , p. 1847 (ISSN 2072-6643, DOI 10.3390/nu14091847, lire en ligne, consulté le )
- (en) Wei-Jyun Chien, Dinar S. Saputri et Hung-Yu Lin, « Valorization of Taiwan's Citrus depressa Hayata peels as a source of nobiletin and tangeretin using simple ultrasonic-assisted extraction », Current Research in Food Science, vol. 5, , p. 278–287 (ISSN 2665-9271, DOI 10.1016/j.crfs.2022.01.013, lire en ligne, consulté le )
- (en) Yoichi NOGATA, Koji SAKAMOTO, Hiroyuki SHIRATSUCHI, Toshinao ISHII, Masamichi YANO et Hideaki OHTA, « Flavonoid Composition of Fruit Tissues of Citrus Species », sur academic.oup.com, (consulté le )
- (ja) K. Miyagi, T. Fujise, N. Koga et K. Wada, « Effect of some extracting methods and storage temperature on quality stability of shiikuwasha (Citrus depressa Hayata) fruit juice during storage: Stability of polymethoxylated flavones and synephrine », Food Preservation Science (Japan), (ISSN 1344-1213, lire en ligne, consulté le )
- (en) Su, Yao, Xu, Jin-Jin, Bi, Jun-Long, Wang, Yue-Hu, Hu, Guang-Wan, Yang Jun, Yin, Ge-Fen, Long, Chun-Lin, « Chemical constituents of Arisaema franchetianum tubers », Journal of Asian Natural Products Research, vol. 15, no 1, , p. 71-77 (lire en ligne).
- (en) Ashok V. Vyas et Newand B. Mulchandani, « Polyoxygenated flavones from Ageratum conyzoides », Phytochemistry, vol. 25, no 11, , p. 2625–2627 (ISSN 0031-9422, DOI 10.1016/S0031-9422(00)84523-9, lire en ligne, consulté le )
- (en) Sims K. Lawson, Layla G. Sharp, Prabodh Satyal et William N. Setzer, « Volatile components of the aerial parts of Conoclinium coelestinum from North Alabama », American Journal of Essential Oils and Natural Products, , p. 8-10 (lire en ligne).
- (en) Zhimin Xu et Luke R. Howard, Analysis of Antioxidant-Rich Phytochemicals, John Wiley & Sons, (ISBN 978-0-8138-2391-1, lire en ligne), p 210
- (en) Akira Nakajima et Yasushi Ohizumi, « Potential Benefits of Nobiletin, A Citrus Flavonoid, against Alzheimer’s Disease and Parkinson’s Disease », International Journal of Molecular Sciences, vol. 20, no 14, , p. 3380 (ISSN 1422-0067, DOI 10.3390/ijms20143380, lire en ligne, consulté le )
- Akira Korean College of Neuropsychopharmacology, Yasushi Ohizumi et Kiyofumi Yamada, Anti-dementia Activity of Nobiletin, a Citrus Flavonoid: A Review of Animal Studies, (lire en ligne)
- Kentaro Matsuzaki, Kenichi Miyazaki, Seiichiro Sakai et Hiromu Yawo, « Nobiletin, a citrus flavonoid with neurotrophic action, augments protein kinase A-mediated phosphorylation of the AMPA receptor subunit, GluR1, and the postsynaptic receptor response to glutamate in murine hippocampus », European Journal of Pharmacology, vol. 578, nos 2-3, , p. 194–200 (ISSN 0014-2999, PMID 17976577, DOI 10.1016/j.ejphar.2007.09.028, lire en ligne, consulté le )
- (en) Ashish Ranjan Sharma, Yeon-Hee Lee, Altanzul Bat-Ulzii et Srijan Chatterjee, « Bioactivity, Molecular Mechanism, and Targeted Delivery of Flavonoids for Bone Loss », Nutrients, vol. 15, no 4, , p. 919 (ISSN 2072-6643, DOI 10.3390/nu15040919, lire en ligne, consulté le ) :
« 5.5. Micelles »
- (en) Larissa Gabriela Faqueti, Vincent Brieudes, Maria Halabalaki, Alexios Leandros Skaltsouni, Maique Weber Biavatti, « QUANTIFICATION OF METHOXYFLAVONES IN THE AQUEOUS EXTRACT OF Ageratum conyzoides (ASTERACEAE) », Brazilian conference in natural products, , p. 1 (lire en ligne [PDF])
- Keisuke Imada, Na Lin, Chunfang Liu et Aiping Lu, « Nobiletin, a citrus polymethoxy flavonoid, suppresses gene expression and production of aggrecanases-1 and -2 in collagen-induced arthritic mice », Biochemical and Biophysical Research Communications, vol. 373, no 2, , p. 181–185 (ISSN 1090-2104, PMID 18541144, DOI 10.1016/j.bbrc.2008.05.171, lire en ligne, consulté le )
- (en) Jonathan A. Green, Kimberley L. Hirst-Jones, Rose K. Davidson et Orla Jupp, « The potential for dietary factors to prevent or treat osteoarthritis », Proceedings of the Nutrition Society, vol. 73, no 2, , p. 278–288 (ISSN 0029-6651 et 1475-2719, DOI 10.1017/S0029665113003935, lire en ligne, consulté le )
- (en) Rosaria Meli et Giuseppina Mattace Raso, « Natural Antioxidants in the Pharmacological Treatment of Rheumatic Immune and Inflammatory Diseases », dans Studies on Arthritis and Joint Disorders, Springer, (ISBN 978-1-4614-6166-1, DOI 10.1007/978-1-4614-6166-1_14), p. 251–273.
- (en) Michiko Hirata, Tsukasa Tominari, Ryota Ichimaru et Naruhiko Takiguchi, « Effects of 4′-Demethylnobiletin and 4′-Demethyltangeretin on Osteoclast Differentiation In Vitro and in a Mouse Model of Estrogen-Deficient Bone Resorption », Nutrients, vol. 15, no 6, , p. 1403 (ISSN 2072-6643, DOI 10.3390/nu15061403, lire en ligne, consulté le )
- (en) « Nobiletin », sur pubchem.ncbi.nlm.nih.gov (consulté le ).
- (en) María Tomás-Navarro, José Luis Navarro, Fernando Vallejo et Francisco A. Tomás-Barberán, « Novel Urinary Biomarkers of Orange Juice Consumption, Interindividual Variability, and Differences with Processing Methods », Journal of Agricultural and Food Chemistry, vol. 69, no 13, , p. 4006–4017 (ISSN 0021-8561 et 1520-5118, DOI 10.1021/acs.jafc.0c08144, lire en ligne, consulté le )
- (en) Tadashi Hattori, Hiroki Tagawa, Makoto Inai et Toshiyuki Kan, « Transdermal delivery of nobiletin using ionic liquids », Scientific Reports, vol. 9, no 1, , p. 20191 (ISSN 2045-2322, DOI 10.1038/s41598-019-56731-1, lire en ligne, consulté le )
- (en) Ana G. Luque-Alcaraz, Jaime Lizardi, Francisco M. Goycoolea, Miguel A. Valdez, Ana L. Acosta, Simon B. Iloki-Assanga, Inocencio Higuera-Ciapara, Waldo Argüelles-Monal, « Characterization and Antiproliferative Activity of Nobiletin-Loaded Chitosan Nanoparticles », Hindawi Publishing Corporation Journal of Nanomaterials, , p. 1 à 8 (lire en ligne [PDF])
- (en) Huanle Chen, Yaping An, Xiangxing Yan et David Julian McClements, « Designing self-nanoemulsifying delivery systems to enhance bioaccessibility of hydrophobic bioactives (nobiletin): Influence of hydroxypropyl methylcellulose and thermal processing », Food Hydrocolloids, vol. 51, , p. 395–404 (ISSN 0268-005X, DOI 10.1016/j.foodhyd.2015.05.032, lire en ligne, consulté le )
- (en) Sabu Thomas, Yves Grohens et Yasir Beeran Pottathara, Industrial Applications of Nanomaterials, Elsevier, (ISBN 978-0-12-815750-3, lire en ligne)
- Jing Yao, Yun Lu et Jian Pin Zhou, « Preparation of nobiletin in self-microemulsifying systems and its intestinal permeability in rats », Journal of Pharmacy & Pharmaceutical Sciences: A Publication of the Canadian Society for Pharmaceutical Sciences, Societe Canadienne Des Sciences Pharmaceutiques, vol. 11, no 3, , p. 22–29 (ISSN 1482-1826, PMID 18801304, DOI 10.18433/j3ms3m, lire en ligne, consulté le )
- (en) Biao Qu, Xiao-lin Wang, De-chong Zheng et Chu-tian Mai, « Novel treatment for refractory rheumatoid arthritis with total glucosides of paeony and nobiletin codelivered in a self-nanoemulsifying drug delivery system », Acta Pharmacologica Sinica, vol. 43, no 8, , p. 2094–2108 (ISSN 1745-7254, DOI 10.1038/s41401-021-00801-6, lire en ligne, consulté le )
- A. Minagawa, Y. Otani, T. Kubota et N. Wada, « The citrus flavonoid, nobiletin, inhibits peritoneal dissemination of human gastric carcinoma in SCID mice », Japanese Journal of Cancer Research: Gann, vol. 92, no 12, , p. 1322–1328 (ISSN 0910-5050, PMID 11749698, PMCID 5926678, DOI 10.1111/j.1349-7006.2001.tb02156.x, lire en ligne, consulté le )
- Takashi Sato, Leona Koike, Yoshiki Miyata et Michiko Hirata, « Inhibition of activator protein-1 binding activity and phosphatidylinositol 3-kinase pathway by nobiletin, a polymethoxy flavonoid, results in augmentation of tissue inhibitor of metalloproteinases-1 production and suppression of production of matrix metalloproteinases-1 and -9 in human fibrosarcoma HT-1080 cells », Cancer Research, vol. 62, no 4, , p. 1025–1029 (ISSN 0008-5472, PMID 11861377, lire en ligne, consulté le )
- (en) N. Yoshimizu, Y. Otani, Y. Saikawa et T. Kubota, « Anti-tumour effects of nobiletin, a citrus flavonoid, on gastric cancer include: antiproliferative effects, induction of apoptosis and cell cycle deregulation: ANTI-TUMOUR EFFECT OF NOBILETIN », Alimentary Pharmacology & Therapeutics, vol. 20, , p. 95–101 (DOI 10.1111/j.1365-2036.2004.02082.x, lire en ligne, consulté le )
- Sachiko Tanaka, Takashi Sato, Noriko Akimoto et Masamichi Yano, « Prevention of UVB-induced photoinflammation and photoaging by a polymethoxy flavonoid, nobiletin, in human keratinocytes in vivo and in vitro », Biochemical Pharmacology, vol. 68, no 3, , p. 433–439 (ISSN 0006-2952, PMID 15242810, DOI 10.1016/j.bcp.2004.04.006, lire en ligne, consulté le )
- Toshiyuki Akachi, Yasuyuki Shiina, Yayoi Ohishi et Takumi Kawaguchi, « Hepatoprotective effects of flavonoids from shekwasha (Citrus depressa) against D-galactosamine-induced liver injury in rats », Journal of Nutritional Science and Vitaminology, vol. 56, no 1, , p. 60–67 (ISSN 1881-7742, PMID 20354348, DOI 10.3177/jnsv.56.60, lire en ligne, consulté le )
- Y. Henrotin, C. Lambert, D. Couchourel et C. Ripoll, « Nutraceuticals: do they represent a new era in the management of osteoarthritis? - a narrative review from the lessons taken with five products », Osteoarthritis and Cartilage, vol. 19, no 1, , p. 1–21 (ISSN 1522-9653, PMID 21035558, DOI 10.1016/j.joca.2010.10.017, lire en ligne, consulté le )
- Akira Murakami, Meiyu Song, Shin-Ichi Katsumata et Mariko Uehara, « Citrus nobiletin suppresses bone loss in ovariectomized ddY mice and collagen-induced arthritis in DBA/1J mice: possible involvement of receptor activator of NF-kappaB ligand (RANKL)-induced osteoclastogenesis regulation », BioFactors (Oxford, England), vol. 30, no 3, , p. 179–192 (ISSN 0951-6433, PMID 18525112, DOI 10.1002/biof.5520300305, lire en ligne, consulté le )
- 梶 萌, 金子 雪子 et 石川 智久, « ノビレチンの膵β細胞に対する抗アポトーシス作用機序の解析 », 日本薬理学会年会要旨集, vol. 96, , p. 2–B–SS12-1 (DOI 10.1254/jpssuppl.96.0_2-B-SS12-1, lire en ligne, consulté le )
- (en) « Nobiletin attenuates Nrf2-Gpx4-regulated ferroptosis in septic liver injury by modulating the gut microbiota », sur researchsquare.com, (consulté le ).
- (en) Xuekai Xiong, Tali Kiperman, Weini Li et Sangeeta Dhawan, « The clock-modulatory activity of Nobiletin suppresses adipogenesis via Wnt signaling », bioRxiv preprint, , p. 33 pages (DOI 10.1101/2023.02.07.527587v1, lire en ligne [PDF], consulté le )
- Akira Nakajima, Kiyomitsu Nemoto et Yasushi Ohizumi, « An evaluation of the genotoxicity and subchronic toxicity of the peel extract of Ponkan cultivar 'Ohta ponkan' (Citrus reticulata Blanco) that is rich in nobiletin and tangeretin with anti-dementia activity », Regulatory toxicology and pharmacology: RTP, vol. 114, , p. 104670 (ISSN 1096-0295, PMID 32371103, DOI 10.1016/j.yrtph.2020.104670, lire en ligne, consulté le )
Annexes
Articles connexes
Liens externes
- (en) Suyu Mei, Predicting health effects of food compounds via ensemble machine learning 2023. voir table 1
- (en) PubChem, « Nobiletin »
- (en) A Narrative Review of the Effects of Citrus Peels and Extracts on Human Brain Health and Metabolism, sur mdpi.com
- (en) Lire en ligne, sur phytochemicals.info
- (en) Poonam Jaglan et Harpal S. Buttar (2023), La nobilétine prévient les complications et les troubles neurologiques liés à l'obésité : un aperçu des études précliniques et cliniques (résumé)
- (ja) 菅谷公男, 西島さおり,名嘉栄勝, 嘉手川豪心 et al. Poudre de haute pureté Nobiletin (Nobirex® PMF90) pour la dysurie Essais cliniques sur l'efficacité et la sécurité. 原著論文 診療と新薬 p 915-921. 2020