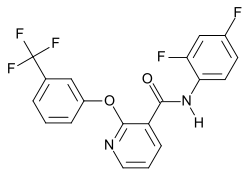
Diflufenicanil
Le diflufenicanil (ou diflufenican ou DFF ou encore (N-(2,4-difluorophényl)-2-[3-(trifluorométhyl)phénoxy]-3-pyridine-carboxamide)) est le nom d'une molécule herbicide organofluorée, substance active principalement utilisée en agriculture, sous forme de différentes formulations, pour différents types de cultures.
| Diflufenicanil | |
| |
| Identification | |
|---|---|
| Synonymes |
diflufenican |
| No CAS | |
| No ECHA | 100.122.360 |
| PubChem | |
| SMILES | |
| InChI | |
| Apparence | solide |
| Propriétés chimiques | |
| Formule | C19H11F5N2O2 [Isomères] |
| Masse molaire[1] | 394,294 9 ± 0,017 g/mol C 57,88 %, H 2,81 %, F 24,09 %, N 7,1 %, O 8,12 %, |
| Propriétés physiques | |
| T° fusion | 160 °C |
| Solubilité | 0,05 mg L−1 dans l'eau à 25 °C |
| Pression de vapeur saturante | 3,18 × 10−8 mmHg à 25 °C |
| Précautions | |
| SGH[2] | |
| H412 |
|
| Écotoxicologie | |
| DL50 | 2 000 mg kg−1 rat oral 2 000 mg kg−1 rat peau |
| Unités du SI et CNTP, sauf indication contraire. | |
Cette molécule est aussi antigerminative mais originellement elle a été conçue comme désherbant du blé d'hiver[3].
Elle se dégrade dans le sol, en moyenne, nettement plus lentement que d'autres désherbants tels que le glyphosate ou l'isoproturon ou que l'azoxystrobine (fongicide)[4] et son principal métabolite est alors le l'acide 2-[3-(trifluorométhyl) phénoxy] nicotinique (désigné par l'expression AE B107137 par l'EFSA et parfois abrégé en AE-B).
Usages
Le diflufénican est utilisé dans en zones agricoles et urbaines, contre les herbes jugées indésirables, dans les allées de cimetière, aéroports... ainsi que sur les bords de voies de circulation. Ses usages autorisés ont varié dans le temps et selon les pays.
Dans l'Union européenne (UE)
Dans l'UE, en Agriculture, le diflufenicanil est interdit dans les parcelles de culture biologique, et n'est autorisé ailleurs que pour désherber chimiquement les champs de blé, orge, seigle et avoine, les vignobles, les cultures d'arbres et buissons de pépinières[5].
Il fait aussi partie des désherbants au moins provisoirement autorisés dans les jardins, cimetières et pour traiter les axes de circulation.
Tonnages utilisés en France
Selon l'Agence française pour la biodiversité (AFB), l'Anses et la Banque nationale des ventes de produits phytopharmaceutiques (renseignée par les distributeurs agréés) en 2018, si la consommation de diflufenicanil a diminué de 2009 à 2017 pour les usages en jardin, elle a plus que doublé sur les grandes cultures, y passant de 168,4 tonnes/an pulvérisées en 2009 à 407,3 t/an en 2017[6].
Pour tous ses usages confondus, en il était en 2009 en France le 60e pesticide le plus utilisé en France (sur 389 molécules autorisées), devenant le 31e (sur 436) en 2017[6].
En 2011, le diflufenicanil a été principalement utilisé sur le blé tendre (1 435 482 hectares traités au moins une fois dans l'année par ce produit, soit 31,4% de tous les champs de blé tendre) selon une estimation faire par le Service de la statistique et de la prospective du Ministère de l'agriculture et de l'alimentation, sur la base d'enquêtes de terrain extrapolées), loin devant l'orge (410 570 ha, soit 31,3% de tous les champs d'orge de France), le triticale (25 762), le blé dur (16 950 ha), le maïs fourrage (2 399 ha), le maïs grain (3 424 ha) et le colza (143 ha)[6].
Cette année là (2011) les tonnages de ce pesticide reçus par les cultures de betterave sucrière et par les viticultures n'ont pu être évalués (faute de données renseignées)[7].
Mais une autre évaluation (méthode similaire), a estimé qu'en 2014 environ 384 178 ha ont été traités au moins une fois au diflufenicanil (soit 0,4% de tous les champs de betterave sucrière de France)[7].
Concernant l'arboriculture, les données étaient également lacunaires jusqu'en 2011, mais il a ensuite été évalué par l'ANSES que seuls 99 ha de pommeraies auraient reçu ce produit en 2012 (sur environ 38 846 ha estimés)[7].
Nombre d'utilisateurs en France (Cf. Cohorte « Agrican »)
Selon les données venant de la cohorte Agrican, 13 985 membres de cette cohorte ont au moins une fois utilisé du diflufénican (soit 7,7 % de la cohorte et 26,5 % des utilisateurs de pesticides de la cohorte)[7]. Mais ces proportions varient énormément selon le sexe : « les utilisateurs de cette substance active représentent 13,9 % des hommes de la cohorte et 29,7 % des utilisateurs de pesticides, tandis que les utilisatrices représentent 0,4 % des femmes de la cohorte et 4,3 % des utilisatrices de pesticides. »[7].
Au moment de l'inclusion du diflufénican dans l'étude, entre 2005 et 2007, 6 081 membres de la cohorte en activité l'utilisaient (soit 11,1 % des hommes de la cohorte alors en activité et 0,2 % des femmes en activité). Au même moment, dans cette même cohorte Agrican, 55,1 % des utilisateurs de pesticides et 16,8 % des utilisatrices de pesticides utilisaient du diflufénican[7].
Devenir des résidus la molécule dans les plantes cultivées
Après des traitements sur du blé trifolié, des agronomes chinois ont recherché les résidus de diflufénican dans le sol, ainsi que dans les plants de blé puis dans leurs grains[8]. Ils ont trouvé que (sachant que la quantité minimale détectable de diflufénican était de 1,0 × 10−10gkg−1), la molécule disparaisait peu à peu avec le temps (plus ou moins vite selon la profondeur de la couche du sol étudiée) et les résidus étaient d'autant plus élevés que la dose pulvérisée a été importante, avec une augmentation non linéaire, par exemple en doublant la quantité pulvérisée, la quantité résiduelle de diflufénican faisait plus que doubler en fin d'expérience). Mais pour une seule pulvérisation, les résidus étaient bien en deçà de la valeur du résidu maximal limite (LMR) fixée en Chine et jugée par les auteurs sans danger pour le blé, les humains ou le bétail[8]. Ils n'ont pas évalué leur impact ni leur concentration dans la faune du sol (vers de terre par exemple)[8].
Le diflufénilcanil et l'eau
La molécule active est presque insoluble dans l'eau[9], mais se montre toxique à faible doses pour le milieu aquatique (voir ci-dessous). Elle est par contre très soluble dans certains mélanges de cosolvants dont par exemple (éthanol + eau), (éthylène glycol, EG + eau), (propylène glycol, PG + eau) et (N, N-diméthyl formamide, DMF + eau)[10].
Elle est facilement adsorbé sur les particules organiques du sol, et une étude de 2 ans sur un petit bassin-versant allemand a constaté des pics importants de lessivage de Diflufenicanil (vers la nappe ou les eaux superficielles) en période humide et en fin d'hiver après que les processus de gel/dégel aient favorisé une augmentation de l'érosion du sol sous les pluies. (mais ce pesticide est néanmoins moins lessivable que le flufénacet qui était aussi suivi par cette étude)[11].
Sans surprise (puisque l'utilisation de cette molécule a beaucoup augmenté), la pollution des eaux de surface par ce produit est en augmentation, dont en France métropolitaine où selon le ministère de l'environnement : en 2007, parmi 639 analyses d'eau quantifiées, 5,7% des analyses montraient la présence de diflufénican ; alors ce taux est passé à 38,6% en 2016 (pour 6 260 analyses d'eau), le nombre de dépassement de la MAC ("Maximum Acceptable Concentration" = Concentration maximale admissible réglementaire, correspondant à un risque aigu pour la Directive cadre sur l'eau) semble être resté stable (entre 1 et 2% des analyses) mais il faut tenir compte du fait que le nombre d'analyse faites par an a augmenté [12] . Par contre hors-métropole, dans les DROM, de 2007 à 2014, les analyses d'eaux de surface n'ont révélé aucune trace de cette molécules, mais le nombre d'analyses faites dans les DROM chaque année est bien moindre qu'en métropole et le nombre nombre d’analyses dont le résultat est supérieur à la limite de quantification y est également bien plus bas. L'ANSES aiment en 2018 que « les techniques analytiques disponibles ou couramment mises en œuvre pour détecter le diflufénican au niveau et en-dessous de la valeur à partir de laquelle un risque ne peut être écarté, ne sont pas assez performantes »[12].
Concernant le eaux de nappe phréatique (surveillées en France par le BRGM), elles se montrent a priori moins contaminées, avec une présence généralement inférieure à la limite de quantification (0,04 μg.l-1 pour la période 2008-2017 étudiée par le dernier rapport de l'ANSES, publié en 2018) [13].
Si la molécule est présent dans l'eau du robinet c'est sous le seuil de quantification, sous la valeur toxicologique de référence fixée à 0,1 μg/L pour un pesticide seul sans les eaux destinées à la consommation humaine, et sous la Vmax= fixée à 600 μg/l en France [14]. Aucune non-conformité n'a été signalée en France pour cette molécule entre 2007 et 2016[15].
Dans les aliments d'origine végétale ou animale
La limite maximale de résidus (LMR) par défaut (la plus basse) pour cette molécules est égale à 0,01 mg/kg. Aucun dépassements de LMR n'a été signalé en France de 2008 à 2017, mais peu de données étaient disponibles (aucune analyse avant 2012 selon l'ANSES et quand on a recherché cette molécule dans ces aliments, son taux était généralement inférieur à la limite de quantification [0,04 μg.l-1] pour la période 2008-2017 étudiée par le dernier rapport de l'ANSES, publié en 2018). On n'a donc pas de données sur la dose cumulée ingérée ou bue par an en France[16]..
Entre 2008 et 2017, deux études ont porté sur l’alimentation totale de français, la première dite EAT2 ne disposait d'aucune analyse de cette molécule dans les aliments[17] mais la seconde (étude de l’alimentation totale infantile (EAT1) a pu s'appuyer sur 161 analyses de laits de croissance et préparations infantiles, aliments courants, eaux embouteillées [18]. Toutes ces analyses avaient pour cette molécule un résultat inférieur à la limite de quantification.
Une évaluation de l'exposition alimentaire des Français et des risques alimentaires liés au « diflufénican seul » en tant que résidu[19] a été tentée par l'ANSES (2018). Elle s'est basée sur les données de programmes de surveillance des denrées alimentaires et des eaux destinées à la consommation humaine, ainsi que sur une étude de l’alimentation totale (dite EAT2) ainsi que sur les niveaux de consommation alimentaire modélisés par l’étude « INCA 2 »[20], mais elle n'a pu tenir compte que « des données de contamination des eaux destinées à la consommation humaine, seules données disponibles au moment de l’évaluation. L’exposition chronique au diflufénican n’a pas pu être évaluée sur la base de l’EAT2[17], cette substance active n’ayant pas été recherchée » et « l’exposition aiguë n’a pas été évaluée en raison de l’absence de fixation d’ARfD et de quantifications pour la période considérée » a précisé l'ANSES en 2018[21] .
La valeur toxicologique de référence (VTR) pour le risque chronique correspond à la « dose journalière admissible », fixée dans l'Union européenne à 0,2 mgLkg de poids corporel et par jour [22], mais pour le risque aigu, il n'y avait pas en 2018 d'ARfD (Acute Reference Dose) applicable [23].
Au vu de ces valeurs de référence, la DJA n'est pas dépassée en France, ni chez l'adulte, ni chez l'enfant. Les valeurs toxicologiques de référence (VTR) ne concernent que la molécule seule en tant que résidus des formulations pesticides utilisées ; autrement dit, ces valeurs n'intègrent pas les métabolites de la molécules ingérées ni celles formées dans l'organisme.
De plus, il ne semble exister que très peu de données sur les synergies entre ce pesticide (ou ses résidus) et d'autres pesticides (ou leurs résidus), et encore moins sur d'éventuelles synergies entre ce pesticides et d'autres polluants présents dans l'air, l'eau ou de l'alimentation.
Une étude (2009) a conclu que dans le sol, le mélange glyphosate + diflufénican « a augmenté les effets toxiques des deux herbicides sur l'activité biologique du sol et la persistance individuelle dans le sol de chaque herbicide » (surtout dans un sol sableux)[24], mais elle ne portait que sur ces deux molécules (souvent associées dans les formulations mises sur le marché.
Imprégnation humaine et effets sur l'organisme humain ?
Selon l'ANSES (2018), le diflufénican n'a pas été intégré dans les études de biosurveillance de l'imprégnation humaine par les pesticides, et pour la période 1997-2017/18, le réseau Phyt’attitude (CCMSA) n'a pas signalé d’événements indésirables démontré lié à une exposition à un produit contenant du diflufénican. De même pour le réseau des Centres antipoison et de toxicovigilance pour la période du 01/01/2010 au 20/11/2018[25].
En 2018, on ne disposait pas d'études sur les effets chroniques du diflufénican sur la santé humaine issues des principales expertises collectives. Le CIRC n'avait pas encore publié de monographie sur ce produit, qui n'était en outre pas cité dans l’expertise collective de l’Inserm ni dans celle de l’EFSA comme étant associé à une pathologie [26].
Dans l'alimentation animale ?
En 2018, selon l'ANSES, « le diflufenican n'a pas été recherché en France dans le cadre des programmes de surveillance » de l'alimentation animale.
Cinétique du diflufénican dans l'Environnement (rural, urbain...)
Le diflufénican se dissipe dans le sol plus lentement que d'autres désherbants tels que le glyphosate, l'azoxystrobine ou l'isoproturon. Par exemple, pour dissiper 25 % de la dose épandue, il faut de 13 à 61 semaines (selon le contexte édaphique et de vie biologique du sol) pour le diflufénican, contre 5,6 à 17,2 semaines pour l'azoxystrobine et 0,3 à 12,5 semaines pour l'isoproturon[4].
En 2020 une équipe de chercheurs danois a confirmé que le devenir (dégradation, biodégradation, minéralisation, sorption et vieillissement) de cette molécules dans le sol varie considérablement selon le milieu, et également en milieu urbain et en milieu agricoles[27]. En particulier, ses deux principaux métabolites (les seuls recherchés par cette étude) persistent beaucoup plus longtemps dans les sols urbains que dans les sols agricoles, et la minéralisation de la molécule se fait très mal dans les substrats de type "gravier" ou "sablonneux"[27] (ou dans le sable qu'on trouve sous les pavés et pavés auto-bloquants). Or, soulignent les auteurs, les pesticides sont réglementés en Europe « uniquement en se basant sur les données des sols agricoles »[27], données non-représentatives de la cinétique des pesticides dans les sols urbains (imperméabilisés, pavés ou non)[28] ;
- l'acide 2-[3-(trifluorométhyl) phénoxy] nicotinique (ou AE-B) qui est le premier et principal métabolite du diflufénican ne semble pas s'accumuler dans un sol de type agricole (où après 150 jours 10% de la quantité de molécule-mère [le diflufénican] apportée au sol s'était minéralisée). Par contre dans le même délai, dans une couche de gravier, telle qu'on en trouve fréquemment en ville, ce même métabolite n'avait pas encore commencé à se minéraliser[27].
- Une étude lysimétrique a confirmé montré en 2020 que la sorption (comme dans le cas du glyphosate) contrôle le lessivage des molécules de dégradation issues du diflufénican, même dans les graviers[28]. De plus, ces produits de dégradation sont lixiviés de manière différente selon le type de gravier (car « différents graviers peuvent déclencher différentes voies de dégradation »[28]. Or la sorption de la molécule-mère (diflufénican) se montre bien plus forte dans le sol agricole que dans le gravier[27] ;
- la sorption des deux principaux métabolites du diflufénican dans le sol, comme dans le gravier, est plus faible que celle le diflufénican lui-même[27] ; Une étude danoise, en extérieur, a utilisé 21 lysimètres emplis de gravier, comparés à une couche arable sableuse comme témoin[28]. Après aspersion d'un mélange commercial diflufénican + glyphosate, les taux d'herbicides et de leurs produits de dégradation pertinents ont été dosés dans les lixiviats durant 19 mois : « le diflufénican, le glyphosate et l'AMPA n'ont été lixiviés par aucun des lysimètres[28]. Mais un produit de dégradation du diflufénican (l'AE-0) s'est lessivé à partir de deux des types de gravier pendant plus d'un an, et un second produit de dégradation (l'AE-B) était retrouvé dans les lixiviation de tous les graviers durant un an au maximum »[28]. Les taux de ces produits dans le lixiviat ont atteint à 0,5 à 3 g/L, et « les concentrations les plus élevées sur les périodes les plus longues étant observées avec des éclats de roche sur le gravier »[28].
- Durant 150 jours, le vieillissement du diflufénican dans le sol et le gravier ne semble pas avoir eu d'influence sur la quantité de composé encore présente dans le sol[27].
Les auteurs concluent donc à des « lacunes dans les procédures d'évaluation des risques demandées pour l'homologation des pesticides pour les zones urbaines »[27].
Écotoxicologie
- Le règlement no 1272/2008 l'a classé H412 : « nocif pour les organismes aquatiques, entraînant des effets néfastes à long terme ». 0,016
- Alors que l'impact des pesticides sur les fonctions agroécologiques des sols préoccupe les chercheurs[29] et que l'on a démontré (en 2006) que ce produit (comme l'isoproturon ou l azoxystrobin) montre des taux de dégradation dans le sol très variable, même au sein d'un même champs, selon l'état local du sol et ses caractéristiques physicochimiques[4] ; une étude récente (2021) a conclu que l'application de cet herbicides « diminue fortement la population microbienne », avec en outre « une modification significative de la structure microbienne dans le sol non amendé »[30]. En revanche, les différences de biomasse et de structure microbienne disparaissaient dans les sols traités s'ils avaient aussi été amendés (par un substrat épuisé de culture de champignon ou par du compost, dans le cas de cette étude)[30]. Selon les auteurs, ces amendements « ont eu un certain effet tampon sur le DHA du sol et la biomasse et la structure microbiennes après l'application d'herbicides en raison de la capacité d'adsorption plus élevée des herbicides par le sol amendé »[30].
Effets du Diflufénicanil sur les biofilms algaux et le périphyton
Dans les bassins versants agricoles comme ailleurs, dès que de l'eau est présente en surface, des périphytons (c'est dire un biofilm vivant sur le sol humide ou des objets immergés) s'y forment. Bien que discrets, ces périphytons ont des fonctions écosystémique importantes pour d'autres espèces et pour la biosphère : outre qu'ils sont des sources de nourriture, ils produisent de l'oxygène, ils créent du sol ou du sédiment (via leur nécromasse) et ils forment un substrat de vie pour d'autres espèces. En colonisant certains écotones, ils contribuent aussi à « fixer » la pellicule superficielle des sols ou des sédiments respectivement face à l'érosion éolienne ou hydrique, et face au courant sous l'eau). De plus, couvrant au total d'immenses surfaces, ce sont aussi de discrets puits de carbone (et puits de phosphore selon une étude de 2006 sur la déseutrophisation des Everglades)[31].
Le périphyton forme en effet des biofilms plus ou moins épais et solides, constitués par des symbioses entre des algues et cyanophycées autotrophes et d'autres organismes, hétérotrophes (bactéries, microchampignons principalement). Cette symbiose leur permet de résister à des facteurs de stress tels que, notamment, le stress hydrique, les chocs thermiques et les UV solaires. Certains périphytons sont en outre des sources de roches biogéniques telles que les stromatolithes.
Comme ils sont en grande partie constitués d'organismes photosynthétiques, il était utile de connaitre les effets des désherbants (ou des biocides en général) sur les communautés « périphytes ». De nombreuses études avaient déjà porté sur l'effet de désherbants sur ces biofilms, mais il s'agissait de désherbants inhibiteurs de la photosynthèse. Or, le Diflufénicanil a un tout autre mode d'action sur la plante (inhibition de la biosynthèse des caroténoïde, selon ses concepteurs).
Un bioessai récent (2018) a donc exposé (12 jours durant) des communautés algales matures et périphytiques à des doses diverses de Diflufénicanil (jusqu'à 10 g/L). Ensuite, ces organismes ont pu récupérer durant de 9 jours dans une eau dépourvue d'herbicide. Tous les trois jours, durant les deux phases de ce bio essai, deux variables étaient quantifiées : la première traduisait l'état fonctionnel du périphyton (via a) la mesure de son efficacité photosynthétique et b) la mesure de l'extinction non-photochimique), et la seconde indiquait l'état de sa structure (via la mesure du taux de pigments, de la biomasse algale et de la structuration de sa communauté).
Résultat : dès 0,2 μg de diflufénican par litre d'eau du milieu, le taux de caroténoïdes chute (d -20% à -25 %) dans le périphyton, et plus encore pour le taux de chlorophylle (-25% à -30 %). Le diflufénican est donc bien écotoxique pour ces écosystèmes, même à faible dose.
Selon les auteurs, le périphyton montre un certain potentiel de récupération (après exposition), observé sous forme d'augmentation des taux de chlorophylle a et d'une extinction non-photochimique accrue, mais le périphyton peut ne pas être en mesure de récupérer rapidement en raison de l'augmentation persistante de l'efficacité photosynthétique, ce qui induit un déplacement des communautés microbiennes vers une hétérotrophie. Ces communautés peuvent alors devenir émettrices de CO2 et/ou de méthane, alors que quand elles étaient à dominante autotrophes (elle jouaient un rôle de pompe à carbone et d'oxygénation du milieu).
Remarque : l'effet dépresseurs sur la fonction chlorophyllienne avait avant cela facilement pu échapper aux observateurs, car il est ici masqué : la quantité de chlorophylle est habituellement évaluée (avec précision, et facilité) par la mesure de sa fluorescence, or il se trouve que l'intoxication des algues par le diflufénican (molécule contenant 5 atomes périphériques de fluor), et l'effet de ce désherbant sur le complexe membranaire pigment-protéine du photosystème II sont « deux processus provoquant une fluorescence plus élevée de la chlorophylle », trompant l'observateur[32].
Effets sur les animaux sauvages
- Les effets sur les animaux sauvages terrestres n'ont pas fait l'objet d'évaluations disponibles (en 2018, selon l'ANSES citant le réseau SAGIR qui n'avait pas de données sur ce produit entre le 01/01/1986 et le 31/12/2013).
Les oiseaux semblent notamment faire partie de espèces exposées à cette molécule dans les plaines agricoles : selon une étude dénommée « PeGASE/M6P », le diflufénican a été utilisé sur 66,7 % des sites d’études et sur 11,7% de la surface totale des sites étudiés. Il ne semble pas avoir été dosé dans les cadavres d’oiseaux, mais a une analyse l'a quantifié dans un œuf non éclos (0,016 mg/kg) ;
- Concernant le bétail ou les mammifères domestiques (chat, chien), les appels aux centres antipoison citent divers symptômes (nausées et vomissements, tremblements, irritations buccales, la perte d'appétit, l'hypersalivation) dans le cadre d'intoxications suspectées par ce produit, via la consommation de végétaux traités, le léchage des pattes ou l'ingestion de granulés par un animal en ayant déchiqueté le sachet. Il est difficile d'attribuer ces effets au diflufénican en particulier, car ce dernier est toujours utilisé en association avec d'autres molécules (ex : Aminotriazole, Glyphosate, Fluoroxypyr, Oxadiazon, MCPA, Diuron, 2,4 D, Isoproturon, Triclopyr, Chlortoluron)... et avec des adjuvants (ex : solvants, surfactants...)[33].
- Il ne semble pas y avoir eu d'études sur les synergies toxiques concernant les effets sur les animaux.
Exposition via l'air
Comme le Diuron et d'autres pesticides à dégradation lente, après pulvérisation, il peut présenter une certaine rémanence dans le sol (plus ou moins selon le type de sol), puis éventuellement être libéré dans l'atmosphère et dans la vapeur d'eau émise par le sol exposé au soleil (par un labour notamment). En France, dans les années 2010, quelques centaines de dosages de pesticides ont été faits annuellement dans l'air (en mesure journalières ou hebodmadaires) par les Associations agréées de surveillance de la qualité de l'air (AASQA) sous l'égide d'ATMO France. Selon, ces données, le diflufenican est souvent présent dans l'air en deçà des seuils de quantification, ou sa teneur est comprise entre 0,17 et 0,39 nanogrammes par m d'air filtré (moyennes sur une semaine). Il ne semble pas y avoir de suivi de ses molécules de dégradation.
En se basant sur la concentration maximale hebdomadaire ((0,39 ng.m-3) observée par les AASQA entre 2013 et 2016 (mais on sait que l'usage de ce produit a augmenté depuis) et en estimant que le taux respiratoire de l’enfant est de 1,07 m3 j−1 kg−1 pc, son exposition correspondrait à moins de 0,1 % de l’AOEL de cette substance active.
Usages, réglementation
Selon le dossier de Phytopharmacovigilance synthétisant les données de surveillance de l'ANSES (daté de décembre 2018), le diflufenicanil a été approuvé par un règlement européen de 2009[5], pour certains usages uniquement, et du 01/08/2009 au 31/12/2020.
Mode d'action
À la différence de nombreux désherbants systémiques conçus pour inhiber la photosynthèse et ainsi tuer la plante qui les absorbe, le Diflufenicanil a été conçu pour dégrader les membranes cellulaires via une inhibition de la biosynthèse des caroténoïdes.
Mais Ashton et ses collègues, en 1992, ont découvert que cette molécule attaque aussi le complexe enzymatique. Elle le fait en inhibant la biosynthèse des lipides acylés (acides gras vitaux)[35]. Des expériences faites in vitro suggèrent que c'est l'acide gras synthétase plutôt que l'acétyl-CoA carboxylase qui est le site d'action de la molécule[35].
Ce mécanisme a été étudié en détail dans les années 1990, en mesurant les activités des réductases au sein du complexe acide gras synthase de la biosynthèse des acides gras de type II d' Escherichia coli–– et du mésocarpe d'avocat (Persea americana)[36]. Totalement inactif sur la bêta-cétoacyl-ACP synthase, le diflufénican inhibe par contre, de manière compétitive les énoyl-[acyl-carrier-protein] réductase qu'elles soient dépendantes du coenzyme NADH (Nicotinamide adénine dinucléotide) ou du coenzyme NADPH (Nicotinamide adénine dinucléotide phosphate)[36]. Ces études laissent penser que d'autres molécules proches du diflufénican feraient aussi des herbicides efficaces, également en inhibant la synthèse des acides gras[36].
Ce désherbant est « mixte » : le produit est à la fois « foliaire systémique » (c'est-à-dire se répandant dans toutes les parties de la plante) et antigerminatif[37]. Il a été conçu par l'industrie phytopharmaceutique pour donc être appliqué en pré- ou post-levée[3].
Contaminations accidentelles
Il a été impliqué en 2021, dans la contamination de deux lots d'une formulation herbicide produit par la société Adama et vendue sous le nom de Marquis pour la culture betteravière, et de 6 lots d'un autre herbicide (le « Goltix Duo », produit par la même société)[38]. Ces 8 lots de pesticides ont été déclarés non-conformes en raison de la présence anormale de diflufenican dans leur formulation[38].
Les lots de Marquis et Goltix Duo non conformes ont été consignés par une ordonnance du 30 juin 2021[38]. Selon le ministère de l'Agriculture et la Confédération générale des planteurs de betteraves, 273 betteraviers (basés dans les Hauts-de-France et le Grand Est, dans la Marne, les Ardennes, l'Aube et l'Aisne) l'auraient utilisé sur environ 5 000 hectares de champs destinés à produire environ 500 000 tonnes de betteraves sucrière (soit environ 1,5 % de la production du pays). Toute cette production doit être détruites[39].
Rémanence dans les sols
Une étude a montré qu'à la différence d'autres désherbants ayant les mêmes usages, ce produit ne présente pas de biodégradation améliorée dans le sol après 3 ans d'applications annuelles répétées. Les autres produits testés avaient encouragé dans le sols le développement de souches de microbes capables de les dégrader.
Dépollution/bioremédiation de sols contaminés par le diflufénican
Un champignon dont la culture est bien maitrisée, le shiitaké (Lentinula edodes), a été testé au Portugal (publication 2011) pour biodégrader le Diflufenicanil[40].
Apparition de plantes résistantes
La plupart des désherbants ont généré, par la pression sélective qu'ils exercent, l'apparition de souches résistantes[41]. On a récemment (2019)montré que c'est le cas pour le diflufénican, avec par exemple l'apparition chez la Moutarde (Sisymbrium orientale L.) de deux mutations (dites Leu498 et Glu425, dans le gène PDS) source principale d'une résistance au diflufénican et au picolinafène retrouvée dans populations de moutarde. Ces mutations ne semblant pas affecter la finess de la plante, il n'y a pas de raisons de penser que la fréquence des allèles de résistance au désherbant diminuera si l'on cesse provisoirement d'utiliser ce pesticide[41].
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE N° 1272/2008 (16 décembre 2008)
- Cramp MC, Gilmour J, Hatton LR, Hewett RH, Nolan CJ and Parnell EW, Design and synthesis of N-(2,4-difluorophenyl)-2-(3-trifluoromethyl-phenoxy)-3-pyridinecarboxamide (diflufenican), a novel pre-and early post-emergence herbicide for use in winter cereals. Pestic Sci18:15–28 (1987).
- (en) Gary D. Bending, Suzanne D. Lincoln et Rodney N. Edmondson, « Spatial variation in the degradation rate of the pesticides isoproturon, azoxystrobin and diflufenican in soil and its relationship with chemical and microbial properties », Environmental Pollution, vol. 139, no 2, , p. 279–287 (DOI 10.1016/j.envpol.2005.05.011, lire en ligne, consulté le )
- règlement no 1107/2009
- Anses - Phytopharmacovigilance - Synthèse des données de surveillance – Diflufénican – décembre 2018, voir le tableau 2, chapitre "Quantités vendues" page 2/10
- Anses - Phytopharmacovigilance - Synthèse des données de surveillance – Diflufénican – décembre 2018, voir le tableau 2, chapitre "Quantités vendues" page 2 et 3 sur 10
- (en) Zhanli Hu, Jun Li, Yezi Zhang et Yan Shi, « Determination of residue of diflufenican in wheat and soil by ultra‐high‐pressure liquid chromatography and mass spectrometry conditions », Journal of the Science of Food and Agriculture, vol. 101, no 1, , p. 215–219 (ISSN 0022-5142 et 1097-0010, DOI 10.1002/jsfa.10633, lire en ligne, consulté le )
- « GESTIS-Stoffdatenbank », sur gestis.dguv.de (consulté le )
- (en) Renjie Xu, Chunjuan Huang et Haixia Zhang, « Diflufenican Dissolved in Different Aqueous Cosolvency Mixtures: Equilibrium Solubility Measurement and Thermodynamic Modeling », Journal of Chemical & Engineering Data, vol. 65, no 11, , p. 5516–5523 (ISSN 0021-9568 et 1520-5134, DOI 10.1021/acs.jced.0c00631, lire en ligne, consulté le )
- (en) Sandra Willkommen, Matthias Pfannerstill, Uta Ulrich et Björn Guse, « How weather conditions and physico-chemical properties control the leaching of flufenacet, diflufenican, and pendimethalin in a tile-drained landscape », Agriculture, Ecosystems & Environment, vol. 278, , p. 107–116 (DOI 10.1016/j.agee.2019.03.017, lire en ligne, consulté le )
- voir pages 4 et 5 (chapitre " Surveillance des eaux de surface, exposition et risques pour les organismes aquatiques) dans le rapport "Anses - Phytopharmacovigilance (2018) - Synthèse des données de surveillance – Diflufénican |Décembre
- voir Tableau 4 : Valeur(s) écotoxicologique(s) de référence pour les eaux de surface, et le commentaire sous le Tableau 7. dans le Synthèse des données de surveillance – Diflufénican – Décembre 2018
- Avis du 29 septembre 2017 de l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail relatif à la détermination de valeurs sanitaires maximales (Vmax) pour différents pesticides et métabolites de pesticides dans l’eau destinée à la consommation humaine
- voir Tableau 12 : Taux de quantification et de non-conformité pour le diflufénican dans les eaux destinées à la consommation humaine (source : ministère chargé de la santé - ARS - Anses) in le Synthèse des données de surveillance – Diflufénican – Décembre 2018
- voir page 6 : Surveillance des aliments d’origine végétale et animale et des eaux destinées à la consommation humaine, exposition et risques pour la population Données de surveillance des aliments d’origine végétale et animale > Données issues des programmes et plans de surveillance et de contrôle nationaux in le Synthèse des données de surveillance – Diflufénican – Décembre 2018
- Anses, 2011, Étude de l’alimentation totale française 2 (EAT2), Tome 2 : résidus de pesticides, additifs, acrylamide, HAP, juin 2011, Ed. scientifique, 401 pages.
- Anses, 2016, Étude de l’alimentation totale infantile, Tome 2, Partie 4 : résultats relatifs aux résidus de pesticides, rapport d’expertise collective, septembre 2016, Ed. Scientifique, 378 pages.
- Cf. réglementation européenne ; en savoir plus : (en) « EU Pesticides Database », sur ec.europa.eu (consulté le )
- Afssa, 2009, INCA 2 : étude individuelle nationale sur les consommations alimentaires, 2006-2007.
- voir pages 7 (fin du chapitre " Surveillance des aliments d’origine végétale et animale et des eaux destinées à la consommation humaine, exposition et risques pour la population") dans le rapport "Anses - Phytopharmacovigilance (2018) - Synthèse des données de surveillance – Diflufénican |Décembre
- (COM, 2008)
- ARfD=non applicable (COM, 2008 ; Directive 08/66)
- (en) Manuel Tejada, « Evolution of soil biological properties after addition of glyphosate, diflufenican and glyphosate+diflufenican herbicides », Chemosphere, vol. 76, no 3, , p. 365–373 (DOI 10.1016/j.chemosphere.2009.03.040, lire en ligne, consulté le )
- Voir le chapitre Données relatives aux expositions et intoxications humaines issues des réseaux de vigilance (Données du réseau Phyt’attitude, CCMSA) in Anses - Phytopharmacovigilance (2018) - Synthèse des données de surveillance – Diflufénican |Décembre
- Anses - Phytopharmacovigilance (2018) - Synthèse des données de surveillance – Diflufénican |Décembre ; voir p. 8/10, chapitre "Données sur les effets chroniques sur la santé humaine issues des principales expertises collectives"
- (en) Sif B. Svendsen, Pedro N. Carvalho, Ulla E. Bollmann et Lea Ellegaard-Jensen, « A comparison of the fate of diflufenican in agricultural sandy soil and gravel used in urban areas », Science of The Total Environment, vol. 715, , p. 136803 (DOI 10.1016/j.scitotenv.2020.136803, lire en ligne, consulté le )
- (en) Christian Nyrop Albers, Ole Stig Jacobsen, Kai Bester et Carsten Suhr Jacobsen, « Leaching of herbicidal residues from gravel surfaces – A lysimeter-based study comparing gravels with agricultural topsoil », Environmental Pollution, vol. 266, , p. 115225 (DOI 10.1016/j.envpol.2020.115225, lire en ligne, consulté le )
- (en) Michael T. Rose, Timothy R. Cavagnaro, Craig A. Scanlan et Terry J. Rose, « Impact of Herbicides on Soil Biology and Function », Advances in Agronomy, Elsevier, vol. 136, , p. 133–220 (ISBN 978-0-12-804681-4, DOI 10.1016/bs.agron.2015.11.005, lire en ligne, consulté le )
- (en) María José Carpio et Carlos García-Delgado, « Soil Microbial Community Changes in a Field Treatment with Chlorotoluron, Flufenacet and Diflufenican and Two Organic Amendments », sur Agronomy, (ISSN 2073-4395, DOI 10.3390/agronomy10081166, consulté le ), p. 1166
- (en) Paul V. McCormick, Robert B.E. Shuford et Michael J. Chimney, « Periphyton as a potential phosphorus sink in the Everglades Nutrient Removal Project », Ecological Engineering, vol. 27, no 4, , p. 279–289 (DOI 10.1016/j.ecoleng.2006.05.018, lire en ligne, consulté le )
- (en) Alexander Feckler, Jelena Rakovic, Maria Kahlert et Rikard Tröger, « Blinded by the light: Increased chlorophyll fluorescence of herbicide-exposed periphyton masks unfavorable structural responses during exposure and recovery », Aquatic Toxicology, vol. 203, , p. 187–193 (DOI 10.1016/j.aquatox.2018.08.015, lire en ligne, consulté le )
- Anses - Phytopharmacovigilance - Synthèse des données de surveillance – Diflufénican – décembre 2018 | voir page 9/10
- Tableau 18 (Résultats d’analyses concernant la recherche du diflufénican à partir de la base de données ORP de l’ITSAP - Institut de l'abeille), dans le rapport de l'Anses - Phytopharmacovigilance : Synthèse des données de surveillance – Diflufénican –
- décembre 2018
- (en) Ian P. Ashton, Khalid O. Abulnaja, Kenneth E. Pallett et David J. Cole, « Diflufenican, a carotenogenesis inhibitor, also reduces acyl lipid synthesis », Pesticide Biochemistry and Physiology, vol. 43, no 1, , p. 14–21 (DOI 10.1016/0048-3575(92)90014-Q, lire en ligne, consulté le )
- (en) I.A. Ashton, K.O. Abulnaja, K.E. Pallett et D.J. Cole, « The mechanism of inhibition of fatty acid synthase by the herbicide diflufenican », Phytochemistry, vol. 35, no 3, , p. 587–590 (DOI 10.1016/S0031-9422(00)90566-1, lire en ligne, consulté le )
- http://www.bayercropscience.com/bcsweb/cropprotection.nsf/id/diflufenican.htm?open&l=EN&ccm=200020
- « Hauts-de-France: des parcelles de betteraves détruites à cause d'un herbicide non conforme », sur LA VDN, (consulté le )
- source : Cyril Cogniard, président de la Confédération générale des planteurs de betteraves (CGB) Champagne-Bourgogne, interrogé par la Voix du Nord, in « Hauts-de-France: des parcelles de betteraves détruites à cause d'un herbicide non conforme », sur LA VDN, (consulté le )
- (en) Ana Paula Pinto, Ana Teresa Caldeira, Dora Martins Teixeira et Eunice Mestrinho, « Degradation of terbuthylazine, diflufenican and pendimethalin pesticides by Lentinula edodes cultures », Current Opinion in Biotechnology, vol. 22, , S70 (DOI 10.1016/j.copbio.2011.05.201, lire en ligne, consulté le )
- (en) Hue Thi Dang, Weihua Long, Jenna Moira Malone et Christopher Preston, « No apparent fitness costs associated with phytoene desaturase mutations conferred resistance to diflufenican and picolinafen in oriental mustard (Sisymbrium orientale L.) », Pesticide Biochemistry and Physiology, vol. 155, , p. 51–57 (DOI 10.1016/j.pestbp.2019.01.005, lire en ligne, consulté le )
Voir aussi
Articles connexes
Bibliographie
- (en) « Comparison between accelerated solvent extraction and traditional extraction methods for the analysis of the herbicide diflufenican in soil », Journal of Chromatography A, vol. 765, no 1, , p. 121–125 (ISSN 0021-9673, DOI 10.1016/S0021-9673(96)00948-X, lire en ligne, consulté le )
- (en) « Diflufenican », dans Pesticide Synthesis Handbook, William Andrew Publishing, (ISBN 978-0-8155-1401-5, lire en ligne)