Complexe oxo
Un complexe oxo est un complexe métallique dont un ligand est l'anion bidenté oxyde O2−, généralement pontant, parfois terminal. Ce ligand stabilise les états d'oxydation élevés des cations métalliques[1]. On le trouve dans diverses métalloprotéines, comme les cofacteurs molybdoptérine et FeMoco (« cofacteur à fer et molybdène »), ainsi que dans de nombreuses enzymes contenant du fer. L'un des premiers composés synthétiques contenant un ligand oxo est sans doute le ferrate de potassium K2FeO4, probablement préparé par le chimiste allemand Georg Ernst Stahl dès 1702[2].
Réactions
Olation et réactions acido-basiques
L'olation est une réaction courante des complexes métalliques oxo. C'est une réaction de condensation qui convertit les oxydes de faible poids moléculaire en polymères via ponts oxyde. Elle commence souvent par la déprotonation d'un complexe métallique hydroxo. C'est la base de la minéralisation et de la précipitation des oxydes métalliques.
Transfert d'atome d'oxygène
Les complexes métalliques oxo sont des intermédiaires dans de nombreuses réactions d'oxydation catalysées par des métaux. Le transfert d'atome d'oxygène est une réaction majeure en chimie organique et en biochimie[3]. Certains complexes oxo sont capables de transférer leur ligand oxo sur des substrats organiques. C'est par exemple le cas avec les enzymes de la superfamille des oxotransférases à molybdène, parmi lesquelles on compte la DMSO réductase, la xanthine oxydase, la nitrite réductase et la sulfite oxydase.
Des complexes métalliques oxo interviennent également comme intermédiaires dans la conversion de l'eau en oxygène O2 à l'aide de catalyseurs d'oxydation de l'eau.
Extraction d'atomes d'hydrogène
Les complexes oxo de métaux de transition sont également capables de briser des liaisons fortes C–H, N–H et O–H. Le cytochrome P450 contient un complexe oxo de fer de valence élevée qui est capable d'extraire les atomes d'hydrogène de liaisons C–H fortes[4].
Oxydes moléculaires
Certains des composés oxo les plus connus et les plus largement utilisés sont des oxydants tels que le permanganate de potassium KMnO4 et le tétroxyde d'osmium OsO4[5]. De tels composés sont largement utilisés pour convertir des alcènes en diols vicinaux et des alcools en cétones ou en acides carboxyliques[1]. Parmi les réactifs oxydants plus sélectifs ou plus doux, on compte le chlorochromate de pyridinium [C5H5NH]+[CrO3Cl]− (PCC) et le dichromate de pyridinium [C5H5NH]2[Cr2O7] (PDC)[1]. Les complexes métalliques oxo sont capables d'oxydations catalytiques de divers types, y compris des oxydations asymétriques. Certains complexes oxo favorisent les activations de liaisons C–H, convertissant les hydrocarbures en alcools[6].
![Exemples d'oxydes métalliques moléculaires. De gauche à droite : oxytrichlorure de vanadium (d0), carbonyle oxo de tungstène (d2), permanganate (d0), [ReO2(py)4]+ (d2), composé I du cytochrome P450 (d4) et O=Ir(Mes)3 (d4).](https://img.franco.wiki/i/MOvarietypackPlus.png.webp) Exemples d'oxydes métalliques moléculaires. De gauche à droite : oxytrichlorure de vanadium (d0), carbonyle oxo de tungstène (d2), permanganate (d0), [ReO2(py)4]+ (d2), composé I du cytochrome P450 (d4) et O=Ir(Mes)3 (d4)[7].
Exemples d'oxydes métalliques moléculaires. De gauche à droite : oxytrichlorure de vanadium (d0), carbonyle oxo de tungstène (d2), permanganate (d0), [ReO2(py)4]+ (d2), composé I du cytochrome P450 (d4) et O=Ir(Mes)3 (d4)[7].
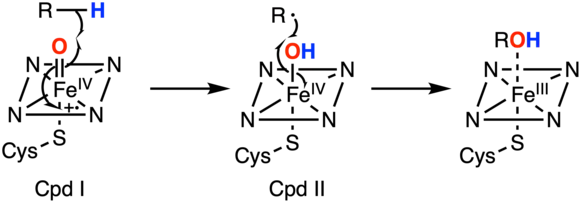
Complexes oxo de fer(IV)
Les complexes oxo de fer(IV) sont des intermédiaires dans de nombreuses oxydations biologiques :
- les hydroxylase α-cétoglutarate-dépendantes (en) activent l'oxygène O2 par décarboxylation oxydative de l'α-cétoglutarate, générant des centres ferryle Fe(IV)=O qui hydroxylent divers substrats hydrocarbonés[8] ;
- les enzymes du cytochrome P450 utilisent un cofacteur héminique, insèrent l'oxygène d'un groupe ferryle dans des liaisons C–H saturées[9], convertissent les alcènes en époxydes[10] - [11], et oxydent les groupes aromatiques[12] ;
- la méthane monooxygénase (en) (MMO) oxyde le méthane en méthanol par transfert d'atomes d'oxygène à partir d'un intermédiaire oxo de fer à son centre di-fer non héminique[6]. Beaucoup d'efforts visent à reproduire des réactions avec des catalyseurs synthétiques[13].
Complexes oxo de molybdène/tungstène
Le ligand oxo (ainsi que le ligand analogue sulfuro (en) S2−) est très présent dans la chimie du molybdène et du tungstène, apparaissant dans les minerais contenant ces éléments, tout au long de leur processus d'extraction ainsi que dans leur rôle biologique (hormis la nitrogénase). On considère généralement que ce sont les anions oxométallate MoO42− et WO42− qui sont transportés biologiquement et utilisés comme points de départ pour la synthèse des espèces biologiquement actives. Toutes les enzymes à molybdène ou à tungstène, hormis la nitrogénase, contiennent un ou plusieurs groupes prosthétiques de molybdoptérine. Les centres Mo ou W oscillent généralement entre les états M(VI) hexavalent et M(IV) tétravalent. Ces enzymes font intervenir un transfert d'atomes d'oxygène entre le centre Mo ou W et le substrat[15]. Ce sont notamment les réactions :
- Sulfite oxydase : SO32− + H2O ⟶ SO42− + 2 H+ + 2 e− ;
- DMSO réductase : H3CS(O)CH3 + 2 H+ + 2 e− ⟶ H3CSCH3 + H2O ;
- Aldéhyde ferrédoxine oxydoréductase (en) : RCHO + H2O ⟶ RCO2H + 2 H+ + 2 e−.
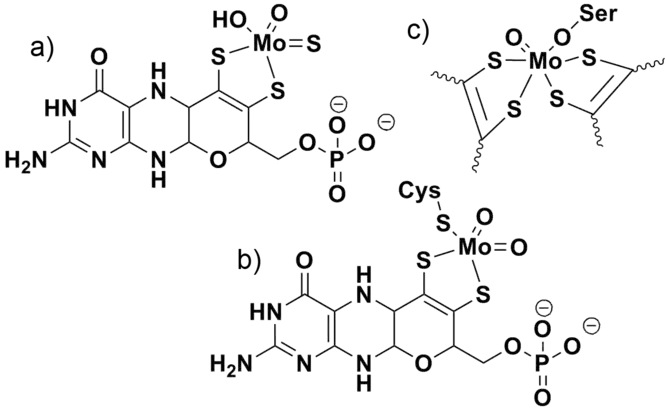 Exemples de cofacteurs à molybdène de (a) la xanthine oxydase, (b) la sulfite oxydase et (c) la DMSO réductase. La DMSO réductase contient également deux ligands molybdoptérine liés au molybdène qui ne sont pas représentés sur la figure pour plus de clarté.
Exemples de cofacteurs à molybdène de (a) la xanthine oxydase, (b) la sulfite oxydase et (c) la DMSO réductase. La DMSO réductase contient également deux ligands molybdoptérine liés au molybdène qui ne sont pas représentés sur la figure pour plus de clarté.
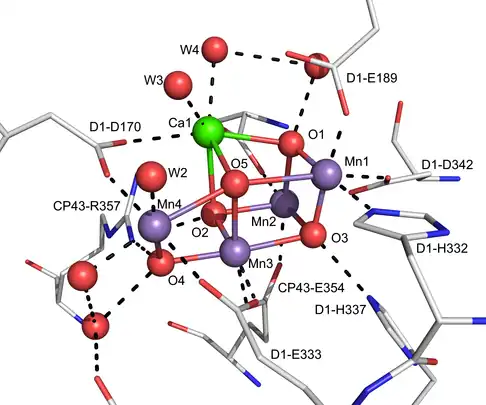
Complexe d'oxydation de l'eau
Le site actif du complexe d'oxydation de l'eau (COE) du photosystème II (PSII) est un complexe Mn4O5Ca avec plusieurs ligands oxo pontants qui participent à l'oxydation des molécules d'eau en oxygène[16]. On pense que le COE utilise un ligand oxo terminal dans la réaction d'oxydation de l'eau. Cette réaction fondamentale est à l'origine de la presque totalité de l'oxygène atmosphérique terrestre.
Notes et références
- (en) W. A. Nugent et J. M. Mayer, Metal-Ligand Multiple Bonds, Wiley, 1988. (ISBN 0-471-85440-9)
- (en) Lionel Delaude et Pierre Laszlo, « A Novel Oxidizing Reagent Based on Potassium Ferrate(VI) », The Journal of Organic Chemistry, vol. 61, no 18, , p. 6360-6370 (PMID 11667478, DOI 10.1021/jo960633p, lire en ligne)
- (en) R. H. Holm, « Metal-centered oxygen atom transfer reactions », Chemical Reviews, vol. 87, no 6, , p. 1401-1449 (DOI 10.1021/cr00082a005, lire en ligne)
- (en) Bernard Meunier, Samuël P. de Visser et Sason Shaik, « Mechanism of Oxidation Reactions Catalyzed by Cytochrome P450 Enzymes », Chemical Reviews, vol. 104, no 9, , p. 3947-3980 (PMID 15352783, DOI 10.1021/cr020443g, lire en ligne)
- (en) Guodong Du et Mahdi M. Abu-Omar, « Oxo and Imido Complexes of Rhenium and Molybdenum in Catalytic Reductions », Current Organic Chemistry, vol. 12, no 14, , p. 1185-1198 (DOI 10.2174/138527208785740238, lire en ligne)
- (en) Ahmet Gunay et Klaus H. Theopold*, « C−H Bond Activations by Metal Oxo Compounds », Chemical Reviews, vol. 112, no 2, , p. 1060-1081 (DOI 10.1021/cr900269x, lire en ligne)
- (en) Robyn S. Hay-Motherwell, Geoffrey Wilkinson, Bilquis Hussain-Bates et Michael B. Hursthouse, « Synthesis and X-ray crystal structure of oxotrimesityliridium(V) », Polyhedron, vol. 12, no 16, , p. 2009-2012 (DOI 10.1016/S0277-5387(00)81474-6, lire en ligne)
- (en) Robert P. Hausinger, « Fe(II)/α-Ketoglutarate-Dependent Hydroxylases and Related Enzymes », Critical Reviews in Biochemistry and Molecular Biology, vol. 39, no 1, , p. 21-68 (PMID 15121720, DOI 10.1080/10409230490440541, S2CID 85784668, lire en ligne)
- (en) Paul R. Ortiz de Montellano, « Hydrocarbon Hydroxylation by Cytochrome P450 Enzymes », Chemical Reviews, vol. 110, no 2, , p. 932-948 (PMID 19769330, PMCID 2820140, DOI 10.1021/cr9002193, lire en ligne)
-
(en) Alfin D. N. Vaz, Dermot F. McGinnity et Minor J. Coon, « Epoxidation of olefins by cytochrome P450: Evidence from site-specific mutagenesis for hydroperoxo-iron as an electrophilic oxidant », Proceedings of the National Academy of Sciences of the United States of America, vol. 95, no 7, , p. 3555-3560 (PMID 9520404, PMCID 19874, DOI 10.1073/pnas.95.7.3555, Bibcode 1998PNAS...95.3555V, lire en ligne
 )
) - (en) Edgardo T. Farinas, Miguel Alcalde et Frances Arnold, « Alkene epoxidation catalyzed by cytochrome P450 BM-3 139-3 », Tetrahedron, vol. 60, no 3, , p. 525-528 (DOI 10.1016/j.tet.2003.10.099, lire en ligne)
- (en) Kenneth Korzekwa, William Trager, Martin Gouterman, Dale Spangler et Gilda Loew, « Cytochrome P450 mediated aromatic oxidation: a theoretical study », Journal of the American Chemical Society, vol. 107, no 14, , p. 4273-4279 (DOI 10.1021/ja00300a033, lire en ligne)
- (en) Thomas C. Brunold, « Synthetic iron-oxo “diamond core” mimics structure of key intermediate in methane monooxygenase catalytic cycle », Proceedings of the National Academy of Sciences of the United States of America, vol. 104, no 52, , p. 20641-20642 (PMID 18093936, PMCID 2409203, DOI 10.1073/pnas.0710734105, Bibcode 2007PNAS..10420641B, lire en ligne)
- (en) Xiongyi Huang et John T. Groves, « Beyond ferryl-mediated hydroxylation: 40 years of the rebound mechanism and C–H activation », Journal of Biological Inorganic Chemistry, vol. 22, no 2, , p. 185-207 (PMID 27909920, PMCID 5350257, DOI 10.1007/s00775-016-1414-3, lire en ligne)
- (en) Günter Schwarz, Ralf R. Mendel et Markus W. Ribbe, « Molybdenum cofactors, enzymes and pathways », Nature, vol. 460, no 7257, , p. 839-847 (PMID 19675644, DOI 10.1038/nature08302, Bibcode 2009Natur.460..839S, S2CID 205217953, lire en ligne)
- (en) Yasufumi Umena, Keisuke Kawakami, Jian-Ren Shen et Nobuo Kamiya, « Crystal structure of oxygen-evolving photosystem II at a resolution of 1.9 Å », Nature, vol. 473, no 7345, , p. 55-60 (PMID 21499260, DOI 10.1038/nature09913, Bibcode 2011Natur.473...55U, S2CID 205224374, lire en ligne)