Chlorure de chrome(III)
On appelle chlorure de chrome(III), ou chlorure chromique, une série de composés de formule CrCl3(H2O)x, où x peut valoir 0, 5 et 6. Le composé anhydre de formule CrCl3 est un solide violet. La forme la plus commune du trichlorure est l'hexahydrate CrCl3(H2O)6, vert foncé. Les chlorures de chrome(III) sont utilisés comme catalyseurs et comme précurseurs de colorants pour la laine.
| Chlorure de chrome(III) | |||
-chloride-purple-anhydrous-sunlight.jpg.webp)
| |||
 | |||
| Anhydre et hexahydrate | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | trichlorure de chrome(3+) | ||
| Synonymes |
chlorure chromique |
||
| No CAS | (hexahydrate) |
||
| No ECHA | 100.030.023 | ||
| No CE | 233-038-3 | ||
| No RTECS | GB5425000 GB5450000 (hexahydrate)[1] |
||
| PubChem | 6452300 | ||
| SMILES | |||
| InChI | |||
| Apparence | poudre cristalline pourpre (anhydre)[2] vert foncé (hexahydrate) |
||
| Propriétés chimiques | |||
| Formule | CrCl3 | ||
| Masse molaire[3] | 158,355 ± 0,007 g/mol Cl 67,16 %, Cr 32,84 %, |
||
| pKa | 2,4 à 20 °C, cc=50 g/L[1] | ||
| Susceptibilité magnétique | +6 890,0 × 10−6 cm3/mol | ||
| Propriétés physiques | |||
| T° fusion | 1 152 °C (anhydre)[4] - [5] 83 °C (hexahydrate)[1] - [5] |
||
| Solubilité | légèrement soluble (anhydre) dans l'eau[5] et l'éthanol[2] 590 g/L à 20 °C (hexahydrate)[1] - [5] insoluble dans l'éther et l'acétone |
||
| Masse volumique | 2,87 g cm−3 à 25 °C (anhydre)[4] 1,76 g cm−3 à 25 °C (anhydre)[1] |
||
| Point d’éclair | ininflammable | ||
| Cristallographie | |||
| Système cristallin | monoclinique | ||
| Classe cristalline ou groupe d’espace | (no 12) [6] |
||
| Structure type | Structure YCl3 | ||
| Paramètres de maille | a = 606,0 pm ; b = 606,0 pm ; c = 658,1 pm ; α = 98.591° ; β = 98.591° ; γ = 119.991° | ||
| Volume | 199,759 Å3 soit 0,199 759 nm3 | ||
| Précautions | |||
| SGH[4] - [1] - [5] | |||
   |
|||
| NFPA 704[7] | |||
| Transport[4] | |||
|
|||
| Écotoxicologie | |||
| DL50 | 1870 mg/kg (rat, oral)[5] - [8] | ||
| Composés apparentés | |||
| Autres cations | Chlorure de molybdène(III) Chlorure de tungstène(III) |
||
| Autres anions | Fluorure de chrome(III) Bromure de chrome(III) Iodure de chrome(III) |
||
| Autres composés |
Chlorure de chrome(II) |
||
| Unités du SI et CNTP, sauf indication contraire. | |||
Structure
Forme anhydre
Le chlorure de chrome(III) anhydre adopte la structure YCl3, où les ions Cr3+ occupent un tiers des interstices octaédriques dans des couches alternées d'un réseau pseudo-cubique à faces centrées d'ions Cl−. L'absence de cations dans une couche sur deux conduit à une faible liaison entre deux couches adjacentes. Pour cette raison, les cristaux de CrCl3 clivent aisément le long des plans entre couches, ce qui donne l'aspect flaky (micacé) des échantillons de chlorure de chrome(III)[9] - [10].
-chloride-sheet-from-monoclinic-xtal-3D-balls-SF-overlay.png.webp) Modèle compact d'empilement cubique à faces centrées d'ions chlorure dans la structure cristalline de CrCl3
Modèle compact d'empilement cubique à faces centrées d'ions chlorure dans la structure cristalline de CrCl3-chloride-sheet-from-monoclinic-xtal-3D-balls.png.webp) Modèle boules-bâtonnets d'une partie d'une couche
Modèle boules-bâtonnets d'une partie d'une couche-chloride-layers-stacking-from-monoclinic-xtal-3D-balls.png.webp) Empilement de couches
Empilement de couches
Hydrates
Les chlorures de chrome(III) possèdent la propriété assez inhabituelle d'exister sous plusieurs formes chimiques distinctes (isomères), qui diffèrent quant au nombre d'anions chlorure coordonnés avec Cr(III) et l'eau de cristallisation. Les différentes formes existent à la fois sous forme solide et en solution aqueuse. Plusieurs membres sont connus des séries [CrCl3−n(H2O)n]z+. Le principal hexahydrate peut être plus précisément décrit comme [CrCl2(H2O)4]Cl(H2O)2. Il est constitué du cation [CrCl2(H2O)4]+ trans et de molécules d'eau supplémentaires et d'un anion chlorure dans le réseau[11]. Deux autres hydrates sont connus, [CrCl(H2O)5]Cl2(H2O) vert pâle et [Cr(H2O)6]Cl3 violet. Un comportement similaire existe avec d'autres composés du chrome(III).
Préparation
Le chlorure de chrome(III) anhydre peut être préparé par chloration du chrome métal directement, ou indirectement par la chloration carbothermique de l'oxyde de chrome(III) à 650–800 °C[12] - [13] :
- Cr2O3 + 3 C + 3 Cl2 → 2 CrCl3 + 3 CO
La déshydratation avec du chlorure de triméthylsilyle dans du THF donne le solvaté[14] :
- CrCl3(H2O)6 + 12 Me3SiCl → CrCl3(THF)3 + 6 (Me3Si)2O + 12 HCl
Il peut aussi être préparé en traitant l'hexahydrate avec du chlorure de thionyle[15] :
- CrCl3(H2O)6 + 6 SOCl2 → CrCl3 + 6 SO2 + 12 HCl
Les chlorures hydratés sont préparés par traitement du chromate avec de l'acide chlorhydrique et du méthanol. Au laboratoire, les hydrates sont habituellement préparés en dissolvant le chrome métal ou l'oxyde de chrome(III) dans l'acide chlorhydrique.
Réactions
Les faibles vitesses de réaction sont classiques avec les complexes de chrome(III). La faible réactivité de l'ion Cr3+ d3 peut être expliquée par la théorie du champ cristallin. Une façon de permettre à CrCl3 de participer à des substitutions en solution est de réduire les très faibles traces restantes en CrCl2, par exemple à l'aide de zinc dans l'acide chlorhydrique. Ce composé chrome(II) participe aux substitutions facilement, et il peut échanger des électrons avec CrCl3 par un pont chlorure, permettant à tous les CrCl3 de réagir rapidement.
Avec la présence de quelques ions chrome(II), cependant, le CrCl3 solide se dissout rapidement dans l'eau. De même, les réactions de substitution de ligands des solutions de [CrCl2(H2O)4]+ sont accélérées par le catalyseur chrome(II).
Avec les chlorures de métaux alcalins fondus tels que le chlorure de potassium, CrCl3 donne des sels de type M3CrCl6 et K3Cr2Cl9, qui sont aussi octaédriques mais où les deux chromes sont liés par trois ponts chlorure.
Complexes avec des ligands organiques
CrCl3 est un acide de Lewis, classé comme "dur" selon le concept HSAB. Il forme plusieurs adduits de type [CrCl3L3]z, où L est une base de Lewis. Par exemple, il réagit avec la pyridine (C5H5N) pour former un adduit :
- CrCl3 + 3 C5H5N → CrCl3(C5H5N)3
Le traitement avec du chlorure de triméthylsilyle dans du THF donne le complexe THF anhydre[16] :
- CrCl3.(H2O)6 + 12 (CH3)3SiCl + 3 THF → CrCl3(THF)3 + 6 ((CH3)3Si)2O + 12 HCl
Précurseur de composés organochromiques
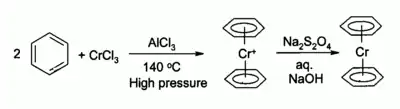
Le chlorure de chrome(III) est utilisé comme précurseur de nombreux composés organochromiques, par exemple le bis(benzène)chrome, un analogue du ferrocène :
Les complexes de phosphine dérivés de CrCl3 catalysent la trimérisation de l'éthylène en hex-1-ène[17] - [18].
Utilisation en synthèse organique
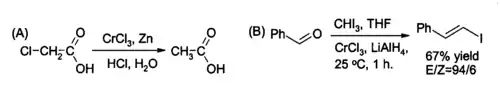
Une utilisation de niche du CrCl3 en synthèse organique concerne la préparation in situ du chlorure de chrome(II), un réactif utilisé pour la réduction des halogénoalcanes et pour la synthèse des halogénures (E)-alcényles. La réaction est habituellement faite avec deux moles de CrCl3 par mole d'hydrure d'aluminium et de lithium, bien que si les conditions d'acidité du milieu aqueux sont appropriées, le zinc et l'acide chlorhydrique peuvent suffire.
Le chlorure de chrome(III) a aussi été utilisé comme acide de Lewis dans des réactions organiques, par exemple pour catalyser la réaction de Diels-Alder nitroso[19].
Colorants
Plusieurs colorants contenant du chrome sont utilisés commercialement pour teinter la laine. Les colorants typiques sont des triarylméthanes constitués de dérivés de l'acide orthohydroxybenzoïque[20].
Précautions
Bien que le chrome trivalent soit beaucoup moins toxique que l'hexavalent, les sels de chrome sont généralement considérés toxiques.
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Chromium(III) chloride » (voir la liste des auteurs).
- Fiche Sigma-Aldrich du composé Chromium(III) chloride hexahydrate 96%, consultée le 11 septembre 2019. + (pdf) fiche MSDS.
- (de) « Chromchloride », sur Römpp Online, Georg Thieme Verlag (consulté le )
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Fiche Sigma-Aldrich du composé Chromium(III) chloride purified by sublimation, 99%, consultée le 11 septembre 2019. + (pdf) fiche MSDS.
- Entrée « Chromium(III) chloride » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 9 janvier 2019 (JavaScript nécessaire).
- https://materialsproject.org/materials/mp-27630/
- Cameo Chemicals MSDS
- Chromium(III) compounds [as Cr(III)], Immediately Dangerous to Life and Health Concentrations (IDLH), National Institute for Occupational Safety and Health (NIOSH).
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, Butterworth-Heinemann, (ISBN 0080379419), p. 1020
- A. F. Wells, 'Structural Inorganic Chemistry, 5th ed., Oxford University Press, Oxford, UK, 1984.
- Ian G. Dance, Hans C. Freeman "The Crystal Structure of Dichlorotetraaquochromium(III) Chloride Dihydrate: Primary and Secondary Metal Ion Hydration" Inorganic Chemistry 1965, volume 4, 1555–1561. DOI 10.1021/ic50033a006
- D. Nicholls, Complexes and First-Row Transition Elements, Macmillan Press, London, 1973.
- (de) Georg Brauer, Handbuch Der Präparativen Anorganischen Chemie, vol. 2, Stuttgart; New York, New York, Ferdinand Enke Verlag; Academic Press, Inc., (1re éd. 1962), 882 p. (ISBN 978-0-323-16129-9, lire en ligne), p. 1340
- Philip Boudjouk, Jeung-Ho So, « Solvated and Unsolvated Anhydrous Metal Chlorides from Metal Chloride Hydrates », Inorg. Synth., vol. 29, , p. 108–111 (DOI 10.1002/9780470132609.ch26)
- Pray, A. P. "Anhydrous Metal Chlorides" Inorganic Syntheses, 1990, vol 28, 321–2. DOI 10.1002/9780470132401.ch36
- (en)Philip Boudjouk, Jeung-Ho So "Solvated and Unsolvated Anhydrous Metal Chlorides from Metal Chloride Hydrates" Inorganic Syntheses, 2007, vol. 29, p. 108-111. DOI 10.1002/9780470132609.ch26
- John T. Dixon, Mike J. Green, Fiona M. Hess, David H. Morgan “Advances in selective ethylene trimerisation – a critical overview” Journal of Organometallic Chemistry 2004, Volume 689, pp 3641-3668. DOI 10.1016/j.jorganchem.2004.06.008
- Feng Zheng, Akella Sivaramakrishna, John R. Moss “Thermal studies on metallacycloalkanes” Coordination Chemistry Reviews 2007, Volume 251, 2056-2071. DOI 10.1016/j.ccr.2007.04.008
- Calvet, G., Dussaussois, M., Blanchard, N. et Kouklovsky, C., « Lewis Acid-Promoted Hetero Diels-Alder Cycloaddition of α-Acetoxynitroso Dienophiles », Organic Letters, vol. 6, no 14, , p. 2449–2451 (PMID 15228301, DOI 10.1021/ol0491336)
- Thomas Gessner and Udo Mayer "Triarylmethane and Diarylmethane Dyes" in Ullmann's Encyclopedia of Industrial Chemistry 2002, Wiley-VCH, Weinheim. DOI 10.1002/14356007.a27_179
Voir aussi
Bibliographie
- Handbook of Chemistry and Physics, 71st edition, CRC Press, Ann Arbor, Michigan, 1990.
- The Merck Index, 7th edition, Merck & Co, Rahway, New Jersey, USA, 1960.
- J. March, Advanced Organic Chemistry, 4th ed., p. 723, Wiley, New York, 1992.
- K. Takai, in Handbook of Reagents for Organic Synthesis, Volume 1: Reagents, Auxiliaries and Catalysts for C-C Bond Formation, (R. M. Coates, S. E. Denmark, eds.), pp. 206–211, Wiley, New York, 1999.