Chlorure de triméthylsilyle
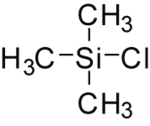
Le chlorure de triméthylsilyle, également connu sous le nom de chlorotriméthylsilane est un halogénure de silyle qui a diverses utilités importantes en chimie organique. Il a pour formule semi-développée (CH3)3SiCl et dans les conditions standards, c'est un liquide incolore qui est stable en l'absence d'eau. Il peut être préparé à partir de tétrachlorure de silicium par substitution nucléophile de trois atomes de chlore par des groupes méthyles avec une source de méthyle nucléophile tel que le méthyllithium. Cependant, ce composé est largement et facilement disponible commercialement.
| Chlorure de triméthylsilyle | |
   |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.000.819 |
| No RTECS | VV2710000 |
| SMILES | |
| InChI | |
| Apparence | liquide clair et incolore qui, exposé à l'air humide, fume |
| Propriétés chimiques | |
| Formule | C3H9ClSi [Isomères] |
| Masse molaire[1] | 108,642 ± 0,005 g/mol C 33,17 %, H 8,35 %, Cl 32,63 %, Si 25,85 %, |
| Propriétés physiques | |
| T° fusion | −40 °C |
| T° ébullition | 57 °C |
| Masse volumique | 0,856 g·cm-3 |
| T° d'auto-inflammation | 400 °C |
| Point d’éclair | −28 °C |
| Précautions | |
| NFPA 704 | |
| Directive 67/548/EEC | |
 C  F |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Usage
Le chlorure de triméthylsilyle a des utilisations variées en chimie organique, à la fois comme source de groupe triméthylsilyle et comme une source anhydre d'ions chlorures. Les groupes fonctionnels tels que les alcools et les amines réagissent quantitativement avec le chlorure de triméthylsilyle, donnant des éthers et des amines de triméthylsilyle. Dans ce cas, le groupe triméthylsilyle peut servir de groupe protecteur, mais la labilité de ce groupe peut en limiter l'utilité.
La triméthylsilylation peut également être utilisée pour augmenter la volatilité de composés comme les acides organiques ou les sucres, ce qui permet de faire la chromatographie en phase gazeuse des substances normalement non-volatiles telles que le glucose. Le chlorure de triméthylsilyle réagit également avec les alcynures (acétylénures) métalliques pour donner des alcynes triméthylsilylés, qui est une forme de protection très efficace des alcynes.
La réaction du chlorure de triméthylsilyle avec des alcools produit un équivalent de chlorure d'hydrogène. Cette réaction peut être exploitée pour créer des solutions alcooliques anhydres d'acide chlorhydrique, qui trouvent leur utilité dans la synthèse douce d'esters et d'acétals à partir d'acides carboxyliques et de cétones, respectivement.
En présence de triéthylamine et de diisopropylamidure de lithium, les aldéhydes énolisables, les cétones et les esters sont convertis en éthers d'énol triméthylsilylés. Malgré leur instabilité vis-à-vis de l'hydrolyse, ces composés ont trouvé une large gamme d'applications en chimie. L'oxydation de la double liaison de l'éther d'énol par époxydation ou dihydroxylation (en), peut être utilisée pour retrouver le groupe carbonyle d'origine et un groupe alcool sur l'atome de carbone en α. Les éthers d'énol triméthylsilylés peuvent être utilisés comme équivalents masqués d'énolates dans l'addition aldolique de Mukaiyama.
Le chlorure de triméthylsilyle peut aussi être utilisé comme composé de départ pour élaborer d'autres halogénures de triméthylsilyle et des pseudohalogénures de triméthylsilyle, tels que :
- Fluorure de triméthylsilyle
- Bromure de triméthylsilyle
- Iodure de triméthylsilyle
- Azoture de triméthylsilyle[2]
- Triflate de triméthylsilyle (TMSOTf = CF3SO3-TMS)
Ces composés sont préparés par une réaction d'échange entre le chlorure de triméthylsilyle et un sel du (pseudo)halogène (MX):
- MX + Me3Si-Cl → MCl + Me3Si-X
Le chlorure de triméthylsilyle est aussi utilisé pour silyler de la verrerie de laboratoire, rendant ainsi leur surface plus lipophile[3].
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Trimethylsilyl chloride » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Trimethylsilyl azide, L. Birkofer et P. Wegner, Org. Synth., 1988, vol. 6, p. 1030.
- comme dans The use of polystyrylsulfonyl chloride resin as a solid supported condensation reagent for the formation of esters: Synthesis of N-[(9-fluorenylmethoxy)carbonyl]-L-aspartic acid; α tert-butyl ester, β-(2-ethyl[(1E)-(4-nitrophenyl)azo]phenyl]amino]ethyl ester, Norbert Zander et Ronald Frank, Org. Synth., 2005, vol. 81, p. 235.
