Chimie des fullerènes
La chimie des fullerènes est un domaine de la chimie organique consacré à l'étude des propriétés chimiques des fullerènes[1] - [2] - [3]. La recherche dans ce domaine est motivée par la nécessité de fonctionnaliser les fullerènes et de modifier leurs propriétés. Par exemple, le fullerène est connu pour être insoluble mais l'ajout d'un groupe adapté peut améliorer sa solubilité. Par l'ajout d'un groupe polymérisable, un polymère du fullerène peut être obtenu. Les fullerènes fonctionnalisés sont divisés en deux catégories : les exofullerènes, avec des substituants à l'extérieur de la cage, et les endofullerènes, avec des molécules piégées dans la cage.
Propriétés chimiques des fullerènes
Le fullerène ou C60 a une forme de ballon de football. Sa symétrie appartient au groupe Ih. Il est constitué de 12 pentagones et 20 hexagones. D'après la Caractéristique d'Euler, ces 12 pentagones sont nécessaires pour effectuer la clôture du réseau carboné constitué de n hexagones, et le C60 est le premier fullerène stable car c'est le plus petit possible obéissant à cette règle. Dans cette structure, aucun des pentagones n'entre en contact avec les autres. À la fois le C60 et son dérivé le C70 obéissent à cette règle du pentagone isolé (RPI). L'homologue suivant, le C84, possède 24 isomères RPI dont plusieurs ont été isolés et 51 568 autres isomères non-RPI. Les fullerènes non-RPI n'ont pour l'instant été isolés que sous forme d'endofullerènes tels que le Tb3N@C84 avec deux pentagones fusionnés au sommet d'une cage en forme d’œuf[4]. ou d'exofullerènes avec stabilisation externe tels que le C50Cl10[5]. et apparemment le C60H8[6]. Les fullerènes inférieurs n'obéissent pas à la règle du pentagone isolé (RPI).
En raison de la forme sphérique de la molécule, les atomes de carbone sp2 ne sont pas plans mais déformés, à mi-chemin vers une géométrie moléculaire trigonale plan, ce qui a de lourdes conséquences sur la réactivité. À cela deux raisons. La première, il est estimé que la tension de cycle représente 80 % de l'enthalpie standard de formation. Les atomes de carbone conjugués répondent à l'écart de planéité par un changement dans l'hybridation orbitalaire des orbitales sp2 et des orbitales pi pour former une orbitale sp2.27 avec un renforcement du caractère p. Les lobes p s'étendent plus loin à l'extérieur de la surface qu'à l'intérieur de la sphère, et c'est l'une des raisons pour lesquelles un fullerène est électronégatif. L'autre raison étant que les orbitales pi* vides et basses en énergie ont également un caractère s élevé.
Les doubles liaisons dans les fullerènes ne sont pas toutes les mêmes. Deux groupes peuvent être identifiés: 30 doubles liaisons notées [6,6] connectent deux hexagones et 60 doubles liaisons [5,6] connectent un hexagone et un pentagone. Les liaisons [6,6] sont plus courtes avec un caractère plus prononcé de double liaison, en conséquence un hexagone est souvent représenté comme un cyclohexatriène et un pentagone comme un pentalène ou [5]radialène. En d'autres termes, bien que les atomes de carbone dans les fullerènes soient tous conjugués la superstructure n'est pas un composé "superaromatique". La diffraction des rayons X donne des longueurs de liaison de 139,1 pm pour les liaisons [6,6] et 145,5 pm pour les liaisons [5,6].
Le fullerène C60 possède 60 électrons pi, mais le remplissage de la couche de valence en nécessite 72. Le fullerène est en mesure d'acquérir les électrons manquants par réaction avec un réducteur comme du potassium pour former d'abord le sel K6C60, ce qui correspond à C606− puis le K12C60, ce qui correspond à C6012−. Dans ce composé l'alternance des longueurs de liaison observée avec la molécule de départ a disparu.
Réactivité des fullerènes
Les fullerènes ont tendance à réagir en tant qu'électrophiles. Leur réactivité est augmentée par la suppression de la tension de cycle lorsque les doubles liaisons deviennent saturées. L'élément clé dans ce type de réaction est la quantité de fonctionnalisations, par exemple une monoaddition vs. une polyaddition et, dans le cas de la polyaddition, les relations topologiques entre les fragments ajouté (substituants entassés vs. espacés régulièrement). En conformité avec les règles de l'IUPAC, les termes méthanofullerènes sont utilisés pour indiquer les dérivés du fullerène dont le substituant se referme en cycle (cyclopropane), et fulleroïdes pour ceux dont le substituant est ouvert (méthanoannulènes).
Addition nucléophile
Les fullerènes réagissent en tant qu'électrophiles avec de nombreux nucléophiles pour subir des additions nucléophiles. L'intermédiaire formé (un carbanion) est capturé par un autre électrophile. Des exemples de nucléophiles sont les réactifs de Grignard et les organolithiens. Par exemple, la réaction du C60 avec le chlorure de méthylmagnésium s'arrête quantitativement à la penta-addition avec les groupes méthyles centrés autour d'un anion cyclopentadiényle qui est par la suite protoné. Une autre réaction nucléophile est la réaction de Bingel. Le fullerène réagit avec le chlorobenzène et le chlorure d'aluminium dans une réaction d'alkylation de Friedel et Crafts. Cette hydroarylation forme le produit de l'addition 1,2ː le (Ar-CC-H).
Réactions péricycliques
Les liaisons [6,6] des fullerènes réagissent en tant que diènes ou diénophiles dans les cycloadditions comme la réaction de Diels-Alder. Des cycles à 4 atomes peuvent être obtenus par cycloadditions [2+2] avec par exemple le benzyne[7] - [8] Un exemple de cycloaddition 1,3-dipolaire formant un cycle à 5 atomes est la réaction de Prato.
Hydrogénation
Les fullerènes sont facilement hydrogénés par plusieurs méthodes. Des exemples d'hydrofullerènes sont le C60H18 et le C60H36. Cependant, le C60H60 totalement hydrogéné n'est qu'hypothétique en raison de la forte tension de cycle. Les fullerènes trop hydrogénés ne sont pas stables car la réaction directe des fullerènes avec de l'hydrogène gazeux à haute température provoque une fragmentation de la cage. Lors de l'étape finale de la réaction, la fragmentation résulte en l'effondrement de la structure de la cage accompagnée par la formation d'hydrocarbures aromatiques polycycliques[9].
Oxydation
Bien que plus difficile que sa réduction, l'oxydation du fullerène est possible, par exemple avec de l'oxygène et du tétroxyde d'osmium.
Hydroxylation
Les fullerènes peuvent être hydroxylés en fullerénols ou fullerols. La solubilité dans l'eau dépend du nombre total de groupes hydroxyles qui peuvent y être attachés. Une méthode est de faire réagir le fullerène dans de l'acide sulfurique dilué en présence de nitrate de potassium pour former du C60(OH)15[10] - [11] Une autre méthode est la réaction dans de l'hydroxyde de sodium dilué catalysée par l'hydroxyde de tétrabutylammonium, ce qui ajoute entre 24 et 26 groupes hydroxyles au composé[12] L'hydroxylation a également été observée dans une réaction sans solvant avec le mélange NaOH / peroxyde d'hydrogène[13] Le C60(OH)8 a été préparé en utilisant une procédure multi-étapes débutant à partir d'un mélange de peroxyde et de fullerène[14]. Le nombre maximum de groupes hydroxyle qui peuvent être attachés (méthode au peroxyde d'hydrogène) s'élève à 36-40[15].
Addition électrophile
Les fullerènes réagissent aussi dans des additions électrophiles. La réaction avec le brome peut ajouter jusqu'à 24 atomes de brome à la sphère. Le détenteur du record pour l'addition de fluor est le C60F48. Selon des prédictions in silico l'insaisissable C60F60 pourrait avoir certains de ses atomes de fluor en position endo (pointant vers l'intérieur) et pourrait ressembler à un tube plus qu'à une sphère[16].
Rétroadditions
Des protocoles ont été étudiés pour la suppression de substituants via des rétroadditions après que ces substituants aient rempli leur rôle. Des exemples sont la rétroréaction de Bingel et la rétroréaction de Prato.
Addition de Carbènes
Les fullerènes réagissent avec les carbènes pour former des méthanofullerènes[17]. La réaction du fullerène avec le dichlorocarbène (créé par pyrolyse du trichloroacétate de sodium) a été observée pour la première fois en 1993[18]. Une simple addition se fait le long d'une liaison [6,6].
Addition de radicaux
Les fullerènes peuvent être considérés comme des piégeurs de radicaux. Avec un radical alkyle tel que le radical du t-butyle obtenu par thermolyse ou photolyse d'un précurseur approprié, le radical tBuC60 est formé et peut être étudié. L'électron non apparié ne se délocalise pas sur l'ensemble de la sphère, mais il se place au voisinage du substituant tBu.
Les fullerènes en tant que ligands
Le fullerène est un ligand en chimie organométallique. La double liaison [6,6] est déficiente en électrons et forme généralement des liaisons métalliques avec une hapticité η = 2. Des modes de liaisons tels que η = 5 ou η = 6 peuvent être induits par la modification de la sphère de coordination. Le fullerène C60 réagit avec de l'hexacarbonyle de tungstène W(CO)6 pour former le complexe (η2-C60)W(CO)5 dans une solution d'hexane au contact direct de la lumière du soleil[19].
Variantes
Fullerènes à cage ouverte
Une partie de la recherche sur les fullerènes est consacrée aux fameux fullerènes à cage ouverte [20] chez lesquels une ou plusieurs liaisons ont été chimiquement détruites pour ouvrir un orifice[21]. De cette manière, il est possible d'insérer à l'intérieur de petits atomes tels que l'hydrogène, l'hélium ou le lithium. Le premier de ces fullerènes à cage ouverte a été observé en 1995[22] Pour les endofullerènes hydratés l'ouverture, l'insertion de l'hydrogène et la fermeture de l'orifice ont déjà été ̩effectuées.
Hétérofullerènes
Dans les hétérofullerènes au moins un atome de carbone est remplacé par un autre élément[23] - [24]. Basées sur la spectroscopie, les substitutions ont été effectuées avec le bore (borafullerènes)[25] - [26], l'azote (azafullerènes)[27] - [28], l'oxygène[29], l'arsenic, le germanium[30], le phosphore[31], le silicium[32], le fer, le cuivre, le nickel, le rhodium[33]. et l'iridium[34] Les publications sur les hétérofullerènes isolés sont limités à ceux qui contiennent de l'azote[35] - [36] - [37] - [38]. et de l'oxygène[39].
Dimères de fullerènes
Le C60 fullerène se dimérise par cycloaddition [2+2] pour former un C120 en forme d'haltère à l'état solide par mécanochimie (haute vitesse de vibration de fraisage), avec le cyanure de potassium en tant que catalyseur[40]. Le trimère a également été obtenu avec la 4-aminopyridine comme catalyseur (4 % de rendement)[41]. et observé par microscopie à effet tunnel, présentant une forme de monocouche[42].
Synthèse
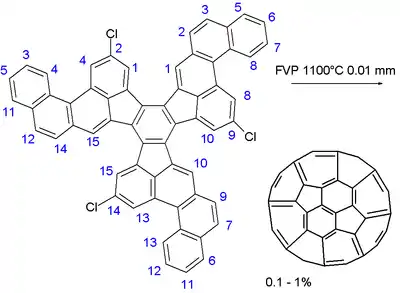
Synthèse multi-étapes du fullerène.
Bien que la procédure pour la synthèse du fullerène C60 soit bien établie (génération d'un courant important entre deux électrodes de graphite sous atmosphère inerte), une étude de 2002 décrit une synthèse organique du fullerène à partir de composés organiques simples[43] - [44]
Dans l'étape finale un grand hydrocarbure aromatique polycyclique, composé de 13 hexagones et trois pentagones est soumis à une pyrolyse-éclair sous vide à une température de 1100 °C et une pression de 0,01 Torr. Les trois liaisons carbone-chlore servent d'incubateur pour former un radical libre et le ballon est entraîné dans une série sans doute complexe de réactions radicalaires. Le rendement chimique est faible: 0,1 à 1 %. Un faible pourcentage de fullerènes est formé dans tout processus qui implique la combustion des hydrocarbures, par exemple dans la combustion d'une bougie. Le rendement obtenu par la méthode de combustion est souvent au-dessus de 1 %. La méthode proposée ci-dessus ne fournit donc aucun avantage pour la synthèse des fullerènes par rapport à l'habituelle méthode de combustion, et par conséquent, la synthèse organique des fullerènes reste un défi pour la chimie.
Un exercice similaire visant à la construction d'une cage C78 en 2008 (mais en abandonnant les halogènes du précurseur) n'a pas abouti à des rendements suffisants, mais a permis d'empêcher l'introduction de défauts de Stone-Wales (en). La synthèse du C60 par le biais d'un précurseur fluoré a été signalée en 2013.
Purification
La purification des fullerènes désigne le processus d'obtention d'un composé fullerène exempt de toute contamination. Lors de la production des fullerènes on obtient systématiquement des mélanges de C60, C70 et d'homologues de rang supérieur. La purification des fullerènes est un élément clé de la science des fullerènes et détermine leur prix et le succès de leurs applications pratiques. La première méthode de purification disponible pour le fullerène C60 a été par HPLC à partir de laquelle de petites quantités peuvent être générées à grands frais.
Une méthode pratique à l'échelle des laboratoires pour la purification de la suie enrichi en C60 et C70 commence avec l'extraction au toluène suivie par une filtration avec un filtre en papier. Le solvant est évaporé et le résidu (la fraction de la suie soluble dans le toluène) est à nouveau dissout dans du toluène et soumis à une chromatographie sur colonne. Le C60 est élué en premier avec une couleur pourpre/violette et est suivi du C70 arborant une couleur brune-rougeâtre.
Lors du traitement des nanotubes, la méthode de purification établie pour éliminer le carbone amorphe et les métaux est l'oxydation compétitive (souvent par un mélange acide sulfurique / acide nitrique). Il est supposé que cette oxydation crée des composés oxygénés (hydroxyle, carbonyle, carboxyle) sur la surface des nanotubes ce qui stabilise ces derniers électrostatiquement dans l'eau et qui peuvent plus tard être utilisés pour la fonctionnalisation chimique. Un rapport révèle en fait que les composés oxygénés se combinent avec des impuretés absorbées sur les parois du nanotube qui peuvent être retirées par simple lavage. Nettoyer les nanotubes réduit leur ratio D/G ce qui est indicatif d'une plus faible fonctionnalisation, et l'absence d'oxygène est également visible par spectroscopie INFRAROUGE et par spectroscopie photoélectronique à rayons X.
Stratégies expérimentales de purification
Une récente stratégie de purification du fullerène à l'échelle du kilogramme a été mise en œuvre par Nagata et coll. Dans cette méthode le C60 a été isolé à partir d'un mélange de C60, C70 et de composés fullerènes de plus haut rang en ajoutant d'abord le composé DBU (une amidine) à une solution du mélange carboné dans le 1,2,3-triméthylbenzène. Il s'avère que le DBU ne réagit qu'avec les fullerènes C70 et de plus haut rang, les produits de la réaction se séparent ensuite et peuvent être retirés par filtration. Les fullerènes C60 n'ont aucune affinité pour DBU et sont par la suite isolés. D'autres diamines comme le DABCO ne possèdent pas cette sélectivité.
Le C60 (mais pas le C70) forme un composé d'inclusion 1ː2 avec la cyclodextrine (CD). Une méthode de séparation pour les deux fullerènes basée sur ce principe est rendu possible par l'ancrage de la cyclodextrine à des particules d'or colloïdal via un pont disulfure[45]. Le composé Au/CD est très stable, soluble dans l'eau et extrait sélectivement le C60 à partir du mélange insoluble après avoir été mis à reflux pendant plusieurs jours. Le fullerène C70 est ensuite éliminé par simple filtration. Le C60 est séparé du composé Au/CD par l'ajout d'adamantanol qui a une plus grande affinité pour la cavité de la cyclodextrine. L'Au/CD est complètement recyclé lorsque l'adamantanol est à son tour chassé par l'ajout d'éthanol et l'éthanol éliminé par évaporation; 50 mg d'Au/CD capturent 5 mg de fullerène C60.
Références
- (en) Fullerenes and Related Structures (Topics in Current Chemistry), Berlin, Springer, , 246 p. (ISBN 3-540-64939-5).
- (en) F. N. Diederich, « Covalent fullerene chemistry », Pure and Applied Chemistry, vol. 69, no 3, , p. 395–400 (DOI 10.1351/pac199769030395).
- (en) M. Prato, « [60]Fullerene chemistry for materials science applications », Journal of Materials Chemistry, vol. 7, no 7, , p. 1097–1109 (DOI 10.1039/a700080d, lire en ligne).
- (en) C. M. Beavers, T. Zuo, J. C. Duchamp, K. Harich, H. C. Dorn, M. M. Olmstead et A. L. Balch, « Tb3N@C84: An Improbable, Egg-Shaped Endohedral Fullerene that Violates the Isolated Pentagon Rule », Journal of the American Chemical Society, vol. 128, no 35, , p. 11352–11353 (PMID 16939248, DOI 10.1021/ja063636k).
- (en) « Capturing the Labile Fullerene[50] as C50Cl10 », Science, vol. 304, no 5671, , p. 699 (PMID 15118154, DOI 10.1126/science.1095567, lire en ligne).
- (en) Q. H. Weng, Q. He, T. Liu, H. Y. Huang, J. H. Chen, Z. Y. Gao, S. Y. Xie, X. Lu, R. B. Huang et L. S. Zheng, « Simple Combustion Production and Characterization of Octahydro[60]fullerene with a Non-IPR C60 Cage », Journal of the American Chemical Society, vol. 132, no 43, , p. 15093–15095 (PMID 20931962, DOI 10.1021/ja108316e).
- (en) S. H. Hoke, J. Molstad, D. Dilettato, M. J. Jay, D. Carlson, B. Kahr et R. G. Cooks, « Reaction of fullerenes and benzyne », The Journal of Organic Chemistry, vol. 57, no 19, , p. 5069 (DOI 10.1021/jo00045a012).
- (en) A. D. Darwish, A. G. Avent, R. Taylor et D. R. M. Walton, « Reaction of benzyne with [70]fullerene gives four monoadducts: Formation of a triptycene homologue by 1,4-cycloaddition of a fullerene », Journal of the Chemical Society, Perkin Transactions 2, no 10, , p. 2079 (DOI 10.1039/P29960002079).
- (en) A. V. Talyzin, Y. O. Tsybin, J. M. Purcell, T. M. Schaub, Y. M. Shulga, D. Noréus, T. Sato, A. Dzwilewski, B. Sundqvist et A. G. Marshall, « Reaction of Hydrogen Gas with C60at Elevated Pressure and Temperature: Hydrogenation and Cage Fragmentation† », The Journal of Physical Chemistry A, vol. 110, no 27, , p. 8528–8534 (PMID 16821837, DOI 10.1021/jp0557971).
- (en) L. Y. Chiang, J. W. Swirczewski, C. S. Hsu, S. K. Chowdhury, S. Cameron et K. Creegan, « Multi-hydroxy additions onto C60 fullerene molecules », Journal of the Chemical Society, Chemical Communications, no 24, , p. 1791 (DOI 10.1039/C39920001791).
- (en) L. Y. Chiang, R. B. Upasani, J. W. Swirczewski et S. Soled, « Evidence of hemiketals incorporated in the structure of fullerols derived from aqueous acid chemistry », Journal of the American Chemical Society, vol. 115, no 13, , p. 5453 (DOI 10.1021/ja00066a014).
- (en) J. Li, A. Takeuchi, M. Ozawa, X. Li, K. Saigo et K. Kitazawa, « C60 fullerol formation catalysed by quaternary ammonium hydroxides », Journal of the Chemical Society, Chemical Communications, no 23, , p. 1784 (DOI 10.1039/C39930001784).
- (en) S. Wang, P. He, J. M. Zhang, H. Jiang et S. Z. Zhu, « Novel and Efficient Synthesis of Water‐Soluble [60]Fullerenol by Solvent‐Free Reaction », Synthetic Communications, vol. 35, no 13, , p. 1803 (DOI 10.1081/SCC-200063958).
- (en) G. Zhang, Y. Liu, D. Liang, L. Gan et Y. Li, « Facile Synthesis of Isomerically Pure Fullerenols and Formation of Spherical Aggregates from C60(OH)8 », Angewandte Chemie International Edition, vol. 49, no 31, , p. 5293–5 (PMID 20575126, DOI 10.1002/anie.201001280).
- (en) K. Kokubo, K. Matsubayashi, H. Tategaki, H. Takada et T. Oshima, « Facile Synthesis of Highly Water-Soluble Fullerenes More Than Half-Covered by Hydroxyl Groups », ACS Nano, vol. 2, no 2, , p. 327–333 (PMID 19206634, DOI 10.1021/nn700151z).
- (en) J. Jia, H. S. Wu, X. H. Xu, X. M. Zhang et H. Jiao, « Fused Five-Membered Rings Determine the Stability of C60F60 », Journal of the American Chemical Society, vol. 130, no 12, , p. 3985–3988 (PMID 18311972, DOI 10.1021/ja0781590).
- Carbene Additions to Fullerenes Michio Yamada, Takeshi Akasaka, and Shigeru Nagase Chemical Reviews Article ASAP DOI 10.1021/cr3004955.
- C61Cl2.
- J. E. Cortés-Figueroa, « An Experiment for the Inorganic Chemistry Laboratory: The Sunlight-Induced Photosynthesis of (η2-C60)M(CO)5 Complexes (M = Mo, W) », Journal of Chemical Education, vol. 80, no 7, , p. 799–346 (DOI 10.1021/ed080p799, Bibcode 2003JChEd..80..799C).
- G. C. Vougioukalakis, M. M. Roubelakis et M. Orfanopoulos, « Open-cage fullerenes: Towards the construction of nanosized molecular containers », Chemical Society Reviews, vol. 39, no 2, , p. 817–844 (PMID 20111794, DOI 10.1039/b913766a).
- M. M. Roubelakis, G. C. Vougioukalakis et M. Orfanopoulos, « Open-Cage Fullerene Derivatives Having 11-, 12-, and 13-Membered-Ring Orifices: Chemical Transformations of the Organic Addends on the Rim of the Orifice », The Journal of Organic Chemistry, vol. 72, no 17, , p. 6526–6533 (PMID 17655360, DOI 10.1021/jo070796l).
- J. C. Hummelen, M. Prato et F. Wudl, « There is a Hole in My Bucky », Journal of the American Chemical Society, vol. 117, no 26, , p. 7003 (DOI 10.1021/ja00131a024).
- DOI 10.1007/3-540-68117-5_3.
- Hummelen, Jan C.; Bellavia-Lund, Cheryl and Wudl, Fred (1999) "Heterofullerenes.
- Chai, Y., Guo, T., Jin, C., Haufler, R. E., Guo, T., Guo, T., Guo, T., Guo, T., Guo, T. et Guo, T., « Fullerenes with metals inside », The Journal of Physical Chemistry, vol. 95, no 20, , p. 7564 (DOI 10.1021/j100173a002, Bibcode 1996CPL...249..399M).
- H. -J. Muhr, R. Nesper, B. Schnyder et R. Kötz, « The boron heterofullerenes C59B and C69B: Generation, extraction, mass spectrometric and XPS characterization », Chemical Physics Letters, vol. 249, nos 5–6, , p. 399 (DOI 10.1016/0009-2614(95)01451-9, Bibcode 1996CPL...249..399M).
- J. Averdung, H. Luftmann, I. Schlachter et J. Mattay, « Aza-dihydro[60]fullerene in the gas phase. À mass-spectrometric and quantumchemical study », Tetrahedron, vol. 51, no 25, , p. 6977 (DOI 10.1016/0040-4020(95)00361-B).
- I. Lamparth, B. Nuber, G. Schick et A. Skiebe, « C59N+ and C69N+: Isoelectronic Heteroanalogues of C60 and C70 », Angewandte Chemie International Edition in English, vol. 34, no 20, , p. 2257 (DOI 10.1002/anie.199522571, Bibcode 1992CPL...199..373C).
- J. F. Christian, Z. Wan, S. L. Anderson et Y. Kawazoe, « O++C60•C60O+ production and decomposition, charge transfer, and formation of C59O+. Dopeyball or [CO@C58]+ », Chemical Physics Letters, vol. 199, nos 3–4, , p. 373 (DOI 10.1016/0009-2614(92)80134-W, Bibcode 1992CPL...199..373C).
- T. Ohtsuki, K. Ohno, K. Shiga et Y. Kawazoe, « Formation of As- and Ge-doped heterofullerenes », Physical Review B, vol. 60, no 3, , p. 1531 (DOI 10.1103/PhysRevB.60.1531, Bibcode 1999PhRvB..60.1531O).
- Möschel, C. et Jansen, M., « Darstellung stabiler Phosphor-Heterofullerene im Hochfrequenzofen », Z. Anorg. Allg. Chem., vol. 625, no 2, , p. 175–177 (DOI 10.1002/(SICI)1521-3749(199902)625:2<175::AID-ZAAC175>3.0.CO;2-2, Bibcode 1999JChPh.110.6927P).
- « Photolysis experiments on SiC mixed clusters: From silicon carbide clusters to silicon-doped fullerenes », The Journal of Chemical Physics, vol. 110, no 14, , p. 6927–6921 (DOI 10.1063/1.478598, Bibcode 1999JChPh.110.6927P).
- W. Branz, I. M. L. Billas, N. Malinowski et F. Tast, « Cage substitution in metal–fullerene clusters », The Journal of Chemical Physics, vol. 109, no 9, , p. 3425 (DOI 10.1063/1.477410, Bibcode 1998JChPh.109.3425B).
- « Experimental and computational studies of heterofullerenes », Nanostructured Materials, vol. 12, nos 5–8, , p. 1071–1076 (DOI 10.1016/S0965-9773(99)00301-3).
- J. C. Hummelen, B. Knight, J. Pavlovich et R. Gonzalez, « Isolation of the Heterofullerene C59N as Its Dimer (C59N)2 », Science, vol. 269, no 5230, , p. 1554–1556 (PMID 17789446, DOI 10.1126/science.269.5230.1554, Bibcode 1995Sci...269.1554H).
- M. Keshavarz-K, R. González, R. G. Hicks et G. Srdanov, « Synthesis of hydroazafullerene C59HN, the parent hydroheterofullerene », Nature, vol. 383, no 6596, , p. 147 (DOI 10.1038/383147a0, Bibcode 1996Natur.383..147K).
- B. Nuber et A. Hirsch, « A new route to nitrogen heterofullerenes and the first synthesis of (C69N)2 », Chemical Communications, no 12, , p. 1421 (DOI 10.1039/CC9960001421).
- G. Zhang, S. Huang, Z. Xiao et Q. Chen, « Preparation of Azafullerene Derivatives from Fullerene-Mixed Peroxides and Single Crystal X-ray Structures of Azafulleroid and Azafullerene », Journal of the American Chemical Society, vol. 130, no 38, , p. 12614–12615 (PMID 18759401, DOI 10.1021/ja805072h).
- N. Xin, H. Huang, J. Zhang et Z. Dai, « Fullerene Doping: Preparation of Azafullerene C59NH and Oxafulleroids C59O3 and C60O4 », Angewandte Chemie International Edition, vol. 51, no 25, , p. 6163–6166 (PMID 22573566, DOI 10.1002/anie.201202777).
- K. Komatsu, G. W. Wang, Y. Murata et T. Tanaka, « Mechanochemical Synthesis and Characterization of the Fullerene Dimer C120 », The Journal of Organic Chemistry, vol. 63, no 25, , p. 9358 (DOI 10.1021/jo981319t).
- K. Komatsu, K. Fujiwara et Y. Murata, « The Mechanochemical Synthesis and Properties of the Fullerene Trimer C180 », Chemistry Letters, no 9, , p. 1016 (DOI 10.1246/cl.2000.1016).
- « Structural Analysis of C60 Trimers by Direct Observation with Scanning Tunneling Microscopy », Angewandte Chemie International Edition, vol. 41, no 6, , p. 969–972 (DOI 10.1002/1521-3773(20020315)41:6<969::AID-ANIE969>3.0.CO;2-I).
- L. T. Scott, M. M. Boorum, B. J. McMahon et S. Hagen, « A Rational Chemical Synthesis of C60 », Science, vol. 295, no 5559, , p. 1500–1503 (PMID 11859187, DOI 10.1126/science.1068427, Bibcode 2002Sci...295.1500S).
- The numbers in image correspond to the way the new carbon carbon bonds are formed.
- Y. Liu, Y. W. Yang et Y. Chen, « Thio[2-(benzoylamino)ethylamino]-β-CD fragment modified gold nanoparticles as recycling extractors for [60]fullerene », Chemical Communications, no 33, , p. 4208–10 (PMID 16100605, DOI 10.1039/b507650a, lire en ligne).