Cyclodextrine
Une cyclodextrine (dite parfois cycloamylose) est une molécule-cage ou cage moléculaire d’origine naturelle qui permet d’encapsuler diverses molécules[1]. Les cyclodextrines se rencontrent aujourd'hui dans un grand nombre de produits agroalimentaires et pharmaceutiques et sont donc l’objet de nombreuses recherches scientifiques.
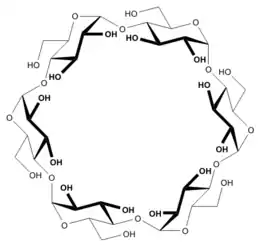
Généralités
Description
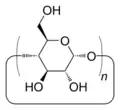
Une cyclodextrine est un oligomère (oligosaccharide) cyclique composé de n chaînons glucopyranose C6H10O5 liés en α-(1,4), d’où la formule brute (C6H10O5)n. Pour les cyclodextrines typiques les valeurs de n sont égales à 6, 7 ou 8. Mais d'autres cyclodextrines ont des valeurs de n plus élevées, de l'ordre de 10 à 30 ou même plus. Les plus grandes de ces molécules sont dites « cyclodextrines géantes »[2], et perdent les propriétés de molécules-cages. Comme c'est le cas en langue anglaise[3] il semble raisonnable de réserver le terme de cycloamyloses à ces cyclodextrines qui tendent à se rapprocher de l'amylose. Cet oligomère en chaîne ouverte possède un grand nombre n de chaînons C6H10O5. On note l'analogie de structure entre : d'une part les trois cyclodextrines typiques et l'amylose, et d'autre part les trois cycloalcanes (CH2)n avec n = 6, 7 ou 8 et le polyéthylène (CH2)n avec n très grand.
Découverte et propriétés
Une première cyclodextrine a été isolée et cristallisée en 1891 par Antoine Villiers-Moriamé[4] comme sous-produit très minoritaire de la dégradation de l'amidon par la bactérie Bacillus amylobacter. La composition chimique qu'il a mesurée est bien celle d'une cyclodextrine mais la solubilité mesurée dans l'eau (13 g/L à 15 °C) était trop faible pour lui permettre d'en déduire la masse molaire par cryoscopie. Cette solubilité correspond bien à celle de la β-cyclodextrine. Au début des années 1900 Schradinger[5] isole la bactérie Bacillus macerans qui dégrade l'amidon en fournissant des cyclodextrines avec un rendement de 25-30% et il cristallise les α- et β- cyclodextrines[6]. On montrera plus tard que d'autres bactéries (ex : Alkalophylic bacillus[7]) font de même. Les cyclodextrines sont encore aujourd'hui principalement produites par dégradation enzymatique de l'amylose (fraction linéaire de l'amidon)[8].
Trois familles sont principalement utilisées ou étudiées les α-, β- et γ-cyclodextrines formées respectivement de 6, 7 et 8 chaînons C6H10O5.
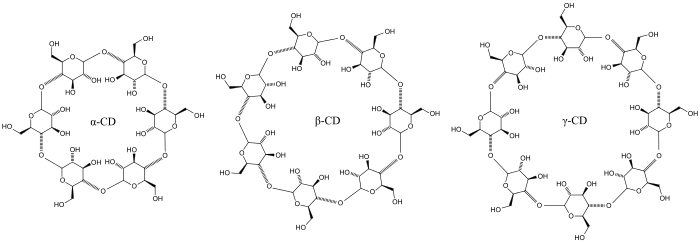
| α-cyclodextrine | β-cyclodextrine | γ-cyclodextrine | |
|---|---|---|---|
| Numéro CAS | |||
| Formule brute | C36H60O30 | C42H70O35 | C48H80O40 |
| Masse molaire (g/mol) | 972,8 | 1135,0 | 1297,1 |
| Température de transition vitreuse | 292 °C ± 2 °C [9]. | ||
| Diamètre en nm de la cavité de 0,79 nm de longueur[10] | 0,47 à 0,53 | 0,60 à 0,65 | 0,75 à 0,83 |
| Solubilité dans l'eau à 25 °C (g/L)[11] | 145 | 18,5 | 232 |
De nombreux dérivés peuvent être obtenus à partir des cyclodextrines naturelles : les groupements hydroxyles des unités glucopyranose peuvent être aminés, estérifiés ou éthérifiés. La synthèse de ces dérivés a souvent pour but d'obtenir une bonne solubilité. Parmi les plus étudiés on trouve des dérivés de la β-cyclodextrine (βCD, naturelle, en anglais native) : l'hydroxypropyl-β-cyclodextrine (HPCD) et la Randomly-methyled-β-cyclodextrine (Rameβ-CD).
Toxicité
En général les cyclodextrines et leurs dérivés hydrophiles sont considérés comme pratiquement non toxiques en administration par voie orale. En effet ces molécules ne diffusent quasiment pas au travers des membranes biologiques et ne sont pas absorbées lors du transit intestinal (DL50 oral, rat 18 800 mg/kg pour la β-cyclodextrine, d'après MSDS). Ainsi dans un rapport de 1995, fondé sur celui de 1993, l’OMS (Joint FAO/WHO Expert committee, 1993, 1995), donnait une Dose Journalière Admissible de 5 mg par kg de masse corporelle pour la βCD, fondé sur une dose sans effet nocif (NOEL) de 1,25 % dans le régime alimentaire chez le chien (coefficient de sécurité de 200). La FDA (Food and Drugs Agency) autorise son utilisation comme additif alimentaire à hauteur de 0,5 à 2 % selon les produits. La BCD est ainsi utilisée dans l’industrie agro-alimentaire comme additif alimentaire (E459).
Ces molécules peuvent être considérées comme éco-compatibles et se dégradent dans le milieu naturel. Toutefois la cyclodextrine naturelle se dégrade plus facilement que les cyclodextrines modifiées : 82 % de biodégradation de la BCD en 28 jours mais seulement 9 % pour la HPCD et 9 % pour la MCD.
Propriétés remarquables
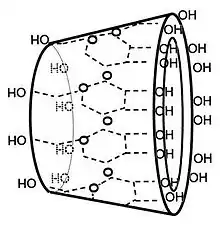
Les cyclodextrines possèdent une structure en tronc de cône, délimitant une cavité en leur centre. Cette cavité présente un environnement carboné apolaire et plutôt hydrophobe (squelette carboné et oxygène en liaison éther), capable d'accueillir des molécules peu hydrosolubles, tandis que l'extérieur du tore présente de nombreux groupements hydroxyles, conduisant à une bonne solubilité (mais fortement variable selon les dérivés) des cyclodextrines en milieu aqueux. On remarquera que la β-CD naturelle est près de dix fois moins soluble que les α-CD et γ-CD naturelles: en effet, toutes les cyclodextrines présentent une ceinture de liaisons hydrogène à l'extérieur du tore. Il se trouve que cette "ceinture" est bien plus rigide chez la β-CD, ce qui explique la difficulté de cette molécule à former des liaisons hydrogène avec l'eau et donc sa plus faible solubilité en milieu aqueux. Grâce à cette cavité apolaire, les cyclodextrines sont capables de former des complexes d'inclusion en milieu aqueux avec une grande variété de molécules-invitées hydrophobes. Une ou plusieurs molécules peuvent être encapsulées dans une, deux ou trois cyclodextrines.
La formation de complexe suppose une bonne adéquation entre la taille de la molécule invitée et celle de la cyclodextrine (l'hôte). « Il se produit de manière non-covalente à l’intérieur de la cavité grâce, soit à des liaisons hydrogène, soit des interactions électroniques de Van der Waals »[7]. L'intérieur de la cavité apporte un micro-environnement lipophile dans lequel peuvent se placer des molécules non polaires. La principale force provoquant la formation de ces complexes est la stabilisation énergétique du système par le remplacement dans la cavité des molécules d'eau à haute enthalpie par des molécules hydrophobes qui créent des associations apolaires-apolaires. Ces molécules invitées sont en équilibre dynamique entre leur état libre et complexé. La résultante de cette complexation est la solubilisation de molécules hydrophobes très insolubles dans la phase aqueuse. Ainsi les cyclodextrines sont capables de complexer en milieu aqueux et ainsi de solubiliser les composés hydrophobes (la polarité de la cavité est comparable à celle d'une solution aqueuse d'éthanol). Les cyclodextrines sont de plus capables de créer des complexes de stœchiométries différentes selon le type de molécule invitée: plusieurs CD peuvent complexer la même molécule ou plusieurs molécules peuvent être complexées par la même CD. Il est d'usage de noter (i:j) la stœchiométrie du complexe, où j indique le nombre de CD impliquées et i le nombre de molécules complexées. Remarquez que les variations autour de ces stœchiométries sont très vastes, les complexes les plus courants étant les (1:1), (2:1) et (1:2), mais des complexes (3:4) ou encore (5:4) existent!
Cas particulier des dimères de cyclodextrines
Il a été publié récemment que certains dimères de cyclodextrines peuvent subir une étrange déformation dans l'eau. En effet, l'unité glucopyranose porteuse du groupement "linker" peut pivoter sur 360° permettant ainsi la formation d'un complexe d'inclusion entre la cyclodextrine et le groupement hydrophobe[12].
Utilisations
En médecine et pharmacologie
Les cyclodextrines sont couramment utilisées comme excipient de formulation dans les médicaments. Elles permettent notamment de transformer des composés liquides en solides (poudres, comprimés) par précipitation des complexes d’inclusion. De nombreux médicaments sont composés de molécules hydrophobes, ce qui ne permet pas de les utiliser en solution injectable, et peut poser des problèmes d'assimilation par voie orale lors de la digestion. La complexation des principes actifs permet de mieux contrôler leur passage dans le système sanguin ou la progressivité de leur diffusion. Une autre application est le traitement par voie sub-linguale. La complexation des principes actifs photosensibles ou très réactifs permet souvent de les protéger ou de les stabiliser.
Elles peuvent aussi être utilisées dans des prothèses internes pour libérer de manière prolongée un médicament : ainsi, un laboratoire du CNRS (l'UMET de l'Université de Lille I) a réussi à utiliser des cyclodextrines sur des stents actifs en alliage Cobalt-Chrome (CoCr) couverts d'un polymère à base de cyclodextrines hydrophiles, biocompatibles et biodégradables jouant le rôle d'un réservoir de médicaments lipophiles et permettant la libération prolongée de médicaments anti-prolifératifs ; de la polydopamine (PDA), un biopolymère qui est un puissant adhésif (utilisé par les moules[13]) a été appliqué en couche fine sur la partie métallique du dispositif (CoCr) permettant ensuite d'y ancrer fortement un polymère de cyclodextrine généré "in situ" à partir de cyclodextrines méthylées et d'acide citrique comme agent de réticulation lors d'une réaction de polycondensation [14]. La sécurité et la durabilité d'usage des stents actifs pourraient ainsi être améliorées en diminuant le risque de thrombose qui jusqu'alors persistait à long terme[15].
La même « colle » (bioinspirée de la colle biologique produite par le byssus des moules pour adhérer à leur support) pourrait permettre d'utiliser à l'intérieur d'un organe ou organisme des nanoparticules magnétiques associées à un biocide antibiotique efficace mais toxique (nanoargent par exemple) mais récupérable (au moyen d'un aimant) après l'avoir laissé agir quelques heures[16].
En agroalimentaire
L'industrie agroalimentaire se sert communément (et depuis plus de 20 ans au Japon) des cyclodextrines comme exhausteur de goût en permettant un ajout facile de composés gustatifs ou pour fixer des molécules trop volatiles et prolonger par exemple la durée gustative des chewing-gums. Elles sont aussi utilisées pour au contraire enlever certaines molécules indésirables, notamment pour réduire les taux de cholestérols ou de composés amers des plats cuisinés. Les cyclodextrines sont aussi employées pour stabiliser des émulsions comme la mayonnaise ou même les margarines.
En chimie analytique
Les cyclodextrines sont de plus en plus utilisées en chimie analytique, notamment en HPLC (Chromatographie en phase Liquide Haute Performance), comme greffe sur la phase stationnaire (silice en général). L'emploi de cyclodextrine permet de changer l’affinité des composés à analyser pour la phase stationnaire, et donc de modifier leur temps de rétention. Les cyclodextrines permettent aussi la séparation d'énantiomères grâce à leurs propriétés de sélecteur chiral.
Une propriété remarquable des cyclodextrines est qu'en complexant certaines molécules photosensibles, elles exaltent leur capacité de réponse à l'excitation (fluorimétrie notamment).
En dépollution des sols
Les cyclodextrines présentent des caractéristiques intéressantes pour être utilisées en dépollution des sols :
- elles sont considérées comme non toxiques et biodégradables ;
- il n'y a pas de concentration minimale ou de seuil critique d'activité, comme c’est le cas pour les surfactants ;
- leur structure rigide et leurs groupements fonctionnels hydroxyles non ionisables leurs procurent une bonne stabilité chimique et physique en solution ;
- elles peuvent être chimiquement modifiées pour améliorer leur solubilité aqueuse ;
- leur coût est comparable aux surfactants usuels (bien que variable selon le type de cyclodextrine utilisée).
Cet usage potentiel fait l'objet de recherches, avec deux voies principales explorées : la bioremédiation et l'extraction. La première approche est étudiée depuis les années 1980, tandis que la seconde a émergé dans les années 1990.
- La bioremédiation ; elle consiste à profiter de la dégradation naturelle des polluants par les microorganismes du sol. Elle peut cependant être lente et faible, dépendant fortement de la toxicité des contaminants et de la capacité des microorganismes à les atteindre : c'est la biodisponibilité, car les microorganismes vivent dans un milieu aqueux et se nourrissent donc de composés dissous dans l'eau ou présent à l'interface de ce milieu. Les polluants hydrophobes, et donc très faiblement solubles dans l’eau sont ainsi très peu dégradés.
Les cyclodextrines peuvent agir comme des surfactants éco-compatibles (pas d'altération de l'équilibre naturel de la flore bactérienne) pour améliorer fortement la biodisponibilité et donc la dégradation de molécules très peu solubles. Leur faible coût, leur biocompatibilité et leur effet accélérateur significatif en font un choix pertinent pour des expériences de bioremédiation. - L'extraction des polluants : elle est traditionnellement réalisée à l'aide de surfactants ou dans certains cas de solvants organiques. Ils servent à évacuer les polluants dans une solution de lavage. Ces produits sont tous plus ou moins toxiques pour l'écosystème du sol.
Les cyclodextrines apparaissent donc comme une alternative intéressante, voire une amélioration majeure de ce procédé. La recherche a montré leur réelle efficacité sur les molécules comme les HAP, les PCB, les pesticides, les molécules d’explosifs et probablement de manière générale sur les polluants hydrophobes.
En métallurgie
Extraction de l'or du minerai brut (ou sa récupération dans les éléments électroniques mis au rebut), sans risque de pollution de l'environnement.
Ce procédé a été découvert par Zhichang Liu de l'équipe de James Fraser Stoddart et auteur principal d'une étude publiée en 2013 dans la revue Nature Communications[17]. Il a mélangé le contenu de deux tubes à essai : l'un contenait de l'α-cyclodextrine, l'autre une solution contenant de l'or, et obtenu ainsi des minuscules aiguilles dans le mélange, constituées par un assemblage de quelque 4000 nano-fils d'ions d'or, maintenus par des atomes, de l'eau et de la cyclodextrine, triant cet or des autres métaux précieux présents dans le minerai, tels que le palladium ou le platine.
« L'élimination du cyanure de l'industrie aurifère est de la plus haute importance pour l'environnement. Nous avons remplacé ces substances redoutables par un matériau bon marché, biologiquement inoffensif, dérivé de l'amidon[18]. »
Autres usages
- désodorisation : les cyclodextrines sont utilisées comme agent masquant contre les mauvaises odeurs (la complexation rend les molécules odorantes moins volatiles) ;
- cosmétique : elles permettent de stabiliser des émulsions et les molécules odorantes ou actives ;
- textiles spéciaux : elles sont utilisées pour fixer au tissu des composés actifs (parfums, antibactériens) ;
- catalyseur de réactions chimiques : en chimie organique, elles permettent de contrôler la régiosélectivité de certaines réactions tout en améliorant leur rendement. Elles jouent le rôle de transporteurs de substrats hydrophobes en phase aqueuse. Elles sont aussi souvent utilisées pour l´élaboration d´enzymes artificielles.
Notes et références
- 1, Menuel, S.; Joly, J.-P.; Courcot, B.; Élysée, J.; Ghermani, N.-E.; Marsua, A. "Synthesis and inclusion ability of a bis-β-cyclodextrin pseudo-cryptand towards Busulfan anticancer agent" Tetrahedron, 67, 7, 1706-1714 doi:10.1016/j.tet.2006.10.070
- K. Gessler, I. Usón, T. Takaha, N. Krauss, S. M. Smith, S. Okada, G. M. Sheldrick & W. Saenger (1999) , Proc. Natl. Acad. Sci. USA, , 96, 4246-4251.
- Cf l'article "cycloamylose" sur Wikipedia.en
- A. Villiers, Comptes Rendus de l'Académie des Sciences, vol 112, p.536, (1891).
- F. Schardinger, Z. Untersuch. Nahr. u. Genussm., 6, 865, (1903) ; Wien. Klin. Wochschr. 17, 207 (1904) ; Zentr. Bakteriol. Parasitenk. Abt. II, 14, 772 (1905) ; Zentr. Bakteriol. Parasitenk. Abt. II., 29, 188 (1911).
- E.M.Martin Del Valle, Cyclodextrins and their uses: a review, Process Biochemistry, 39, 1033-1046 (2004).
- Decottignies, Audrey (2013) [Catalyse dans l’eau en présence de cyclodextrine native ou modifiée – Application au couplage croisé de type Suzuki] ; Thèse de doctorat en Génie des Procédés Industriels et développement durable, soutenue le 22 mars 2013, à l'Université de Compiègne ; voir notamment chap II.1.2. Caractéristiques structurales p 42./187 du pdf, et chap II.1.4. Complexes d’inclusion p 45/187
- Les Cyclodextrines : molécules cages (cours de chimie de Chimie-sup.fr
- Characterization of the hidden glass transition of amorphous cyclomaltoheptaose, Nicolas Tabary, Aurélien Mahieu, Jean-François Willart, Emeline Dudognon, Florence Danède, Marc Descamps, Maryse Bacquet, Bernard Martel, Université Lille1, Unité Matériaux et Transformations (UMET), UMR CNRS 8207, F-59655 Villeneuve d’Ascq, France 2011
- (en) Katsuhiko Ariga et Toyoki Kunitake, Supramolecular Chemistry – Fundamentals and Applications Advanced Textbook, Springer-Verlag Berlin Heidelberg, , 1re éd., 208 p. (ISBN 3-540-01298-2, lire en ligne), p. 22
- J. C. de Miranda; T. E. A. Martins, F. Viega, H. G. Ferraz; "Cyclodextrins and ternary complexes: technology to improve solubility of poorly soluble drugs", Brazilian Journal of Pharmaceutical Sciences, 2011, 47(4), 665-681.
- 4, S. Menuel, N. Azaroual, D. Landy, N. Six, F. Hapiot, E. Monflier "Unusual Inversion Phenomenon of β-Cyclodextrin Dimers in Water" Chemistry - A European Journal, 2011, 3949-3955 - doi : 10.1002/chem.201003221
- Mussel-Inspired Surface Chemistry for Multifunctional Coatings Haeshin Lee, Shara M. Dellatore, William M. Miller, Phillip B. Messersmith Science 19 October 2007: Vol. 318 no. 5849 pp. 426–430 doi:10.1126/science.1147241
- J. Sobocinski, W. Laure, M. Taha, E. Courcot, F. Chai, N. Simon, A. Addad, B. Martel, S. Haulon, P. Woisel, N. Blanchemain, J. Lyskawa, (2014) Mussel inspired coating of a biocompatible cyclodextrins based polymer onto CoCr vascular stents, ACS Applied Materials & Interfaces [doi: 10.1021/am405774v]
- Stent thrombosis with drug-eluting and bare-metal stents: evidence from a comprehensive network meta-analysis. Palmerini T, Biondi-Zoccai G, Della Riva D, Stettler C, Sangiorgi D, D'Ascenzo F, Kimura T, Briguori C, Sabatè M, Kim HS, et al. Lancet. 2012 Apr 14; 379(9824):1393-402. Epub 2012 Mar 23.
- Manthiriyappan Sureshkumar, Dessy Yovita Siswanto and Cheng-Kang Lee, J (2010) Magnetic antimicrobial nanocomposite based on bacterial cellulose and silver nanoparticles . Mater. Chem., , 20, 6948-6955 (résumé)
- Zhichang Liu et al., Selective isolation of gold facilitated by second-sphere coordination with α-cyclodextrin, Nature Communications, 2013, vol.4, Article number:1855. DOI 10.1038/ncomms2891; en ligne.
- Le sucre, mine d'or vert ? sciencesetavenir.nouvelobs.com, le 14-05-2013
Voir aussi
Articles connexes
Liens externes
Bibliographie
- Bakkour, Y. (2005). Étude par RMN des complexes d'inclusion avec des cyclodextrines natives et polymérisées (Thèse de doctorat, Univ. de Lille 1) (lien-présentation).
- Salvador, A. (1998). Cyclodextrines méthylées: analyse, caractérisation et utilisation comme sélecteurs chiraux en électrophorèse capillaire et chromatographique en phase supercritique (Thèse de doctorat, Univ. Orléans) (lien-présentation).
- Blach, P. (2005, January). Nouveaux absorbants pour le traitement des émissions de composés organiques volatils. Littoral Thèse de doctorat (lien-présentation).
- Pailler, J. Y. (2004). Synthèse et étude des anhydro-cyclodextrines: application à la décontamination en milieu biologique (Thèse de doctorat, Grenoble 1) (lien-présentation).
- Pharmacie galénique Formulation et technologie pharmaceutique, chap 7, Systèmes colloïdaux de cyclodextrines modifiées Sous la direction de P;Wehrlé (2012) (ISBN 978-2-224-03142-8)