Évolution du cerveau
Les principes qui régissent l'évolution de la structure du cerveau ne sont pas bien compris. La notion d'intelligence et les moyens de la mesurer font débat et, malgré les progrès importants de la neurologie ces dernières années, les mécanismes de l'apprentissage et de la cognition et plus généralement le fonctionnement du cerveau ne sont pas bien compris.

La taille du cerveau n'est pas corrélée à la taille du corps isométriquement mais plutôt allométriquement. C'est-à-dire qu'il n'y a pas de relation linéaire entre la taille du cerveau et du corps. Par exemple, les petits mammifères ont des cerveaux relativement gros par rapport à leur corps et les grands mammifères (comme les baleines) ont comparativement de petits cerveaux rapporté à leur taille. Les propriétés du cerveau supposées être pertinentes pour l'intelligence sont la taille relative du cerveau (son degré d’encéphalisation), et la part du cortex, du cortex préfrontal, et du cervelet dans le volume global du cerveau. En réalité, le nombre de neurones corticaux et la vitesse de conduction, qui sont les bases du traitement de l'information, sont des indicateurs plus pertinents[1].
Si le poids du cerveau est tracé en fonction du poids corporel chez les primates, la ligne de régression des points d'échantillonnage peut donner une indication de la capacité cognitive d'une espèce de primates. Les Lémuriens, par exemple, se situent au-dessous de cette ligne, ce qui signifie que leur cerveau est plus petit que la moyenne des primates de taille équivalente. Les humains se situent au-dessus de la ligne, ce qui indique qu'ils ont un cerveau plus gros que la moyenne des primates de taille comparable. En fait, les humains se situent à l’extrémité supérieure de la courbe des primates vivants. Les hommes de Neandertal, aujourd’hui disparus, possédaient un cerveau plus volumineux que les hommes modernes[2], mais avec un coefficient d'encéphalisation moindre.
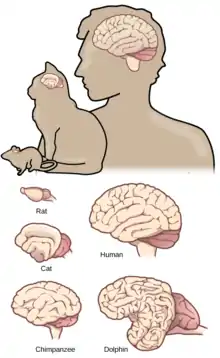
Le coefficient ou quotient d'encéphalisation est une mesure de la taille relative du cerveau, définie comme le rapport entre la masse du cerveau réelle et la masse du cerveau moyen pour un mammifère de taille équivalente, et est supposé être une estimation approximative de l'intelligence ou de la cognition de l'animal. Les primates se trouvent au sommet de cette échelle, avec les humains atteignant le score le plus élevé. Le coefficient d’encéphalisation a un degré élevé de corrélation avec le comportement d'un animal, notamment sur le plan alimentaire[3].
Chronologie
Système nerveux
| Animal | Poids du
cerveau (en g) |
Coefficient
d'encéphalisation[4] |
Nombre de
neurones corticaux (en millions) |
|---|---|---|---|
| Baleine | 2 600 - 9 000 | 1.8 | n.c. |
| Éléphant | 4 200 | 1.3 | 10 500 |
| Humain | 1 250 - 1 450 | 7.4 - 7.8 | 11 500 |
| Dauphin | 1 350 | 5.3 | 5 800 |
| Gorille | 430 - 570 | 1.5 - 1.8 | 4 300 |
| Chien | 64 | 1.2 | 160 |
| Souris | 0.3 | 0.5 | 4 |
Cerveau primitif
Grâce aux fossiles, les paléoneurologues ont pu déduire que la première structure cérébrale est apparue dans des vers il y a plus de 500 millions d'années[5]. Les cerveaux les plus primitifs n'étaient guère plus que des amas de cellules[6]. Les fonctions du cerveau postérieur trouvées dans ces fossiles comprennent la respiration, la régulation du rythme cardiaque, l'équilibre, les mouvements moteurs de base et des compétences de recherche de nourriture. L'observation des cerveaux des souris, des poulets et des singes a montré que les espèces plus complexes préservent les structures pilotant les comportements de base. Cela signifie que les fonctions plus sophistiquées s'ajoutent aux fonctions basiques sans les remplacer[7]. Le cerveau humain moderne contient également une région du cerveau postérieur dite primitive[8]. Le rôle de cette partie du cerveau est de maintenir les fonctions fondamentales de l'homéostasie. Le pont ou pont de Varole et la moelle allongée sont par exemple deux structures importantes localisées dans cette partie du cerveau située schématiquement à la jonction entre la colonne vertébrale et le cerveau.
Cerveau paléomammifère
Une nouvelle région du cerveau est apparue il y a environ 250 millions d'années après l'apparition du rhombencéphale. Cette région est appelée le cerveau paléomammifère. Les parties principales sont l’hippocampe et les amygdales souvent désigné comme l'aire limbique. Le système limbique traite des fonctions plus complexes, y compris les comportements émotionnels, sexuels et violents, la mémoire et l’olfaction[8].
_(20219595418).jpg.webp)
Cerveau et cervelet
Le tronc cérébral et le système limbique sont principalement constitués par des noyaux neuronaux, qui sont des groupes de neurones étroitement liés par leurs fibres axonales qui les relient les uns aux autres. Les deux autres grandes régions du cerveau (le cerveau antérieur et le cervelet) sont basées sur une architecture corticale. À la périphérie externe du cortex, les neurones sont disposés en couches (dont le nombre varie selon l'espèce et la fonction) de quelques millimètres d'épaisseur. Il y a des axones qui se déplacent entre les couches, mais la majorité de la masse des axones est en dessous des neurones eux-mêmes. Les neurones corticaux et leurs faisceaux de fibres axonales ne devant pas rivaliser pour l'espace, les structures corticales peuvent évoluer plus facilement que dans une structure de noyaux neuronaux. Une caractéristique clé du cortex est que parce qu'il se développe « en surface », sa taille peut être augmentée à l'intérieur d'un crâne en introduisant des convolutions. De manière imagée, cela peut être comparé l'introduction d’un linge dans un verre en le chiffonnant. Le degré de convolution est généralement supérieur chez les espèces plus évoluées, qui bénéficient alors de l'augmentation de la surface du cortex.
Le cervelet, ou « petit cerveau », est situé derrière le tronc cérébral et en dessous du lobe occipital du cerveau chez l'homme. Son rôle comprend la coordination des tâches fines sensorielles et il peut être impliqué dans certaines fonctions cognitives, comme le langage. Le cortex cérébelleux humain est finement alambiqué, beaucoup plus que le cortex cérébral. Ses axones intérieurs sont appelés arbor vitae ou arbre de vie.
Néocortex et cortex
La zone du cerveau ayant subi le plus grand nombre de changements récents au cours de l'évolution est appelée le néocortex. Avec le paléocortex et l'archicortex, ils composent le cortex. Chez les reptiles et les poissons, cette zone est appelée le pallium et est plus petit et plus simple par rapport à leur masse corporelle que chez les mammifères. Selon l'état actuel des connaissances, le néocortex se serait d'abord développé il y a environ 200 millions d'années.
Les premiers mammifères placentaires sont apparus environ 125 millions d’années BP et leur morphologie ne semble pas avoir été très différente des marsupiaux et des opossums actuels[9]. Ils étaient petits avec de petits cerveaux avec un sens de l'odorat développé et un néocortex réduit. Le néocortex primitif a évolué à partir d’une seule couche de neurones pyramidaux du cortex dorsal en une structure à six couches présente chez tous les mammifères actuels. Le néocortex a été divisé en 20 - 25 aires corticales, y compris des zones sensorielles primaires et certaines secondaires qui caractérisent le néocortex de presque tous les mammifères aujourd'hui. Les premiers primates étaient des animaux nocturnes et insectivores avec une région élargie du cortex visuel temporel. Ces primates étaient adaptés à la vie dans les branches de la forêt tropicale et avaient un système visuel élargi qui leur permettait une reconnaissance d’objet efficace pour saisir des insectes, de petits vertébrés ou des fruits. Leur néocortex était déjà important et comprenait un éventail de zones corticales présentes aujourd’hui chez tous les primates vivants. Lorsque les anthropoïdes diurnes ont émergé, le système visuel s’est spécialisé en une vision de type fovéal.
Le néocortex est responsable des fonctions cognitives supérieures - par exemple, le langage, la pensée et les formes connexes de traitement de l'information[10]. Il est également responsable du traitement des entrées sensorielles (conjointement avec le thalamus qui est une partie du système limbique et qui agit en tant que routeur de l’information). La plupart de ses fonctions ne sont pas perçues par la conscience et sont par conséquent non disponibles pour l'inspection ou l'intervention de l'esprit conscient. Le néocortex est un accroissement ou une excroissance des structures du système limbique avec lequel il est étroitement intégré.
Cerveau humain
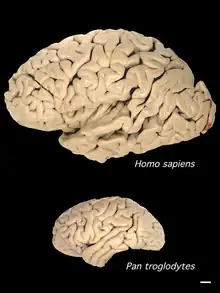
Le néocortex humain constitue environ 80 % du cerveau. Il est divisé en un grand nombre de régions spécialisées : les aires corticales[11]. Bien qu’il n’y ait que des preuves limitées, le nombre de zones corticales, les divisions fonctionnelles fondamentales du cortex, aurait considérablement augmenté avec l'évolution du cerveau humain. Le néocortex des premiers mammifères présentait environ 20 aires corticales distinctes alors que chez l'homme on en compte environ 200, soit une augmentation d’un facteur dix[12].
Le cortex préfrontal, en particulier la zone 10 est proportionnellement plus importante chez les humains[13]. Elle est impliquée dans les fonctions cognitives supérieures telles que la planification des actions futures, les initiatives et l’attention. Le cortex frontal granulaire de l'Homme est non seulement grand, mais il possède des neurones pyramidaux avec plus de cellules dendritiques complexes et plus d’épines pour les synapses[14].
Une autre région ayant particulièrement grandi est le cortex pariétal postérieur. Les ancêtres non-primates des primates avaient un cortex pariétal postérieur très réduit mais tous les primates ont une grande région pariétale postérieure où les stimuli somatosensoriels et visuels influencent les zones ou les domaines du cortex impliqués dans la planification, l'imitation, la saisie d’objets, l'auto-défense et les mouvements oculaires via leurs projections dans le cortex moteur et prémoteur[15]. Le cortex pariétal postérieur est exceptionnellement grand chez les humains. Il a permis l’apparition de nouvelles fonctions, telles que l'utilisation précise de nombreux types d'outils qui est propre aux humains modernes.
La taille du cerveau humain entraine de considérables besoins alimentaires[16] - [17]. Le cerveau humain consomme près de 20 % du métabolisme basal (métabolisme d'un individu au repos) alors qu'il ne représente que 2 % du poids du corps humain[1]. Ces besoins sont satisfaits par des aliments riches en protéines, lipides, et glucides.
L'apparition de la bipédie et le rôle de la thermorégulation (selon la règle d'Allen, les Homo ergaster africains auraient été longilignes) ont été souvent mis en avant pour expliquer l'émergence de nouvelles capacités cognitives. La locomotion bipède et un profil longiligne auraient en effet diminué la taille du canal de naissance[18] (raccourcissement en hauteur et en largeur du bassin) au même moment où la sélection naturelle poussait vers de plus grands cerveaux permettant l'utilisation d'outils. Ce dilemme obstétrical aurait été résolu par la naissance du fœtus à un stade beaucoup plus précoce du développement avec un crâne mou, les fontanelles permettant à la tête de se déformer pour s'adapter au passage par le canal pelvien[19] - [20]. Toutefois, selon une autre analyse plus récente, un bassin maternel plus large n’aurait pas remis en question la bipédie, ni rendu la marche forcément plus difficile. L'immaturité cérébrale à la naissance (appelée altricialité secondaire) serait liée au métabolisme maternel devenu incapable de supporter une gestation plus longue d’une progéniture à grand cerveau (les besoins nutritionnels intra-utérins de cette progéniture étant trop importants)[21] - [22]. Quelle qu'en soit la raison, cette longue maturation du cerveau après la naissance permet à l'enfant humain — et à ses capacités cérébrales — de se développer en lien fort avec son environnement, et ce pendant une longue période[23] - [24] - [25].
Intelligence

Il n'existe pas de définition universelle de l'intelligence. Elle peut être définie et mesurée par la vitesse et le succès pour résoudre des problèmes[26]. La flexibilité mentale et comportementale est souvent considérée comme étant une bonne mesure de l'intelligence. Cette flexibilité permet l'apparition de nouvelles solutions à partir des connaissances précédentes[27]. L'humain est l'animal qui possède la plus grande capacité à trouver de nouvelles solutions[1]. Les oiseaux corvidés sont étonnamment intelligents du point de vue de l'utilisation d'outils, de la flexibilité et de la planification d'actions. Ils peuvent même rivaliser avec les primates dans une certaine mesure[28]. Il existe peu de données comparant l'intelligence entre les différents animaux[1].
Évolution de la taille du cerveau humain
L'évolution du cerveau humain a été une suite complexe de variations de taille, principalement des augmentations, intercalées avec des épisodes de réorganisation du cortex cérébral[29]. La science de l'étude des cerveaux fossiles s'appelle la paléoneurologie.
| Espèce | Volume endocrânien | Date d'apparition |
|---|---|---|
| Sahelanthropus tchadensis | 350 cm3 | 7 millions d'années AP |
| Australopithecus afarensis | 400 à 550 cm3 | 3,9 millions d'années AP |
| Homo habilis | 550 à 700 cm3 | 2,3 millions d'années AP |
| Homo ergaster | 750 à 1 050 cm3 | 2 millions d'années AP |
| Homo neanderthalensis | 1 300 à 1 700 cm3 | 450 000 ans AP |
| Homo sapiens | 1 300 à 1 500 cm3 | 300 000 ans AP |
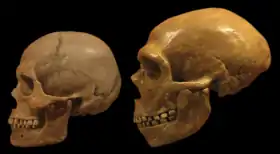
La lignée humaine et celle des chimpanzés ont divergé il y a plus de 7 millions d’années. Leur dernier ancêtre commun avait un cerveau dont le volume représentait probablement moins d'un tiers de celui de l'homme moderne. L'apparition de la bipédie, il y a au moins 7 millions d'années, avec Sahelanthropus tchadensis, aurait eu pour conséquence le recentrage de l'os occipital, alors qu'il oblique vers l'arrière chez les grands singes, et une réorganisation de la structure cérébrale[30].
Au cours des deux derniers millions d'années, le cerveau du genre Homo a considérablement augmenté de taille, en particulier les parties préfrontale, pariétale postérieure, latérale temporale et les régions insulaires. La spécialisation des deux hémisphères cérébraux pour des fonctions connexes mais différentes est devenue plus prononcée, le langage et d'autres capacités cognitives avancées ont émergé[31]. A contrario, certaines parties du cortex n’ont pas changé de taille malgré l’augmentation de volume du cerveau humain, notamment les zones sensorielles et motrices primaires[32].
En première approximation, et faute de pouvoir analyser en détail des cerveaux qui ne se fossilisent pas, les paléoneurologues établissent généralement une corrélation plus ou moins linéaire entre taille du cerveau et capacités cognitives[33]. À différents stades de l'évolution humaine, les avantages du surcroit de capacités cognitives apporté par un plus gros cerveau auraient excédé l'inconvénient d'un besoin supplémentaire en énergie. De meilleures capacités cognitives auraient notamment conféré un avantage pour la survie et la reproduction, et les individus possédant des gènes codants de plus hautes capacités cognitives auraient été en mesure de transmettre davantage leur patrimoine génétique aux générations suivantes.
L'évolution du cerveau ne se serait pas faite de façon linéaire mais par paliers. Les premiers australopithèques possédaient un cerveau un peu plus grand que le cerveau des chimpanzés actuels. Australopithecus afarensis a un volume endocrânien compris entre 400 et 550 cm3, alors que les crânes de chimpanzés vivant aujourd’hui ont un volume interne de moins de 400 cm3. La taille du cerveau a ensuite progressivement augmenté par rapport à la taille du corps pendant 3 millions d'années. Homo habilis, premier représentant connu du genre Homo, apparu il y a 2,3 millions d'années, montre une augmentation modeste de la taille du cerveau. Il présentait en particulier une expansion d'une partie du lobe frontal impliquée dans le langage appelé l'aire de Broca[34]. Les premiers crânes fossiles d'Homo ergaster, datés de 2 millions d'années, présentaient un volume en moyenne légèrement supérieurs à 750 cm3. De là, le volume crânien a lentement augmenté pour atteindre 1 000 cm3 il y a environ un million d'années[35]. Homo ergaster est notamment l'inventeur présumé de l'industrie acheuléenne.
Il y a environ 450 000 ans apparait Homo neanderthalensis. Son cerveau culmine entre 1 500 et 1 700 cm3. Il est l'humain ayant eu le plus grand cerveau. D’après les analyses de fossiles de nouveau-nés néandertaliens, il semble pourtant qu'à la naissance, leur tête n'était pas plus grande que celle des hommes modernes mais la croissance des enfants néandertaliens était plus rapide, ce qui leur permettait d'atteindre un volume crânien plus élevé qu'Homo sapiens[2]. Les Néandertaliens avaient des lobes pariétaux et un réseau vasculaire moins développés et moins complexes que ceux dHomo sapiens, mais des lobes frontaux plus étendus. De plus, le cerveau moderne connait un grand changement de forme durant la première année de la vie du nourrisson, tandis que cette phase de développement précoce était absente chez Néandertal[36].
Les besoins énergétiques croissants du cerveau humain auraient été satisfaits par un meilleur rendement énergétique de l'alimentation, tout d'abord, il y a environ deux millions d'années, par la transformation des aliments par broyage préliminaire pour faciliter la digestion, puis, il y a environ 400 000 ans, par la généralisation de la cuisson, grâce à la domestication du feu[37].
Il y a environ 300 000 ans apparait Homo sapiens[38]. Son cerveau atteint 1 500 cm3 au cours du Paléolithique supérieur. Durant les 20 000 dernières années, le cerveau masculin a diminué de 1 500 à 1 350 cm3 (soit −10 %) et le cerveau féminin dans les mêmes proportions[39]. Des carences nutritionnelles et la diminution de la taille du corps chez les populations agricoles sont un facteur parfois avancé par certains chercheurs pour expliquer cette tendance. D'autres estiment que cela découle de la création des systèmes sociaux et de la division des tâches : chaque être humain a moins de connaissances à stocker[40]. Les hommes actuels sont également plus graciles que les Homo sapiens du Paléolithique supérieur. Les sociétés industrielles des 100 dernières années ont cependant vu la taille du cerveau rebondir. La meilleure nutrition infantile et la diminution du nombre des maladies pourraient en être la raison[35], ou plus simplement la croissance de la taille corporelle moyenne. Finalement, le volume d'un cerveau humain actuel représente environ 3,5 fois celui d'un chimpanzé moderne.
Les conséquences de cette diminution de la taille du cerveau depuis le Paléolithique supérieur ne sont pas clairement établies. Il n’est pas exclu que Néandertal ait eu de meilleures capacités cognitives dans certains domaines. Certains scientifiques pensent que sa vision était meilleure que celle des hommes modernes[41]. Certains chercheurs pensent que les capacités cognitives de Neandertal étaient au moins similaires à celle de l’homme moderne[42] - [30]. D’autres travaux théorisent une plus grande efficacité du cerveau des hommes modernes qui compenserait une taille plus réduite. À partir du Pléistocène supérieur, Homo sapiens d'abord, puis l'Homme de Néandertal ont enterré leurs morts ce qui est une preuve d'une pensée métaphysique. Ils utilisaient tous deux une gamme d'outils plus ou moins élaborés, et ont eu une production artistique, quoique limitée chez Néandertal[30]. De récentes études de 2017 de la plaque dentaire trouvée sur des dents de Néandertaliens suggèrent que les hommes de Néandertal utilisaient des plantes médicinales pour se soigner, notamment des analgésiques (acide salicylique des bourgeons de peuplier) et des antibiotiques naturels (Penicillium)[43].
La croissance la plus rapide du cerveau se réalise pendant les trois premières années de vie[44]. Selon une étude publiée en 2019 et basée sur l'analyse de dents fossiles, les ancêtres de l'homme moderne (genre Homo) allaitaient leurs bébés au lait maternel pendant trois à quatre ans. Les auteurs de l'étude estiment que cette longue période d'allaitement a certainement joué sur le développement du cerveau[45] - [46]. Une étude de 2011 portant sur 128 espèces de mammifères, dont l'homme, établit que plus la durée de l'allaitement d'un mammifère est longue et plus la taille de son cerveau est importante[47]. En 2016, une étude menée par des chercheurs de l’école de médecine de l’université de Washington, portant sur 77 bébés nés prématurés d'au moins 10 semaines, indique que les nourrissons ayant reçu le plus de lait maternel pendant le premier mois de leur vie ont eu aussi la plus importante taille de cerveau[48].
Remarque
Les progrès technologiques et l'augmentation du QI moyen, bien que liés à l’intelligence, ne signifient pas que les capacités cognitives des humains modernes s’améliorent. Ces évolutions sont liées à des changements sociaux et démographiques[30] comme la transmission des savoirs. Certains hommes modernes de tribus primitives tels que les Nambikwara, bien que dotés du même cerveau, vivaient il y a encore quelques décennies dans le dénuement le plus complet sans aucun habillement ou outillage. Un style de vie peu différent des premiers hommes[49]. Des critères reflétant plus objectivement les capacités cognitives et non liés à l’éducation, tels que le temps de réaction, montreraient, au contraire, une diminution des capacités cognitives depuis au moins une centaine d’années[50].
Réarrangement du cerveau humain
Pour certains chercheurs les augmentations quantitatives dans le tissu neural et de la capacité neurale de traitement de l'information ont été les déterminants les plus importants de l'intelligence humaine. Pour d'autres, c’est plutôt une réorganisation du cerveau humain qui a été le principal déterminant de l'augmentation des capacités mentales[51]. Les scientifiques sont arrivés plus récemment à une sorte de consensus lorsqu’ils ont réalisé qu’un changement quantitatif et la réorganisation neuronale ne sont pas des phénomènes mutuellement exclusifs. En effet, chez les mammifères, l'augmentation de la taille du cerveau est corrélée ou prédit diverses formes de réorganisation du cerveau, y compris une diminution de la densité neuronale, une augmentation du nombre des connexions des neurones, un nombre de circonvolutions et fissures accru, une spécialisation accrue des neurones et enfin une augmentation de la taille du néocortex, du cervelet, de l'hippocampe et d'autres structures neurales[52] - [53].
Parmi les espèces de mammifères, celles qui présentent les plus grands cerveaux relatifs sont généralement celles qui ont les plus grandes capacités mentales. Dans de nombreux cas, la taille relative élevée est accompagnée, non seulement de capacités de traitement plus importantes, mais aussi d’une augmentation du nombre de modules neuronaux, d’une augmentation de la taille du néocortex et d'autres zones supérieure du traitement neural et d’une augmentation de la connectivité neuronale[54].
Avec l'utilisation de l'imagerie in vivo par résonance magnétique (IRM) et l'échantillonnage des tissus, différents échantillons corticaux des membres de chaque espèce d'hominidés ont été analysées. Les zones spécifiques du cerveau présentaient une variabilité par la taille suivant les espèces observées. Ces différences peuvent être la marque de la spécificité de l’organisation neuronale de chaque espèce. Des variations de la taille du cortex peuvent montrer des adaptations spécifiques, des spécialisations fonctionnelles et ou des événements évolutifs de l'organisation du cerveau des hominidés. Dans un premier temps, il était considéré que l’analyse du lobe frontal (une partie importante du cerveau qui est responsable du comportement et des interactions sociales) pouvait permettre de prédire les différences de comportement entre les hominidés et les humains modernes. On pense maintenant que l'évolution a eu lieu dans d'autres parties du cerveau qui sont strictement associés à certains comportements.
Alors que les volumes relatifs du cerveau humain sont restés relativement comparables durant le Paléolithique, la position de certains points de repère spécifiques des caractéristiques anatomiques de surface, par exemple le sillon semi-lunaire, suggèrent que les cerveaux ont subi une réorganisation neurologique[55].
Des dents fossiles des premiers humains et hominines montrent que le développement dentaire des enfants marquait une pause, y compris chez les australopithèques[56]. Ces périodes de repos sont des périodes où il n'y a pas d'éruptions dentaires de dents adultes. Pendant cette phase du développement, l'enfant s’habitue à la structure sociale et à la culture[57]. Cette période, absente chez les autres hominidés, donnerait à l'enfant un avantage en lui permettant de se consacrer plusieurs années à son développement cognitif, par exemple au développement de la parole ou de la coopération au sein d'une communauté. Les chimpanzés ne disposent pas de cette période dentaire neutre. Des études suggèrent l’apparition de cette période de repos très tôt chez les hominines[58].
L'intelligence de l'homme semble résulter d'une combinaison et de la mise en valeur de propriétés présentes également chez les primates non-humains plutôt que des propriétés uniques, tels que la théorie de l'esprit, l'imitation et le langage[1].
Facteurs génétiques chez l'humain
Les estimations d'héritabilité basées sur des jumeaux et des familles indiquent que 50% des différences d'intelligence entre individus sont corrélées à des facteurs génétiques[59] - [60]. De même, des études publiées dans Nature Genetics et Molecular Psychiatry montrent une corrélation entre facteurs génétiques et intelligence (mesurée par le QI mais aussi par le nombre d'années d'études)[61] - [62]. C'est seulement à partir de 2017, et l'utilisation d'outils génétiques plus récents, que des résultats reproductibles ont pu être obtenus[63]. Les chercheurs ont identifié des gènes (environ 187 nouveaux locus indépendants impliquant 538 gènes) dont la variation de séquence peut expliquer une variation du degré d'intelligence. Ces gènes sont notamment impliqués dans la neurogenèse, la myélinisation et la synaptogenèse. Aujourd'hui, 10% de la variabilité d'intelligence entre individus est expliquée par la variation de séquences de plusieurs gènes en même temps (genome-wide polygenic scores) et 25% par des polymorphismes d'un seul nucléotide[63]. Autrement dit, 15% de l'héritabilité génétique (pour atteindre les 50% des études sur les jumeaux) liée à l'intelligence n'est pas encore expliquée[63]. Le fait que l'héritabilité est de loin inférieure à 100% indique la participation forte de l'environnement au développement de l'intelligence. Les études manquent aujourd'hui sur l'interaction entre gènes et environnement, qui exprime une sensibilité génétique à un environnement donné[63].
Points communs et différences moléculaires avec d'autres espèces mammifères
Les gènes impliqués dans le neuro-développement sont extrêmement conservés entre les mammifères (94% des gènes en commun avec le chimpanzé, 75% avec la souris), comparé aux autres régions du corps. Les différences d'organisation du cerveau humain avec les autres espèces reposent donc sur un faible nombre de gènes[64].
Les principales différences génétiques reposent sur une évolution des régions inter-géniques, impliquées dans la régulation de l'expression des gènes. Elle conduit à l'expression de gènes au cours du neuro-développement chez l'humain qui ne sont pas exprimés chez les autres espèces. Certaines de ces régions ont évolué très vite chez l'humain (human accelerated regions). Les nouveaux gènes exprimés au cours de la neurogenèse chez l'humain sont notamment impliqués dans les voies cellulaires NOTCH, WNT et mTOR ; il s'agit aussi des gènes codant ZEB2, PDGFD et son récepteur PDGFRβ. Le cortex humain est aussi caractérisé par une augmentation du gradient d'acide rétinoïque dans le cortex préfrontal, conduisant à une augmentation de son volume chez l'humain[65]. Leur action est d'augmenter la durée de la neurogenèse ou d'augmenter les capacités prolifératives des progéniteurs neuraux, conduisant à davantage de neurones corticaux chez l'humain. L'évolution des régions inter-géniques conduit aussi à l'absence d'expression de gènes comparé à d'autres espèces. C'est le cas notamment des gènes GADD45G et FLRT2/FLRT3[64].
La seconde source de différences génétiques entre le génome humain et celui d'autres espèces consiste en l'apparition de nouveaux gènes par duplication. Environ 30 nouveaux gènes (spécifiques à l'humain ou présents dans le génome des hominidés) sont exprimés au cours du neuro-développement. La plupart des gènes étudiés sont impliqués dans la neurogenèse (gènes spécifiquement humains : NOTCH2NLA, NOTCHN2LB, NOTCH2NLC, ARHGAP11B; gènes spécifiques aux hominidés : TBC1D3, TMEM14B). Les patients avec délétions des gènes NOTCH2NL sont atteints de microcéphalie, montrant la nécessité de ces gènes, acquis récemment au cours de l'évolution (moins de 6 millions d'années) dans l'établissement de la taille du cortex cérébral[64].
On connaît beaucoup moins les aspects moléculaires spécifiques de la maturation neuronale chez l'humain. Les gènes conservés entre les mammifères montrent une expression retardée chez l'humain, comparé aux autres espèces, associée à la néoténie du neuro-développement humain. Certains gènes sont exprimés au cours de la maturation neuronale uniquement chez les primates et non les autres espèces ; c'est le cas notamment du gène osteocrin. Un gène spécifique à l'humain, SRGAP2C, serait responsable de la néoténie synaptique, c'est-à-dire une synaptogenèse prolongée dans le temps chez l'humain comparé aux autres espèces[64].
Microcéphaline et ASPM
Bruce Lahn et ses collègues, du Centre médical Howard Hughes à l'Université de Chicago, ont suggéré l’existence de gènes spécifiques contrôlant la taille du cerveau humain. Ces gènes pourraient avoir joué un rôle dans l'évolution du cerveau. L'étude a commencé avec l’évaluation de 214 gènes impliqués dans le développement du cerveau. Ces gènes ont été obtenus à partir d'êtres humains, de macaques, de rats et de souris.
Lahn et les autres chercheurs ont trouvé des séquences d'ADN responsables de la modification des protéines au cours de l’évolution. Le temps nécessaire pour l’apparition de ces changements a ensuite été estimé. Les résultats suggèrent que ces gènes liés au développement du cerveau humain ont évolué beaucoup plus rapidement chez l'homme que chez les autres espèces. Une fois cette preuve génomique acquise, Lahn et son équipe ont décidé de trouver le ou les gènes responsables de cette évolution rapide spécifique. Deux gènes ont été identifiés. Ces gènes contrôlent la taille du cerveau humain. Ces gènes sont la microcéphaline (MCPH1) et la microcéphalie anormale fusiforme (ASPM). Les mutations de la microcéphaline et la microcéphalie anormale fusiforme causent une diminution du volume cérébral jusqu’à une taille comparable à celle des premiers hominidés[66] - [67]. Les chercheurs de l'Université de Chicago ont pu déterminer que sous la pression de la sélection naturelle, des variations significatives de séquences d'ADN de ces gènes se sont répandues. Des études antérieures de Lahn montrent que la microcéphaline a connu une évolution rapide qui a finalement conduit à l'émergence de l'Homo sapiens. Après l'apparition de l'homme, la microcéphaline semble avoir montré un taux d'évolution plus lent. Au contraire, l'ASPM a montré l’évolution la plus rapide après la divergence entre les chimpanzés et les humains[68].
Chacune des séquences de gènes est passée par des changements spécifiques qui a conduit à l’apparition des ancêtres des humains. Afin de déterminer ces modifications, Lahn et ses collègues ont utilisé des séquences d'ADN provenant de plusieurs primates puis comparé ces séquences avec celles des humains. Après cette recherche, les chercheurs ont analysé statistiquement les principales différences entre les primates et l'ADN humain pour arriver à la conclusion que les différences étaient dues à la sélection naturelle. Les changements accumulés dans les séquences d'ADN de ces gènes ont donné un avantage compétitif et une meilleure condition physique aux humains. Ces avantages couplés avec une taille de cerveau plus grande ont permis en fin de compte à l'esprit humain d'avoir une capacité cognitive supérieure[69].
Huntingtine
Tous les humains possèdent deux copies du gène Huntingtin (HTT), qui code la protéine Huntingtine (HTT). Le gène est aussi désigné par HD et IT15. Une partie de ce gène est un triplet de nucléotides CAG répété[70]. Ce gène a été trouvé chez des amibes[71]. Il serait apparu il y a 800 millions d'années[72]. Chez les Deutérostomiens, le gène semble lié à la complexité cérébrale. Un grand nombre de triplet CAG (entre 27-35) chez l'Homme serait corrélé à des capacités cognitives et sensorielles supérieures. La protéine huntingtine joue un rôle clé dans le développement cérébral chez l'Homme[73]. Un nombre supérieur à 35 est responsable du déclenchement de la maladie de Huntington.
Gène Klotho
Le gène KLOTHO est un gène responsable de la synthèse de la protéine Klotho qui est impliquée dans le processus de vieillissement. Il est situé sur le chromosome 13 humain. Certains variants de ce gène chez l'homme et la souris augmente l’activation des NMDAR (en), un récepteur au glutamate. Théoriquement, ce variant augmenterait d'environ 6 points le quotient intellectuel ce qui ferait de Klotho le gène connu ayant le plus d'impact sur l'intelligence à ce jour, devant les gènes NPTN (en) et HMGA2 (en)[74].
Perspectives d'évolutions futures
Une plus grande intégration du cerveau humain avec la technologie et les perspectives qu'offre le génie génétique pourrait donner à l'évolution du cerveau humain un futur imprévisible[35] - [75].
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Evolution of the brain » (voir la liste des auteurs).
- (en) Gerhard Roth et Ursula Dicke, « Evolution of the brain and intelligence », Trends in Cognitive Sciences, vol. 9, , p. 250–257 (ISSN 1364-6613 et 1879-307X, PMID 15866152, DOI 10.1016/j.tics.2005.03.005, lire en ligne, consulté le ).
- (en) Marcia S. Ponce de León, Lubov Golovanova, Vladimir Doronichev et Galina Romanova, « Neanderthal brain size at birth provides insights into the evolution of human life history », Proceedings of the National Academy of Sciences, vol. 105, , p. 13764–13768 (ISSN 0027-8424 et 1091-6490, PMID 18779579, PMCID 2533682, DOI 10.1073/pnas.0803917105, lire en ligne, consulté le ).
- Université de Genève, « 04.10.2010: Evolution des cerveaux: quotient d'encéphalisation, etc. », sur ethologie.unige.ch (consulté le ).
- (en) Harry Jerison, Evolution of The Brain and Intelligence, Elsevier, , 496 p. (ISBN 978-0-323-14108-6, lire en ligne).
- (en) Tae-Yoon S. Park, Ji-Hoon Kihm, Jusun Woo et Changkun Park, « Brain and eyes of Kerygmachela reveal protocerebral ancestry of the panarthropod head », Nature Communications, vol. 9, no 1, , p. 1–7 (ISSN 2041-1723, PMID 29523785, PMCID PMC5844904, DOI 10.1038/s41467-018-03464-w, lire en ligne, consulté le )
- « Evolution of the human brain », sur www.yourgenome.org (consulté le ).
- B. Fritzsch, « Of mice and genes: evolution of vertebrate brain development », Brain, Behavior and Evolution, vol. 52, , p. 207–217 (ISSN 0006-8977, PMID 9787220, lire en ligne, consulté le ).
- C. Redies et L. Puelles, « Modularity in vertebrate brain development and evolution », BioEssays: News and Reviews in Molecular, Cellular and Developmental Biology, vol. 23, , p. 1100–1111 (ISSN 0265-9247, PMID 11746229, DOI 10.1002/bies.10014, lire en ligne, consulté le ).
- Qiang Ji, Zhe-Xi Luo, Chong-Xi Yuan et John R. Wible, « The earliest known eutherian mammal », Nature, vol. 416, , p. 816–822 (ISSN 0028-0836, PMID 11976675, DOI 10.1038/416816a, lire en ligne, consulté le ).
- Donald R. Griffin, « Animal consciousness », Neuroscience & Biobehavioral Reviews, vol. 9, , p. 615–622 (DOI 10.1016/0149-7634(85)90008-9, lire en ligne, consulté le ).
- Jon H. Kaas, « The Evolution of Brains from Early Mammals to Humans », Wiley interdisciplinary reviews. Cognitive science, vol. 4, , p. 33–45 (ISSN 1939-5078, PMID 23529256, PMCID 3606080, DOI 10.1002/wcs.1206, lire en ligne, consulté le ).
- J. H. Kaas, « Why does the brain have so many visual areas? », Journal of Cognitive Neuroscience, vol. 1, , p. 121–135 (ISSN 0898-929X, PMID 23968461, DOI 10.1162/jocn.1989.1.2.121, lire en ligne, consulté le ).
- K. Semendeferi, A. Lu, N. Schenker et H. Damasio, « Humans and great apes share a large frontal cortex », Nature Neuroscience, vol. 5, , p. 272–276 (ISSN 1097-6256, PMID 11850633, DOI 10.1038/nn814, lire en ligne, consulté le ).
- Guy N. Elston, Ruth Benavides-Piccione, Alejandra Elston et Bendan Zietsch, « Specializations of the granular prefrontal cortex of primates: implications for cognitive processing », The Anatomical Record. Part A, Discoveries in Molecular, Cellular, and Evolutionary Biology, vol. 288, , p. 26–35 (ISSN 1552-4884, PMID 16342214, DOI 10.1002/ar.a.20278, lire en ligne, consulté le ).
- Jon H. Kaas, Omar A. Gharbawie et Iwona Stepniewska, « The Organization and Evolution of Dorsal Stream Multisensory Motor Pathways in Primates », Frontiers in Neuroanatomy, vol. 5, (ISSN 1662-5129, PMID 21716641, PMCID 3116136, DOI 10.3389/fnana.2011.00034, lire en ligne, consulté le ).
- Leslie C. Aiello et Peter Wheeler, « The Expensive-Tissue Hypothesi s: The Brain and the Digestive System in Human and Primate Evolution », Current Anthropology, vol. 36, , p. 199–221 (lire en ligne, consulté le ).
- (en) Jennifer L. Fish et Charles A. Lockwood, « Dietary constraints on encephalization in primates », American Journal of Physical Anthropology, vol. 120, , p. 171–181 (ISSN 1096-8644, DOI 10.1002/ajpa.10136, lire en ligne, consulté le ).
- Évolution du bassin chez l'homme, tiré de Laura Tobias Gruss, Daniel Schmitt, « The evolution of the human pelvis: changing adaptations to bipedalism, obstetrics and thermoregulation », Philosophical Transactions of the Royal Society, Vol. 370, n° 1663, 5 mars 2015
- Jean Claude de Mauroy, Bipédie et Biomécanique du complexe lombo-pelvi-fémoral, Clinique du Parc – Lyon
- Évelyne Peyre et Joëlle Wiels, Mon corps a-t-il un sexe ?, La Découverte, , p. 87.
- « Immaturité des bébés : oubliez la taille du bassin! », sur Agence Science Presse, (consulté le )
- (en) Holly M. Dunsworth, Anna G. Warrener, Terrence Deacon, Peter T. Ellison & Herman Pontzer, « Metabolic hypothesis for human altriciality », Proceedings of the National Academy of Sciences of the USA, vol. 38, , p. 15212–15216.
- (en) Karen Rosenberg et Wenda Trevathan, « Bipedalism and human birth: The obstetrical dilemma revisited », Evolutionary Anthropology: Issues, News, and Reviews, vol. 4, , p. 161–168 (ISSN 1520-6505, DOI 10.1002/evan.1360040506, lire en ligne, consulté le ).
- (en) Anna Blackburn Wittman et L Lewis Wall, « The Evolutionary Origins of Obstructed Labor: Bipedalism, Encephalization, and the Human Obstetric Dilemma », Obstetrical & Gynecological Survey, vol. 62, , p. 739–748 (DOI 10.1097/01.ogx.0000286584.04310.5c, lire en ligne, consulté le ).
- Étienne Klein, Évelyne Heyer, « L'Homme : qu'est-ce ? », sur www.franceculture.fr, (consulté le ).
- (en) N. J. Mackintosh, Animal Learning and Cognition, Academic Press, , 398 p. (ISBN 978-0-08-057169-0, lire en ligne).
- (en) Richard W. Byrne, The Thinking Ape : Evolutionary Origins of Intelligence, Oxford University Press, , 266 p. (ISBN 978-0-19-852265-2, lire en ligne).
- (en) Nathan J. Emery et Nicola S. Clayton, « The Mentality of Crows: Convergent Evolution of Intelligence in Corvids and Apes », Science, vol. 306, , p. 1903–1907 (ISSN 0036-8075 et 1095-9203, PMID 15591194, DOI 10.1126/science.1098410, lire en ligne, consulté le ).
- (en) Ralph L. Holloway, Chet C. Sherwood, Patrick R. Hof et James K. Rilling, Evolution of the Brain in Humans – Paleoneurology, Springer Berlin Heidelberg, (ISBN 978-3-540-23735-8 et 9783540296782, lire en ligne), p. 1326–1334.
- Yann Verdo, « 7 millions d'années d'évolution du cerveau », sur lesechos.fr, (consulté le ).
- Jason Hill, Terrie Inder, Jeffrey Neil et Donna Dierker, « Similar patterns of cortical expansion during human development and evolution », Proceedings of the National Academy of Sciences of the United States of America, vol. 107, , p. 13135–13140 (ISSN 0027-8424, PMID 20624964, PMCID 2919958, DOI 10.1073/pnas.1001229107, lire en ligne, consulté le ).
- Todd M. Preuss, « The human brain: rewired and running hot », Annals of the New York Academy of Sciences, vol. 1225, , E182–E191 (ISSN 0077-8923, PMID 21599696, PMCID 3103088, DOI 10.1111/j.1749-6632.2011.06001.x, lire en ligne, consulté le ).
- (en) J. Philippe Rushton et C. Davison Ankney, « Whole Brain Size and General Mental Ability: A Review », The International Journal of Neuroscience, vol. 119, no 5, , p. 692–732 (ISSN 0020-7454, PMID 19283594, PMCID 2668913, DOI 10.1080/00207450802325843, lire en ligne, consulté le )
- Phillip V. Tobias, « L'évolution du cerveau humain | La Recherche », sur www.larecherche.fr, (consulté le ).
- « How has the human brain evolved over the years? », Scientific American Mind, vol. 24, , p. 76–76 (DOI 10.1038/scientificamericanmind0713-76b, lire en ligne, consulté le ).
- Christine Verna, MOOC Les origines de l'Homme, Musée de l'Homme, Néandertal (4.1), voir la vidéo en ligne
- (en) Richard Wrangham, Catching Fire : How Cooking Made Us Human, Profile Books, , 309 p. (ISBN 978-1-84765-210-2 et 1-84765-210-7, lire en ligne)
- « Des Homo sapiens il y a 300 000 ans au Maroc ! », sur Hominidés.com, (consulté le )
- (en) « If Modern Humans Are So Smart, Why Are Our Brains Shrinking? », sur DiscoverMagazine.com, (consulté le ).
- « Le cerveau humain a-t-il rétréci à cause de l'intelligence collective? », sur Slate.fr, (consulté le )
- « Neanderthal Brains Geared for Sight, Not Socializing | Human Evolution », sur Live Science (consulté le ).
- « Neanderthals were not inferior to modern humans, says CU-Boulder study », sur News Center, (consulté le )
- Sid Perkins (2017) Neandertals ate woolly rhinos and mushrooms, may have used painkillers and antibiotics ; Science magazine ; .
- (en) Holly M. Dunsworth, « Thank your intelligent mother for your big brain », Proceedings of the National Academy of Sciences of the United States of America, vol. 113, no 25, , p. 6816–6818 (ISSN 0027-8424, PMID 27286822, PMCID 4922176, DOI 10.1073/pnas.1606596113, lire en ligne, consulté le ) :
« fastest brain growth rate occurs during the first 3 y of life »
- « Le développement du cerveau humain lié à la durée de l'allaitement chez nos ancêtres », sur www.pourquoidocteur.fr, (consulté le )
- (en) « First human ancestors breastfed for longer than contemporary relatives », sur ScienceDaily, (consulté le )
- « L'allaitement est lié à la taille du cerveau », sur The Telegraph, (consulté le )
- « Prématurés : le lait maternel favoriserait leur développement cérébral », sur Femme Actuelle, (consulté le )
- (en) Claude Levi-Strauss, Tristes Tropiques, Penguin, , 448 p. (ISBN 978-1-101-57560-4, lire en ligne).
- « Are Humans Getting Smarter or Dumber? | Intelligence & IQ », sur Live Science (consulté le ).
- Ralph L. Holloway Jr., « Dendritic branching: some preliminary results of training and complexity in rat visual cortex », Brain Research, vol. 2, , p. 393–396 (DOI 10.1016/0006-8993(66)90009-6, lire en ligne, consulté le ).
- (en) B. L. Finlay, R.B. Darlington,, « Neural Development in Metatherian and Eutherian Mammals: Variation and Constraint », The Journal Of Comparative Neurology, no 411, , p. 359-368 (lire en ligne).
- (en) B. L. Finlay et R. B. Darlington, « Linked regularities in the development and evolution of mammalian brains », Science, vol. 268, , p. 1578–1584 (ISSN 0036-8075 et 1095-9203, PMID 7777856, DOI 10.1126/science.7777856, lire en ligne, consulté le ).
- Gibson, Kathleen R., Rumbaugh, Duane et Beran, Michael, « Evolutionary Anatomy of the Primate Cerebral Cortex: Bigger is better: primate brain size in relationship to cognition », Evolutionary Anatomy of the Primate Cerebral Cortex, (DOI 10.1017/CBO9780511897085.007, lire en ligne, consulté le ).
- (en) William H. Kimbel et Lawrence B. Martin, Species, Species Concepts and Primate Evolution, Springer Science & Business Media, , 560 p. (ISBN 978-1-4899-3745-2, lire en ligne).
- (en) Penelope Brown et Stephen C. Levinson, Politeness : Some Universals in Language Usage, Cambridge University Press, , 345 p. (ISBN 978-0-521-31355-1, lire en ligne).
- (en) Peter M. Kappeler et Carel P. van Schaik, Cooperation in Primates and Humans : Mechanisms and Evolution, Berlin/New York, Springer Science & Business Media, , 349 p. (ISBN 978-3-540-28277-8, lire en ligne).
- (en) G. Richard Scott et Joel D. Irish, Anthropological Perspectives on Tooth Morphology : Genetics, Evolution, Variation, Cambridge (GB), Cambridge University Press, , 559 p. (ISBN 978-1-107-01145-8, lire en ligne).
- D. Posthuma, E. J. de Geus et D. I. Boomsma, « Perceptual speed and IQ are associated through common genetic factors », Behavior Genetics, vol. 31, no 6, , p. 593–602 (ISSN 0001-8244, PMID 11838536, lire en ligne, consulté le )
- (en) W. David Hill, Ruben C. Arslan, Charley Xia et Michelle Luciano, « Genomic analysis of family data reveals additional genetic effects on intelligence and personality », Molecular Psychiatry, (ISSN 1476-5578, DOI 10.1038/s41380-017-0005-1, lire en ligne, consulté le )
- (en) Suzanne Sniekers, Sven Stringer, Kyoko Watanabe et Philip R Jansen, « Genome-wide association meta-analysis of 78,308 individuals identifies new loci and genes influencing human intelligence », Nature Genetics, vol. 49, no 7, , p. 1107–1112 (ISSN 1546-1718, DOI 10.1038/ng.3869, résumé)
- (en) W. D. Hill, R. E. Marioni, O. Maghzian et S. J. Ritchie, « A combined analysis of genetically correlated traits identifies 187 loci and a role for neurogenesis and myelination in intelligence », Molecular Psychiatry, (ISSN 1476-5578, DOI 10.1038/s41380-017-0001-5, lire en ligne, consulté le )
- (en) Robert Plomin et Sophie von Stumm, « The new genetics of intelligence », Nature Reviews Genetics, vol. 19, no 3, , p. 148–159 (ISSN 1471-0064, DOI 10.1038/nrg.2017.104, lire en ligne, consulté le )
- (en) Baptiste Libé-Philippot et Pierre Vanderhaeghen, « Cellular and Molecular Mechanisms Linking Human Cortical Development and Evolution », Annual Review of Genetics, vol. 55, no 1, , annurev–genet–071719-020705 (ISSN 0066-4197 et 1545-2948, DOI 10.1146/annurev-genet-071719-020705, lire en ligne, consulté le )
- (en) Mikihito Shibata, Kartik Pattabiraman, Belen Lorente-Galdos et David Andrijevic, « Regulation of prefrontal patterning and connectivity by retinoic acid », Nature, , p. 1–6 (ISSN 1476-4687, DOI 10.1038/s41586-021-03953-x, lire en ligne, consulté le )
- Fernando A. Villanea, George H. Perry, Gustavo A. Gutiérrez-Espeleta et Nathaniel J. Dominy, « ASPM and the Evolution of Cerebral Cortical Size in a Community of New World Monkeys », PLOS ONE, vol. 7, , e44928 (ISSN 1932-6203, PMID 23028686, PMCID 3459963, DOI 10.1371/journal.pone.0044928, lire en ligne, consulté le ).
- C. Geoffrey Woods, James Cox, Kelly Springell et Daniel J. Hampshire, « Quantification of homozygosity in consanguineous individuals with autosomal recessive disease », American Journal of Human Genetics, vol. 78, , p. 889–896 (ISSN 0002-9297, PMID 16642444, PMCID 1474039, DOI 10.1086/503875, lire en ligne, consulté le ).
- (en) David A. Raichlen et John D. Polk, « Linking brains and brawn: exercise and the evolution of human neurobiology », Proceedings of the Royal Society of London B: Biological Sciences, vol. 280, , p. 20122250 (ISSN 0962-8452 et 1471-2954, PMID 23173208, PMCID 3574441, DOI 10.1098/rspb.2012.2250, lire en ligne, consulté le ).
- (en) Patrick D. Evans, Sandra L. Gilbert, Nitzan Mekel-Bobrov et Eric J. Vallender, « Microcephalin, a Gene Regulating Brain Size, Continues to Evolve Adaptively in Humans », Science, vol. 309, , p. 1717–1720 (ISSN 0036-8075 et 1095-9203, PMID 16151009, DOI 10.1126/science.1113722, lire en ligne, consulté le ).
- (en) Francis O. Walker, « Huntington's disease », The Lancet, vol. 369, no 9557, , p. 218–228 (ISSN 0140-6736 et 1474-547X, PMID 17240289, DOI 10.1016/S0140-6736(07)60111-1, lire en ligne, consulté le ).
- Michael A. Myre, Amanda L. Lumsden, Morgan N. Thompson et Wilma Wasco, « Deficiency of Huntingtin Has Pleiotropic Effects in the Social Amoeba Dictyostelium discoideum », PLOS Genetics, vol. 7, no 4, , e1002052 (ISSN 1553-7404, PMID 21552328, PMCID PMC3084204, DOI 10.1371/journal.pgen.1002052, lire en ligne, consulté le ).
- (it) LUCA TOSTI, « Identification of the minimum Huntingtin domain and critical aminoacid sequences involved in a model system of neurulation », sur etd.adm.unipi.it, (consulté le ).
- Inserm, « La huntingtine, un rôle clé dans le développement cérébral », Neuron, (lire en ligne, consulté le ).
- (en) « The 3% solution », The Economist, (lire en ligne, consulté le )
- (en) Nick Bostrom, Superintelligence : Paths, Dangers, Strategies, Oxford University Press, , 328 p. (ISBN 978-0-19-967811-2, lire en ligne).