Événement de suppression du mercure atmosphérique
Un événement de suppression (ou de déplétion) du mercure atmosphérique est un phénomène de chimie de l'atmosphère, encore incompris, par lequel des quantités significatives de mercure élémentaire gazeux présent dans l'atmosphère arctique sont rapidement oxydées et se déposent à la surface, pour être ensuite en grande partie stockées dans le pergélisol.
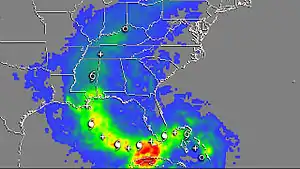
Les « pluies de mercure » commencent brutalement, et elles ne durent que quelques heures à quelques jours[2].
Pouvant débarrasser presque entièrement un grand volume d'air de son mercure[2], elles sont une source majeure de pollution mercurielle des sols et de l'eau. Le dépôt de mercure par cette voie pourrait atteindre des centaines de tonnes par an dans les deux régions polaires[3]. Elles touchent aussi certaines zones continentales (par exemple, 90 à 95 % des apports de mercure dans les Everglades proviennent de telles déplétions[1]) ainsi que, localement, les fruits de mer et le poisson[4]. Dans cette région, environ 85 % des précipitations de mercure se produisent durant les mois d'été, quand la formation d'ozone est favorisée et que les alizés apportent un air iodé[5] de l'Océan Atlantique (Guentzel 1997, cité par Atkeson & Parks[1]).
Histoire de la connaissance du phénomène



- Ce phénomène a été découvert (et pour la première fois mesuré) au Canada, en 1998 par William Schroeder, Alexandra Steffen et leurs collègues de l'agence gouvernementale « Environnement Canada »[2] ; En une dizaine de minutes (alors que le mercure est habituellement relativement stable et dispersé de manière homogène dans l'air) « ces concentrations pouvaient passer de 1,5 ng/m3 à moins de 0,1 ng/m3, comme si l'atmosphère se vidait de son mercure élémentaire »[6]. Ces pluies de mercure n'ont d'abord été observées qu'au printemps et en région arctique, puis d'autres de ces pluies ont été observées ailleurs[6].
- On en a détecté dans des régions subarctiques[7] - [8] - [9] - [10] - [11], dont au nord du Midwest et en Scandinavie.
- Un phénomène similaire à celui observé dans l'arctique a plus récemment été étudié en antarctique par les allemands (Ralf Ebinghaus et Christian Temme, du GKSS de Hambourg) sur le site de base de Nuymayer[12] ;
- On a aussi trouvé (publication 2005[13]) des espèces réactives du mercure dans des zones urbaines[13] ;
- En 2010, à la suite d'une campagne de mesures faites l'été 2009, on apprend que la mer Morte est également concernée[14]. Cette fois, le froid ne peut pas expliquer les taux de mercure oxydé, très anormalement élevés, mesurés[15] dans la couche d'air qui surmonte tout le bassin de la mer Morte, ni le mercure trouvé dans l'eau[16]. Dans ce cas, la température de l'air atteint en effet 45 °C[16] au-dessus de l'eau hypersalée et très dense (qui réverbère les UV solaires). L'ozone pourrait être en cause[17], mais le brome ou plus exactement des composés bromés (espèces réactives du brome ; dites BrOx pour Br+BrO) semble encore plus actif dans cette région). Tas et al. ont montré[18] (en 2006) que des taux extrêmement élevés de BrO se forment presque tous les jours au-dessus de la mer Morte.
En 2009, le BrO de l'air était impliqué pour 80 % du phénomène de déplétion de mercure atmosphérique[15] au-dessus de la mer Morte, et il a été confirmé que le BrO est un oxydant du mercure encore plus efficace que le Brome élémentaire dans un air enrichi en ozone[15].
On a ici acquis la preuve que le brome peut catalyser l'oxydation du mercure très loin des pôles et aussi dans la moyenne atmosphère note D. Obrist[19] - [20] l'un des auteurs de l'étude, ce qui laisse penser que certaines parties des océans et les poissons et mammifères marins pourraient aussi être concernés.
- Dans tous les cas une forte corrélation est observée entre la « déplétion du mercure » et celle de l'ozone dans l'air[14], mais des halogènes présents dans l'air à l'état moléculaire[21] (brome notamment)[14] semblent souvent également fortement impliqués.
- Ces phénomènes sont toujours observés non loin d'une mer ou au moment où une région reçoit un air venant de la mer, mais toutes les zones côtières ne sont pas touchées.
- Pour mesurer la part anthropique du phénomène, des chercheurs (dont Xavier Faïn en France, à Grenoble) recherchent des indices de telles pluies de mercure dans un passé plus lointain, via la paléoclimatologie.
Processus chimique
Il est de mieux en mieux compris, avec plusieurs variantes récemment découvertes, mais il est encore mal cerné.
L'hypothèse la plus consensuelle, et scientifiquement étayée par un faisceau d'indices, est qu'il se produirait une oxydation rapide (catalytique probablement) du mercure élémentaire gazeux en présence de certains halogènes (le fluor, le chlore[22] - [23], le brome (HgBR2)[24] - [25] ou l'iode[5] - [26] pourraient être en cause, mais c'est le brome et certains de ses dérivés qui semblent les plus actifs.
En zone polaire, ces derniers sont en effet émis à cette époque en plus grande abondance par la surface glacée ou via des fractures dans la « glace océanique », au moment du printemps polaire, qui semble de plus en plus précoce et chaud).
Le caractère nettement "boréal" de certaines de ces « pluies de mercure » a trouvé plusieurs hypothèses explicatives : Au printemps, la glace libère des oxydants, réfléchit les UV solaires, et selon[14] T. Hynes et J. Remeika (Université de Miami, Floride) le radical hydroxyle très abondant dans l'atmosphère est normalement un oxydant faible du mercure, sauf semble-t-il en condition très froide, comme dans la partie supérieure de la basse atmosphère (troposphère), notamment en zone polaire en fin d'hiver.
Le mercure élémentaire est volatil, mais il est réputé très peu soluble dans la vapeur d'eau de l'atmosphère[27].
On estime qu'une molécule de mercure élémentaire persiste ainsi dans l'atmosphère durant 1 à 2 ans[2]. Mais, si elle rencontre certains oxydants (OH ou O3 notamment[28]), elle forme ce qu'on appelle du « mercure gazeux réactif » (elle peut aussi - bien plus rarement - former des particules de mercure (HgP).
Le mercure gazeux réactif (reactive gaseous mercury ou RGM pour les anglophones) est un oxyde métallique (HgO) ou toute forme chimique de mercure bivalent Hg(II)[29]. Ces formes du mercure, qu'on pensait rares dans l'atmosphère sont à la fois très réactives et solubles dans l'eau (vapeur, pluie, brume[30], neige). Elles sont de plus facilement adsorbables sur les poussières et particules en suspension dans l'air. Ce mercure ne reste alors en suspension dans l'air que quelques heures à quelques jours, avant d'être emporté par la condensation d'eau (pluie, neige…).
L'eau ruisselant vers les cours d'eau, les lacs et les océans apporte ce mercure dans des sédiments anoxiques où les bactéries peuvent le transformer en méthylmercure (l'une des formes les plus dangereuses et bioassimilables du mercure).
Il est alors bioaccumulé dans la chaîne alimentaire qui peut jouer un rôle de bioamplification.
Sur terre, les « pluies de mercure » abandonnent leur mercure réactif ou (moindrement) particulaire dans le sol où ces deux formes de mercure peuvent être bioconcentrées par de nombreuses espèces de champignons. Là aussi, car bien plus réactif que le mercure élémentaire, le mercure oxydé apporté par les pluies de mercure peut contaminer plus fortement et plus rapidement la chaîne alimentaire que le mercure élémentaire.
Le réchauffement climatique pourrait éventuellement interagir avec ce phénomène, de plusieurs manières ; en favorisant la production de gaz oxydants dans l'air et en réchauffant l'eau et les sols qui peuvent alors relarguer plus de mercure, en modifiant les conditions thermohygrométriques (qui par exemple influent fortement sur les émissions de brome (Br2) par la mer Morte[31] - [32]). Une fréquence accrue d'incendies de forêts (ces incendies sont l'une des sources de mercure, et de précurseurs d'ozone) aggraverait aussi le phénomène.
À partir de la publication d'un premier article sur ce phénomène dans Nature en 1998[2], les scientifiques envisagent sérieusement que des polluants oxydants gazeux puissent à leur tour affecter les retombées de mercure[3], avec des conséquences possibles pour les écosystèmes et la santé humaine.
Des observations et travaux de laboratoires semblent en effet confirmer que des gaz oxydants, tels que l'ozone et des molécules contenant des halogènes tels que brome et de chlore peuvent déclencher une brutale condensation et retombée de mercure. Les oxydants dominent ce processus, mais il semble aussi dépendre de conditions environnementales dont la saison, l'altitude du mercure atmosphérique, et intensité de l'ensoleillement ou sa richesse en ultraviolets (permettant une photochimie du mercure[33]), autant de paramètres qui (hormis la saison) peuvent dépendre des activités humaines[3].
« Les premières mesures de mercure divalent dans la neige attestent bien d'une accumulation soudaine, les quantités pouvant y être multipliées jusqu'à cinquante fois dans certains cas »[6].
Le brome joue un rôle important ou majeur, ce que semble confirmer la cartographie de la distribution des composés chimiques dans la troposphère faite d'après les observations satellitales d'ERS-2 de l'Agence spatiale européenne.
Du brome réactif (en atomes isolés ou associés à de l'oxygène) est présent lors des pluies de mercure[6].
Aux pôles (et en montagne ?), le manteau neigeux semble pouvoir « concentrer et stocker le mercure avant de le relâcher en fondant, cela en fonction des conditions de température et d'insolation »[6].
Les déplétions semblaient uniquement se produire le jour[34], avec un effet "couche limite atmosphérique[35], mais elles peuvent parfois aussi se produire de nuit : En présence d'émissions anthropiques de NO2 (ou de précurseurs chimiques du NO2), l'activité des espèces réactives du brome peut aussi conduire à augmenter la production de nitrates (NO3), ce qui provoque alors une importante déplétion de mercure la nuit. Les nitrates peuvent aussi interagir avec le mercure volatil « biogénique »[36].
Diverses réactions de base sont possibles[37] ;
En phase gazeuse
- Hg + O3 → HgO + O2
- Hg + OH → HgO + H
- Hg + NO3 → HgO + NO2
- Hg + Br → HgBr
- HgBr → Hg + Br
- HgBr + BrO → BrHgOBr
- Hg + BrO → HgO + Br
- Hg + H2O2 → HgO + H2O
- Hg + H2O2 → Hg(OH)2
- Hg + Br2 → HgBr2
- HgBr → Hg + Br
- HgBr + Br → HgBr2
- HgBr + Cl → ClHgBr
- HgCl + Br → ClHgBr
- Hg + HCl → HgCl2
- Hg + Cl → HgCl
- Hg + Cl2 → HgCl2
- Hg + ClO → HgOCl
- Hg + I2 → HgI2
- Hg + I → HgI
… et en phase aqueuse
- Hg + O3 → HgO + O2
- HgO + H+ → Hg2+ + OH−
- Hg+ + OH → Hg+ + OH−
- Hg+ + OH → Hg++ + OH−
- Hg2++HO2 → Hg+ + O2 + H+
- Hg++HO2 → Hg + O2 + H+
- Hg+HOCl → Hg2+ + Cl− + OH−
- Hg+ClO− + H+ → Hg2+ + Cl− + OH−
- Hg+HOBr− → Hg2+ + Br− + OH−
- Hg+++O2− → Hg + + O2
- Hg+Br2 → Hg2+ + 2Br−
- HgSO3 + H2O → Hg + HSO4− + H+
- Hg(OH)2 - hν → Hg + 2OH
ou encore, réaction d’équilibre en phase aqueuse ;
- Hg(II) + OH− ↔ Hg(OH)+
- Hg(OH)+ + OH− ↔ Hg(OH)2
- Hg2+ + SO32− ↔ HgSO3
- HgSO3 + SO32− ↔ Hg(SO3)2 2−
- Hg(OH)+ + Cl− ↔ HgOHCl
- Hg(II) + Cl− ↔ HgCl+
- HgCl+ + Cl− ↔ HgCl2
- HgCl2 + Cl− ↔ HgCl3−
- HgCl3- + Cl− ↔ HgCl42−
- Hg(II) + Br− ↔ HgBr+
- HgBr+ + Br− ↔ HgBr2
- HgBr2 + Br− ↔ HgBr3−
- HgBr3−- + Br− ↔ HgBr42−
D'autres réactions, hétérogènes, non listées ici et impliquant le passage d'une phase gazeuse à un phase aqueuse ou inversement coexistent également.
Étendue du phénomène
Les événements de suppression du mercure atmosphérique sont observés chaque année au-dessus de tout l'Océan Arctique ainsi que des régions adjacentes affectées par un couvert de glace marine hivernal.
À la station scientifique canadienne d'Alert (Nunavut), près du pôle Nord, le phénomène survient entre les mois de mars et mai inclusivement.
On sait, depuis la fin des années 1990 au moins, que certaines régions du monde émettent naturellement des « halogènes réactifs » dans l'atmosphère (ce sont les océans ou plus probablement leurs aérosols[38], les lacs salés et la couche limite marine[39] - [40]). Ceci invite à penser que des pluies de mercure peuvent exister dans toutes ces régions, c'est-à-dire loin des zones polaires à des latitudes moyennes, en région tempérée[41] - [39] comme en zone tropicale.
Impacts environnementaux, écotoxicologie
Le mercure est un polluant majeur souvent (et parfois de plus en plus) trouvé loin des usines et sources de pollution, dont en Amérique du Nord dans les forêts[42] et milieux aquatiques[42]. Dans la troposphère, il est rapidement dispersé dans l'air. Le taux moyen de mercure élémentaire y est d'environ 1,5 ng/m3)[6].
D'un point de vue physique, il apparaît que l'antarctique, et surtout l'arctique fonctionneraient chaque printemps comme des « puits de mercure », qui nettoieraient l'atmosphère planétaire[43], mais du point de vue écosystémique, c'est l'équivalent de l'introduction d'une quantité significative de mercure toxique dans les écosystèmes. Ce mercure pouvant ensuite circuler via les poissons et mammifères marins notamment. Ce phénomène pourrait expliquer les concentrations très élevées de méthylmercure que les naturalistes ont mesuré chez diverses espèces polaires (dont l'ours polaire)[3].
D'autres régions sont touchées. Depuis les années 1980, on avait constaté aux États-Unis qu'il existait (dans les Everglades par exemple des points chauds de pollution mercurielle ne pouvant pas être uniquement expliqué par les sources locales de pollution mercurielle (fortement réduites depuis les années 1990). Là, les analyses ont montré que le mercure actuellement introduit dans le milieu ne provenait pour l'essentiel pas des affluents ni du bassin-versant. Il ne pouvait venir que de l'air[44] ; 95 à 99 % du mercure entrant annuellement dans les Everglades y arrive avec les pluies ou brumes, à partir de l'atmosphère[3]. On a récemment trouvé du mercure oxydé réactif au-dessus de l'Atlantique tempéré, non pas aux altitudes basses typiques des régions polaires, mais surtout dans les parties supérieures de la basse atmosphère, à des hauteurs allant jusqu'à 3 000 mètres[3]. Des mesures atmosphériques faites (jusqu'à 4 000 m d'altitude) à l'observatoire de Mauna Loa (Hawaï) ont montré de grandes variations des teneurs en mercure élémentaire, et oxydé dans la colonne d'air, qui semblent en partie pouvoir être expliquée par les taux de certaines particules dans l'air (aérosols naturels ou anthropiques qui peuvent favoriser de brusques retombées de mercure[3], et interfèrent avec la nébulosité et la pluviométrie). L'exposition d'un smog à la lumière solaire en laboratoire montre que la lumière solaire active certains composés halogénés de l'air en convertissant le mercure élémentaire en mercure gazeux réactif. Les embruns marins contiennent de tels composés, ce qui pourrait expliquer certaines concentrations en mercure d'eaux marines côtières chaudes (dont en Floride)[3]. Dans l'hémisphère nord, les régions industrialisées ont émis des quantités significatives d'halogènes dans l'air, dont à partir de la décomposition des gaz réfrigérants chlorofluorocarbonés, souvent dans des régions également émettrices d'Ozone (États-Unis, Europe, Chine). Steding et A. Russell Flegal (Université de Californie) notent[45] que quand un orage et des pluies côtières se déclenchent en Californie dans une masse d'air contenant des panaches de pollution venus d'Asie, la pluie contient jusqu'à neuf fois plus de mercure. Les poissons bioaccumulent ce mercure et ils sont mangés par les alligators. Par rapport aux alligators nourris avec une nourriture artificielle, et par rapport à ceux d'autres régions, les alligators sauvages des Everglades contiennent des taux nettement plus élevés de mercure. Des doses élevées de ce métal ont été trouvées dans tous les échantillons de cerveau, moelle épinière, foie, reins, testicules, cœur, poumons, rate, muscles de 24 alligators sauvages étudiés, et à moindre dose dans leurs ovaires, oviductes, écailles de la queue et des pattes. Dans les muscles (avec d'autres contaminants, organochlorés notamment, dont DDE[46], DDD[46], DDT[46], dieldrine[46], heptachlore[46], lindane[46] et PCB[46], les taux de mercure dépassaient la norme pour l'État (0,50 à 1,50 ppm) et fédérale (1,00 ppm) pour les aliments destinés à l'Homme. Aucun signe de troubles neurologiques, hépatiques ou rénaux ne sont cependant visibles chez ces alligators, qui pourraient être utilisés comme bioindicateurs de contamination de l'environnement par le mercure[47] - [48] - [49]
Un dépôt "préférentiel" sur la zone arctique et d'autres zones écologiquement importantes (ex : Everglades) fait craindre une bioconcentration (effectivement constatée) chez la faune faune et la flore arctiques marine et terrestres, et chez leurs consommateurs (humains notamment via la consommation des produits de la chasse, de la pêche et de la cueillette, dont champignons qui peuvent bioaccumuler le mercure).
Alors que le mercure est peu à peu théoriquement interdit pour la plupart de ses anciens usages, les taux de mercure dans l'air et dans les écosystèmes, ainsi que de méthylmercure (plus toxique et écotoxique) « n'ont cessé d'augmenter dans les écosystèmes arctiques, des poissons aux ours en passant par les mammifères marins »[50]. « Dans les lacs canadiens, l'ensemble des espèces piscicoles ont dépassé les valeurs jugées limites* pour une consommation régulière. Et récemment, en Norvège, la viande de baleine a, pour la même raison, été interdite aux femmes enceintes »[6].
De 1970 à 1992, des analyses de sang chez 38 000 résidents canadiens ont mis en évidence que 9 000 d'entre présentaient des taux sanguins de méthylmercure dépassant 20 µg/litre, et de plus de 100 µg/l pour 610 d'entre eux, sachant qu'à partir de 330 µg/l, les dégâts pour l’organisme sont jugés irréversibles par l'OMS[6].
Selon les données disponibles, ce phénomène aggrave les inégalités écologiques et de santé (les victimes (inuits par exemple)) sont éloignées des sources ; les zones touchées pourraient notamment être des zones où les UV sont augmentés et plus actifs (sous le trou de la couche d'ozone, et en mer et sur les zones humides à cause de la réflexion d'une partie du flux solaire sur l'eau). Ce sont déjà aussi des zones où le risque de cancer de la peau a augmenté.
Rôle du pergélisol
.jpg.webp)
Une étude pilotée par Paul Schust[51] et co-écrite par 16 autres chercheurs (fédéraux, universitaires et indépendants) a conclu en 2018 d'analyses de carottages faits en 13 sites d'Alaska que son pergélisol serait (extrapolation) le plus grand réservoir de mercure au monde (environ 1,7 million de tonnes de mercure, équivalent en volume à celui de 50 piscines olympiques). Ce mercure y aurait été piégé pendant et depuis la dernière glaciation dans les résidus végétaux qui se décomposent mal dans le froid. Ce volume de mercure représente environ le double de tout le mercure existant dans tous les autres sols de la planète, dans l'atmosphère et l'océan réunis[52]. Outre du méthane (puissant gaz à effet de serre), d'énormes quantité de mercure hautement toxique et écotoxique pourraient ainsi être libérées dans l'océan et l'air si ce pergélisol continue à fondre[53] - [54].
Pistes de solutions
Ces retombées semblent en tant que telles, impossibles à contrôler.
La seule solution serait de freiner les sources de mercure et de copolluants synergiques à la source, ce qui pose des questions géopolitiquement et industriellement délicate, car à ce jour, la seule solution serait de conjointement :
- limiter les émissions de mercure partout, ce qui implique de mieux contrôler les émissions chroniques et accidentelles régionales, et internationales de ce métal, mais aussi l'orpaillage (légal ou illégal). Beaucoup de législation ont commencé à interdire les usages du mercure pour lesquels des alternatives peu coûteuses existaient (équipements sans mercure pour remplacer le thermomètre et tensiomètre à mercure ou les piles au mercure par exemple). D'importantes quantité de mercure ont ainsi été récupérées, mais qu'en faire ? C'est un produit dangereux dont le stockage définitif exige des moyens de protection et de surveillance. Le plus grand consommateur de mercure est devenu l'industrie de production du chlore[55], et l'évolution des process fait qu'elle va disposer d'un stock excédentaire important. Les stocks de mercure devenu inutile s'accumulant[56], comme d'autres propriétaires de mercure (militaires, laboratoires scientifiques…), l'industrie peut être tentée d'en revendre les stocks (aux orpailleurs illégaux y compris, directement ou via des trafiquants) ; ce mercure recontaminera alors l'environnement. L'ONU a proposé qu'un stockage permanent et contrôlé du mercure excédentaire ou récupéré soit envisagé à échelle planétaire. Le Quicksilver Caucus (QSC) est un consortium de grandes associations, créé en 2001 pour le stockage du mercure éliminé de notre environnement[57].
- rétrospectivement contrôler les anciennes décharges qui auraient pu recevoir du mercure (ce métal étant volatil, il peut s'en échapper durant des années sous forme gazeuse, ou sous forme de méthylmercure encore plus toxique via les lixiviats[58].
- contrôler et limiter en amont les émissions (agricoles et industrielles) de sulfates, nitrates et autres polluants atmosphériques ou de tout polluant susceptibles d'être précurseurs de l'ozone ou de favoriser les oxydants dans l'air.
- Il faut aussi limiter les émissions d'aérosols polluants des avions (les trainées d'avion n'étant que la partie visible de ces émissions) et des transports maritimes (panaches visibles sur des dizaines à centaines de km dans l'infrarouge). Du fulminate de mercure est encore utilisé dans des pétards pour enfants.
- contrôler et limiter les émissions de gaz à effet de serre qui réchauffent l'air des basses couches, ce qui est propice aux incendies de forêt et à une accumulation accrue de mercure dans l'air. Ces gaz aggravent aussi indirectement le trou de la couche d'ozone qui se traduit par une augmentation de l'intensité du rayonnement ultraviolets dans la troposphère.
Depuis les années 1990, ces objectifs font l'objet d'efforts et de conventions internationales, sous l'égide de l'ONU, mais avec des résultats encore insuffisants (alors que les transports aériens et maritimes augmentent fortement, tout en étant détaxés ou sous-taxés pour l'énergie).
De plus, comme le géochimiste Douglas J. Steding le fait remarquer, un « stock » important de mercure est présent dans l'atmosphère terrestre (du mercure élémentaire sous forme de vapeur pour 99 % de ce stock[3]). Ce métal à la fois volatil et bioaccumulable circule au-dessus des mers et des continents[59] ; il pourrait donc falloir des décennies ou siècles avant que les teneurs environnementales ne redeviennent celle du fond géochimique naturel. Dans le passé de la planète, c'est avec le charbon, le pétrole et le gaz naturel que le mercure atmosphérique avait été, au cours de centaines de millions d'années, piégé et enfoui dans le sous-sol puis les roches profondes ; avec le puits de carbone qu'ils constituaient et que l'humanité détruit en réinjectant son contenu dans l'air[3].
Vocabulaire
Le phénomène est désigné en anglais par l'appellation Arctic springtime mercury depletion events ou Atmospheric mercury depletion events[15] (AMDEs[15]) ;
En français, un article[6] du Journal La Recherche intitulé « Pluie de mercure sur l'Arctique » a popularisé l'expression pluies de mercure., mais on parle aussi de « déplétion » du mercure atmosphérique.
Notes et références
- Tom Atkeson & Paul Parks (Florida Department of Environmental Protection ; Mercury Program), Everglades Consolidated Report Chapter 7: Everglades Mercury Problem Rapport 2001, PDF, 41Pp
- Schroeder, W. H., Anlauf, K. G., 5 Barrie, L. A., Lu, J. Y., Steffen, A., Schneeberger, D. R., and Berg, T.: Arctic springtime depletion of mercury, Nature, 394, 331–332, 1998
- Janet Raloff, Why the Mercury Falls ; Heavy-metal rains may trace to oxidants, including smog
- Janet Ralof, Mercurial Effects of Fish-Rich Diets, Science News
- Calvert, J. G. and Lindberg, S. E., The potential influence of iodine-containing compounds on the chemistry of the troposphere in the polar spring: II. Mercury depletion, Atmos. Environ., 38, 5105–5116, 2004.
- Christophe Ferrari, Pluie de mercure sur l'Arctique, Journal La Recherche,
- Lindberg, S. E., Brooks, S., Lin, C.-J., Scott, K. J., Landis, M. S., Stevens, R. K., Goodsite, M., 10 and Richter, A., Dynamic oxidation of gaseous mercury in the Arctic troposphere at polar sunrise, Environ. Sci. Technol., 36, 1245–1256, 2002.
- Ebinghaus, R., Kock, H. H., Temme, C., Einax, J. W., Lo¨we, A. G., Richter, A., Burrows, J. P., and Schroeder, W. H., Antarctic springtime depletion of atmospheric mercury, Environ. Sci. Technol., 36, 1238–1244, 2002.
- Berg, T., Sekkesæter, S., Steinnes, E., Valdal, A.-K., and Wibetoe, G., Springtime depletion of mercury in the European Arctic as observed at Svalbard, Sci. Total Environ., 304, 43–51, 2003.
- Skov, H., Christensen, J. H., Goodsite, M. E., Heidam, N. Z., Jensen, B., Wahlin, P., and Geernaert, G., Fate of elemental mercury in the Arctic during atmospheric mercury depletion episodes and the load of atmospheric mercury to the Arctic, Environ. Sci. Technol., 38, 2373– 2382, 2004.
- Poissant, L. and Pilote, M.: Time series analysis of atmospheric mercury in Kuujjuarapik/ Whapmagoostui (Québec), J. Phys. IV France, 107, 1079–1082, 2003.
- R. Ebinghaus et al., Environmental Science and Technology, 36, 1238, 2002.
- Shon, Z.-H., Kim, K.-H., Kim, M.-Y. and Lee, M.: Modeling study of reactive gaseous mercury in the urban air, Atmos. Environ., 39, 749–761, 2005
- Tony Hynes & James Remeika, Reactive Gaseous Mercury (RGM) Measurements using KCl-Coated Denuders, Présentation (PPT/PDF, 11pp)
- E. Tas, D. Obrist, M. Peleg, V. Matveev, X. Faïn, D. Asaf et M. Luria, Measurement-based modeling of bromine-induced oxidation of mercury above the Dead Sea ; Atmos. Chem. Phys. Discuss., 11, 24467–24502, 2011 (www.atmos-chem-phys-discuss.net/11/24467/2011/) ; doi:10.5194/acpd-11-24467-2011 (étude publiée sous licence CC-by-sa 3.0)
- National Science Foundation (NSF), Air Above Dead Sea Contains Very High Levels of Oxidized Mercury, communiqué de presse, 2010
- Pal, B. and Ariya, P. A., Studies of ozone initiated reactions of gaseous mercury: Kinetics, product studies, and atmospheric implications, Phys. Chem. Chem. Phys., 6, 572–579, 2004b
- Tas, E., Peleg, M., Pedersen, D. U., Matveev, V., Pour Biazar, A., and Luria, M., Measurement based modeling of bromine chemistry in the boundary layer: 1. Bromine chemistry at the Dead Sea, Atmos. Chem. Phys., 6, 5589–5604, doi:10.5194/acp-6-5589-2006, 2006.
- DRI Associate Research Professor in the Division of Atmospheric Sciences and Menachem Luria, Professor at Hebrew University and an Adjunct Professor at DRI (Desert Research Institute)
- Desert Research Institute (DRI, Nevada, États-Unis), Mercury Depletion Events at the Dead Sea
- Ariya, P. A., Khalizov, A., and Gidas, A., Reaction of gaseous mercury with atomic and molecular halogens: Kinetics, product studies, and atmospheric implications, J. Phys. Chem. A, 106, 7310–7320, 2002
- Lin, C.-J. and Pehkonen, S. O., Oxidation of elemental mercury by aqueous chlorine (HOCl/OCl-): Implications for tropospheric mercury chemistry, J. Geophys. Res., 103D, 28093–28102, 1998.
- Lin, C.-J. and Pehkonen, S. O., Aqueous phase reactions of mercury with free radicals and chlorine: Implications for atmospheric mercury chemistry ; Chemosphere, 38, 1253–1263, 1999.
- Goodsite, M., Plane, J. M. C., and Skov, H., A theoretical study of the oxidation of Hg to HgBr2 in the troposphere, Environ. Sci. Technol., 38, 1772–1776, 2004
- Evans, M. J., Jacob, D. J., Atlas, E., Cantrell, C. A., Eisele, F., Flocke, F., Fried, A., Mauldin, R. L., Ridley, B. A., Wert, B., Talbot, R., Blake, D., Heikes, B., Snow, J., Welega, J., Weinheimer,A. J. et Dibb, J., Coupled evolution of BrOX-ClOXHOX-NOX chemistry during bromine-catalyzed ozone depletion events in the Arctic boundary layer, J. Geophys. Res., 108(D4), 8368, doi:10.1029/2002JD002732, 2003.
- Zingler, J. and Platt, U., Iodine oxide in the Dead Sea Valley: Evidence for inorganic sources of boundary layer IO, J. Geophys. Res., 110, D07307, doi:10.1029/2004JD004993, 2005
- Clever, H., Johnson, S. A., and Derrick, E. M., The solubility of mercury and some sparingly soluble mercury salts in water and aqueous solutions, J. Phys. Chem. Ref. Data., 14, 631– 680, 1985.
- Munthe, J., The aqueous oxidation of elemental mercury by ozone, Atmos. Environ. Part AGeneral Topics, 26(8), 1461–1468, 1992
- Lindberg, S. E., Brooks, S., 5 Lin, C.-J., Scott, K., Meyers, T., Chambers, L., Landis, M., and Stevens, R. K, Formation of Reactive Gaseous Mercury in the Arctic: Evidence of Oxidation of Hg to Gas-Phase Hg-II Compounds after Arctic Sunrise, Water Air Soil Pollut., 1(5–6), 295–302, 2001.
- Pleijel, K. and Munthe, J., Modelling the atmospheric mercury cycle - chemistry in fog droplet, Atmos. Environ., 29, 1441–1457, 1995.
- Obrist, D., Tas, E., Peleg, M., Matveev, V., Faïn, X., Asaf, D., and Luria, M., Bromine-induced oxidation of mercury in the mid-latitude atmosphere, Nature Geosci., 4, 22–26, 2011.
- Donohoue, D. L., Bauer, D., Cossairt, B., and Hynes, A. J.: Temperature and pressure dependent rate coefficients for the reaction of Hg with Br and the reaction of Br with Br: a 5 pulsed laser photolysis-pulsed laser induced fluorescence study, J. Phys. Chem. A, 110, 6623–6632, 2006.
- Pehkonen, S. O. and Lin, C.-J., Aqueous photochemistry of mercury with organic acids, J. Air. Waste. Manage., 48, 144–150, 1997
- Mao, H., Talbot, R. W., Sigler, J. M., Sive, B. C., and Hegarty, J. D.,Seasonal and diurnal variations of Hg over New England, Atmos. Chem. Phys., 8, 1403–1421, doi:10.5194/acp-8- 1403-2008, 2008
- McNider, R. T. and Pielke, R. A., Diurnal boundary-layer development over sloping terrain, J. Atmos. Sci., 38, 2198–2212, 1981.
- Sommar, J., Hallquist, M., Ljungstrom E., and Lindqvist, O., On the gas phase reactions between volatile biogenic mercury species and the nitrate radical, J. Atmos. Chem., 27, 233– 247, 1997.
- E. Tas, & al., Measurement-based modeling of bromine-induced oxidation of mercury above the Dead Sea ; Atmos. Chem. Phys. Discuss., 11, 24467-24502, 2011, www.atmos-chem-phys-discuss.net/11/24467/2011/ doi:10.5194/acpd-11-24467-2011 ; 2011. This work is distributed under the Creative Commons Attribution 3.0 License.
- Gong, S. L., Barrie, L. A., and Blachey, J.-P.: Modelling sea-salt aerosols in the atmosphere, 1. Model development, J. Geophys. Res., 102(D3), 3805–3818, 1997
- Saiz-Lopez, A., Plane, J. M. C., and Shillito, J. A., Bromine oxide in the mid-latitude marine boundary layer, Geophys. Res. Lett., 31(3), L03111, 2004.
- Hedgecock, I. M. and Pirrone, N., Mercury and photochemistry in the marine boundary layer modelling studies suggest the in situ production of reactive gas phase mercury, Atmos. Environ., 35, 3055–3062, 2001.
- Hebestreit, K., Stutz, J., Rosen, D., Matveev, V., Peleg, M., Luria, M., and Platt, U., First DOAS ; Measurements of Tropospheric Bromine Oxide in Mid Latitudes, Science, 283, 55–57, 1999
- Driscoll, C. T., Han, Y. J., Chen, C. Y., Evers, D. C., Lambert, K. F., Holsen, T. M., Kamman, N. C., and Munson, R. K., Mercury contamination in forest and freshwater ecosystems in the northeastern United States, Bioscience, 57(1), 17–28, 2007.
- Ariya, P., Dastoor, A., Amyot, M., Schroeder,W.H., Barrie, L., Anlauf, K., Raofie, F., Ryzhkov, A., Davignon, D., Lalonde, J., Steffen, A.: The Arctic: A sink for mercury, Tellus, 56B, 397–403, 2004
- Atkeson, coordinateur des recherches sur le mercure au Florida Department of protection de l'environnement à Tallahassee
- Art. du 19 décembre 2002, Journal of Geophysical Research
- Delany MF, Bell JU, Sundlof SF., Concentrations of contaminants in muscle of the American alligator in Florida ; J Wildl Dis. 1988 Jan; 24(1):62-6.
- Rumbold DG, Fink LE, Laine KA, Niemczyk SL, Chandrasekhar T, Wankel SD, Kendall C., Levels of mercury in alligators (Alligator mississippiensis) collected along a transect through the Florida Everglades. Sci Total Environ. 2002 Oct 7; 297(1-3):239-52
- Yanochko GM, Jagoe CH, Brisbin IL, Tissue mercury concentrations in alligators (Alligator mississippiensis) from the Florida Everglades and the Savannah River Site, South Carolina. Jr. Arch Environ Contam Toxicol. 1997 Apr; 32(3):323-8.
- Khan B, Tansel B., Mercury bioconcentration factors in American alligators (Alligator mississippiensis) in the Florida everglades. Ecotoxicol Environ Saf. 2000 Sep; 47(1):54-8.
- R. Wagemann et al., The Science of the Total Environment, 186, 41, 1996. ,cité par Christophe Ferrari, in La recherche, 1996
- Paul Schust est scientifique à l'US Geological Survey
- Mooney Chris (2018) The Arctic is full of toxic mercury, and climate change is going to release it ; Washington Post
- Langin K (2018) Millions of tons of trapped mercury could be released as world warms publié le 06 février 2018
- Chuster & al. (2018) Permafrost Stores a Globally Significant Amount of Mercury, Geophysicoal reserach
- 2002. Chlor-alkali industry principles concerning the retirement of mercury. The Chlorine Institute. May 9. (PDF en ligne
- Johnson, J. 2002. Too much of a bad thing: As U.S. companies end mercury use, questions mount over need to limit world access to surplus. Chemical & Engineering News 80(July 29):22–23.
- ECOS, Quicksilver Caucus ; Group Backgroun,
- Science News, Landfills Make Mercury More Toxic (les décharges rendent le mercure plus toxique ; News 2001-07-07 ; Vol.160 #1
- Steding, D.J., and A.R. Flegal. Mercury concentrations in coastal California precipitation: Evidence of local and trans-Pacific fluxes of mercury to North America. Journal of Geophysical Research 107(D24):4764. (résumé)
Voir aussi
Articles connexes
Bibliographie
- (en) A. Steffen et al., "A synthesis of atmospheric mercury depletion event chemistry linking atmosphere, snow and water", dans Atmos. Chem. Phys. Discuss., no 7 (2007), pp.;10837–10931 ; (résumé).
- (en) Janet Raloff, Why the Mercury Falls ; Heavy-metal rains may trace to oxidants, including smog.
- (en) Michael Evan Goodsite, Thèse Fate of mercury in the arctic (devenir du mercure dans l'arctique) ; Thèse, Dpt de chimie de l'université de Copenhague, ; COGCI, 335 pp.
- (en) EPA, Hynes, Anthony J. , Présentation du projet : Laser Based Studies of Atmospheric Mercury Transformation : Laboratory Kinetics and Ultrasensitive Detection of Elemental and Reactive Gaseous Mercury, projet conduit de à , avec l'université de Miami, et rapport final.
- (en) Lin, Che-Jen, Chemical Transformations Of Mercury In The Multiphase Atmosphere ; Université de Cincinnati, Dissertation Abstracts International, Volume: 60-04, Section: B, page: 1505 ; (résumé)
- (en) Bergan, T. and Rodhe, H.: Oxidation of elemental mercury in the atmosphere: Constraints imposed by global scale modeling, J. Atmos. Chem., 40, 191–212, 2001.
- (en) Byun, Y., Cho, M., Namkung, W., Lee, K., Koh, D. J., and Shin, D. N., Insight into the Unique Oxidation Chemistry of Elemental Mercury by Chlorine-Containing Species : Experiment and Simulation ; Environ. Sci. Technol., 2010, 44, 1624–1629, 2010.
- (en) Lin, C.-J. and Pehkonen, S. O.: Aqueous free radical chemistry of mercury in the presence of iron oxides and ambient aerosol ; Atmos. Environ., 31, 4125–4137, 199.7
- (en) Lu, J. Y., Schroeder, W. H., Barrie, L. A., and Steffen, A., Magnification of atmospheric mercury deposition to polar regions in springtime: The link to tropospheric ozone depletion chemistry ; Geophys. Res. Lett. 28, 3219–3222, 2001
- (en) Raofie, F. and Ariya, P. A., Kinetics and products study of the reaction of BrO radicals with gaseous mercury, J. Phys. IV France, 107, 1119–1121, 2003.
- (en) Shepler, B. C., Balabanov, N. B., and Peterson, K. A., Hg+Br!HgBr recombination and collision induced dissociation dynamics, J. Chem. Phys., 127, 164–304, doi:10.1063/1.2777142, 2007.
- (en) Sillman, S., Marsik, F. J., Al-Wali, K. I., Keeler, G. J., and Landis, M. S.,Reactive mercury in the troposphere: Model formation and results for Florida, the northeastern United States, and the Atlantic ocean, J. Geophys. Res., 112, D23305, doi:10.1029/2006JD008227, 2007.
- (en) Tokos, J. J. S., Hall, B., Calhoun, J. A., and Prestbo, E. M., Homogeneous gas-phase reaction of Hg0 with H2O2, O3, CH3I, and (CH3)2S: Implications for atmospheric Hg cycling, Atmos. Environ., 32, 823–827, 1998
- (en) Xiao, Z. F., Munthe, J., Stromberg, D., and Lindqvist, O., Photochemical behavior of inorganic mercury compounds in aqueous solution, in: Mercury as a Global Pollutant – Integration and Synthesis ; Ed:Watras, C. J. & Huckabee, J. W., 581–592, Lewis Publishers, 1994.
- (en) Lutter, R., and E. Irwin. 2002. Mercury in the environment: A volatile problem. Environment 44 (novembre):24.