Théorie radicalaire du vieillissement
La théorie radicalaire du vieillissement énonce que les organismes vieillissent par la multiplication des lésions liées à l’accumulation de radicaux libres dans les cellules[1]. Un « radical libre » est un atome ou une molécule possédant un seul électron non apparié dans sa couche externe[2]. Si certains radicaux libres, tels la mélanine, sont chimiquement inertes, la plupart des radicaux libres présents dans les organismes sont fortement réactifs[3]. Dans la plupart des structures biologiques, les lésions liées à la présence de radicaux libres sont étroitement associées au processus d'oxydation. Les antioxydants sont des réducteurs qui limitent l'action des radicaux libres dans ces structures en les passivant[4].
Au sens strict, la théorie radicalaire, telle qu'énoncée initialement par Denham Harman dans les années 1950[5], ne concerne que les radicaux de type superoxydes ( O2− ), mais son auteur a extrapolé la théorie dans les années 1970 aux synthèses mitochondriales de dérivés réactifs de l'oxygène[6] et depuis elle englobe les lésions d'autres espèces chimiquement agressives comme les peroxyde d'hydrogène (H2O2), ou le Peroxynitrite[4] (OONO−).
Il a pu être démontré, sur certains organismes modèles comme les levures et les Drosophiles, que la diminution des lésions liées à l'oxydation prolonge la vie[7] ; en revanche, chez les souris, seule une altération génétique bloquant la barrière antioxydante sur 18 (la destruction d'enzymes SOD1), réduit la durée de vie[8]. De même, on a constaté récemment[9] que chez les nématodes (Caenorhabditis elegans), l'inhibition de la synthèse de l'antioxydant naturel qu'est la Superoxyde dismutase augmente l’espérance de vie. L'efficacité de la diminution des risques d'oxydation dans l'augmentation de la durée de vie demeure donc une question controversée.
Contexte
La théorie radicalaire du vieillissement a été imaginée par Denham Harman dans les années 1950, à un moment où l'opinion générale prévalait que les radicaux libres étaient trop instables pour pouvoir subsister dans les organismes[10]. Naturellement, encore personne n'avait invoqué les radicaux libres comme cause des maladies dégénératives[11]. Harman s'est inspiré de deux sources :
- la théorie de la quantité de vie, formulée par R. Pearl, selon laquelle la durée de vie est inversement proportionnelle au rythme métabolique, lequel est proportionnel à la consommation d’oxygène, et
- une observation de Rebbeca Gershman, selon laquelle on peut expliquer la toxicité de l'oxygène hyperbare et l'irradiation par un seul et même phénomène : la présence de radicaux libres de dioxygène[10] - [12].
Remarquant que les radiations provoquent des « mutations, cancers et un vieillissement prématuré », Harman énonça que les radicaux libres d’oxygène produits par la respiration devraient entraîner des lésions cumulatives, menant finalement à une perte de fonctionnalité organique, et à terme, à la mort[10] - [12].
Ces dernières années, la théorie a été extrapolée, aux maladies liées à l'âge[11]. Les lésions provoquées dans les cellules par les radicaux libres seraient à l'origine de nombreux désordres organiques tels que cancers, arthrite, athérosclérose, maladie d'Alzheimer et diabète[13]. Certains résultats suggèrent que les radicaux libres et certains radicaux azotés déclenchent et accélèrent les mécanismes de mort cellulaire tels l'apoptose et des cas extrêmes de nécrose[14].
En 1972, Harman a modifié sa théorie originale pour énoncer une « théorie mitochondriale du vieillissement[11]. » Dans sa formulation actuelle, elle énonce que les dérivés réactifs de l'oxygène synthétisés dans les mitochondries altèrent certaines macromolécules y compris les lipides, protéines et surtout l'ADN mitochondrial[15]. Ces altérations provoquent à leur tour des mutations qui favorisent la synthèse d'autres dérivés réactifs de l'oxygène (DRO), et donc l'accumulation de radicaux libres dans les cellules affectées[15]. Cette théorie mitochondriale est privilégiée dans l'explication des phénomènes de vieillissement[16].
La théorie continue d'évoluer et de s'enrichir[16].
Les processus
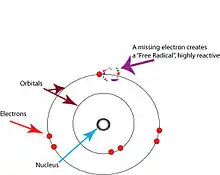
Les radicaux libres sont des atomes ou des molécules possédant des électrons isolés[2]. Dans les atomes ou les molécules, les électrons sont normalement groupés par paires le long d'orbitales[17]. Les radicaux libres, qui ne comportent qu'un seul électron sur chacune de leurs orbitales, sont en principe instables et ont tendance à perdre ou à capturer un électron pour perdre ou saturer leur couche externe[17].
La présence d'un électron isolé sur la couche externe n’implique pas qu'un radical libre soit positivement chargé.
Les lésions se produisent lorsqu'un radical libre se recombine avec une autre molécule pour saturer sa couche électronique externe. Le radical libre capte alors un électron de la molécule cible, ce qui fait de cette molécule un radical libre, apte à altérer une autre molécule, d'où une réaction en chaîne[18]. Les radicaux libres produits dans ces réactions finissent par modifier entièrement la structure ou les propriétés d'une molécule, particulièrement en biologie. C'est en ce sens qu'on parle de lésion cellulaire (car la cellule contient des molécules modifiées, impropres aux fonctions vitales).
Les réactions en chaîne déclenchées par les radicaux libres peuvent provoquer une altération des édifices atomiques : lorsqu'elles impliquent des molécules liées par pont hydrogène dans les brins d'ADN, l'ADN peut être hybridé[19].
L’enjambement d'ADN peut à son tour se manifester par divers symptômes de vieillissement, particulièrement par un cancer[20]. L'hybridation peut combiner des molécules grasses et des protéines, à l'origine des rides[21]. En oxydant les LDL, les radicaux libres sont à l'origine de la formation de plaques dans les artères, et par là de thromboses et d’hémorragies cérébrales[22]. Ces exemples montrent les applications de la théorie radicalaire dans la compréhension des mécanismes de plusieurs maladie chroniques[23].
Parmi les radicaux libres soupçonnés d'intervenir dans le processus de vieillissement, on trouve le superoxyde et le monoxyde d'azote[24] : un excès en superoxydes affecte le vieillissement, tandis qu'une baisse de synthèse d'oxydes nitriques, ou leur biodisponibilité, agit de même[24].
Les antioxydants sont efficaces pour réduire et empêcher les lésions dues aux réactions des radicaux libres, grâce à leur capacité à céder des électrons qui neutralisent le radical sans en former de nouveaux. L’acide ascorbique, par exemple, peut perdre un électron à un radical libre tout en demeurant lui-même stable : il cède des électrons instables[25].
On a pu en déduire[26] que l'absorption de grandes quantités d’antioxydants pouvait, étant donné leur capacité à modérer la teneur en radicaux libres, ralentir les lésions résultant des maladies chroniques, et même le vieillissement.
Observations à la base de la théorie
Plusieurs études ont montré le rôle des radicaux libres dans le processus de vieillissement, et à ce titre elles confortent plutôt la théorie radicalaire du vieillissement : elles démontrent une augmentation sensible de la teneur en radicaux superoxydes et de peroxydation des lipides chez les rats âgés[27]. Chung et al. suggèrent que la synthèse de dérivés réactifs de l'oxygène augmente avec l'âge et ils ont montré que la conversion de XDH en xanthine deshydrogénase (XOD) pourrait en être un mécanisme important[28]. Cette hypothèse est renforcée par une autre étude, montrant que la synthèse de superoxyde par xanthine oxydase et NO synthase dans les artères mésentériques est plus élevée chez les rats âgés[29].
Hamilton et al. ont relevé des similitudes entre les affections endothéliales liées à l'hypertension et le vieillissement chez l'Homme, et ont mis en évidence une surproduction de superoxydes dans les deux cas[30]. Cette découverte est confortée par une étude de 2007 qui a montré que le stress oxydant endothélial s'accroît avec l'âge chez les hommes sains et qu'il est corrélé à une réduction de la vasodilatation endothélium-dépendante[31]. En outre, la culture de cellules de muscles lisses a mis en évidence une augmentation en dérivés réactifs de l'oxygène sur les cellules prélevées chez des souris plus âgées[32]. Ces découvertes sont enfin confirmée par une troisième étude menées sur des cellules de Leydig isolées prélevées sur les testicules de rats jeunes et vieux[33].
L'expérience de Choksi et al. sur la souris naine d'Ames (DW) ainsi que les faibles teneurs en dérivés réactifs de l'oxygène endogènes chez cette espèce pourraient expliquer sa résistance au stress oxiydant et sa longévité[34]. Lener et al. estiment que l’activité des Nox4 contribue à accroître les lésions oxydantes dans les cellules endothéliales de la veine ombilicale chez l'Homme via stimulation de la synthèse de superoxyde[35]. En outre, Rodriguez-Manas et al. ont découvert que le dysfonctionnement endothélial dans les vaisseaux humains est le produit d'une conjugaison de l'inflammation des vaisseaux et du stress oxydant[36].
Sasaki et al. ont établi que la chimiluminescence liée à la présence de superoxydes est inversement proportionnelle à la longévité chez la souris, le rat Wistar et les pigeons[37]. Ils sont d'avis que les dérivés actifs de l'oxygène ayant fonction de signal jouent un rôle déterminant processus de vieillissement[37]. Mendoza-Nunez et al. estiment que le stress oxydant s'accroît nettement vers l'âge de 60 ans[38]. Miyazawa a découvert que la synthèse d'anions superoxydes mitochondriaux peut provoquer l'atrophie et le dysfonctionnement d'un organe via apoptose d'origine mitochondriale[39]. En outre, ils avancent que l’anion superoxyde mitochondrial joue un rôle essentiel dans le vieillissement[39]. Lund et al. ont prouvé le rôle de la superoxyde dismutase endogène extracellulaire dans les mécanismes de défense contre le dysfonctionnement endothélial chez les souris âgées[40].
Variantes de la théorie des radicaux libres
L'une des principales critiques adressées à la théorie radicalaire vise l'idée que les radicaux libres sont à l'origine des altérations de biomolécules , altérations qui à leur tour affectent la biologie de la cellule et donc le vieillissement de l'organisme[41]. C'est pourquoi de nombreuses modifications ont été apportées pour tenir compte des apports les plus récents.
L'origine mitochondriale du vieillissement
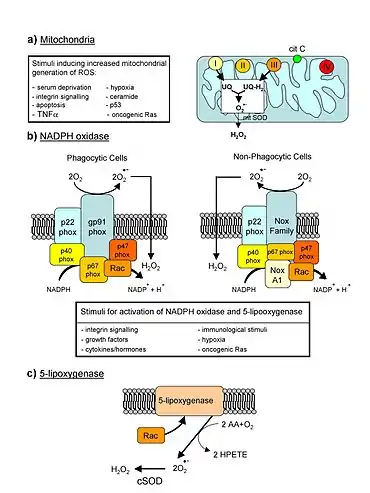
La théorie mitochondriale du vieillissement a été énoncée pour la première fois en 1978[42] - [43], suivie deux ans plus tard de la théorie du vieillissement par les radicaux libres d'origine mitochondriale[44]. Cette théorie fait des mitochondries la cause principale de l'altération des molécules, en s'appuyant :
- sur certains mécanismes chimiques connus de synthèse de dérivés actifs de l'oxygène dans les mitochondries,
- sur le fait que des composants mitochondriaux comme le mtDNA ne sont pas aussi résistants que l'ADN nucléaire,
- et enfin sur des étudies comparant les altérations sur l'ADN nucléaire et l'ADN mt, le second étant plus souvent dégradé[45].
Des électrons peuvent se détacher dans les processus métaboliques de la mitochondrie comme la chaîne de transport d'électrons, et ces électrons peuvent à leur tour réagir avec l'eau pour former des dérivés actifs de l'oxygène comme le radical superoxyde ou, via un chemin moins direct, le radical hydroxyl. Ces radicaux altèrent ensuite l'ADN mitochondrial et les protéines, et les cellules affectées sont davantage susceptibles de synthétiser des molécules vecteurs de dérivés actifs de l'oxygène. On démontre ainsi l'existence d'une boucle de rétroaction positive du stress oxydant qui, au fil du temps, provoque la détérioration des cellules, puis des organes et de l'organisme tout entier[41]. Cette théorie très controversée[46] n'explique guère comment se produisent les mutations induites dans l'ADN mt par les dérivés réactifs de l'oxygène[41]. Conte et al. postulent que la substitution d'atomes de zinc aux atomes de fer pourrait créer des radicaux libres, le zinc ayant une affinité pour l'ADN[47].
Le vieillissement par déséquilibre redox épigénétique
Brewer a formulé une théorie qui combine à la théorie radicalaire la transduction de signal de l'insuline[48]. La théorie de Brewer implique qu’« un comportement sédentaire, associé à l'âge, déclenche un déséquilibre rédox et un dysfonctionnement mitochondrial[48]. » Le dysfonctionnement mitochondrial favorise en retour un comportement plus sédentaire et à un vieillissement accéléré[48].
Théorie de la stabilité métabolique
Selon la théorie de la stabilité métabolique du vieillissement, c'est la capacité des cellules à maintenir une concentration stable dérivés actifs de l'oxygène qui serait le facteur primaire de longévité[49]. Cette théorie s'oppose évidemment à la théorie radicalaire, car elle reconnaît que les dérivés actifs de l'oxygène sont des molécules-signal spécifiques, nécessaires au maintien de fonctions cellulaires normales.
Hormèse mitochondriale
Le stress oxydant peut augmenter la longévité de Caenorhabditis elegans en déclenchant une réponse secondaire à des niveaux initialement élevés de composés réactifs de l’oxygène[50]. Ce phénomène a d'abord été appelé « hormèse mitochondriale » puis, sur une base purement spéculative[51], « mito-hormèse ». Chez les mammifères, l'effet des dérivés réactifs de l'oxygène sur le vieillissement est encore moins clair[52] - [53] - [54]. Certaines études épidémiologiques récentes viennent à l'appui de l'existence d'un processus de mitohormèse chez l'Homme, et même suggèrent que l'absorption d'antioxydants exogènes est susceptible d'accroître la prévalence de maladies chez les humains (car selon cette théorie ils empêchent la stimulation des réponses naturelles de l'organisme aux composés oxydants[55]).
Effets d'un régime hypocalorique
Diverses études ont monté les effets bénéfiques d'un régime hypocalorique sur la longévité des sujets, quoique de tels régimes s'accompagnent de stress oxydant[56]. Ces effets s'expliqueraient par l'action anti-oxydante[56], la suppression du stress oxydant[57], ou une résistance accrue au stress oxydant[58] acquise. Fontana et al. supposent qu'un régime hypocalorique influence plusieurs mécanismes de transduction de signal par modération du facteur de croissance 1 ressemblant à l'insuline[59]. Ils suggèrent en outre que la superoxyde dismutase antioxydante et la catalase sont impliquées dans l'inhibition de ce mécanisme[59].
On oppose souvent à l’origine mitochondriale des radicaux libres responsables du vieillissement, l’accroissement de longévité observé à la suite de régimes hypocaloriques accompagné de variations de la consommation en dioxygène[56] - [60]. Toutefois, Barja a montré que le taux de synthèse de radicaux oxygénés dans les mitochondries (par unité de dioxygène consommé) diminuait nettement avec un régime hypocalorique, la pratique de l’aerobic ou d’efforts réguliers et soutenus, ou en cas d’hyperthyroïdie[60]. D’ailleurs, la synthèse de radicaux oxygénés dans les mitochondries est plus faible chez les oiseaux à forte longévité que chez les mammifères de taille et de métabolisme comparables, qui ont de fait une moindre longévité. Ainsi, la synthèse mitochondriale de radicaux libres est certainement indépendante de la consommation en dioxygène O2 chez plusieurs espèces, dans différents tissus et pour différents états physiologiques[60].
Objections cliniques à la théorie des radicaux libres
Le cas du Rat-taupe nu
Le Rat-taupe nu est un rongeur de grande longévité (32 ans). Comme l'ont montré Lewis et al.[61] (2013), le taux de production d'espèces oxydo-actives chez ce rat n'est pas différent de celui des autres rongeurs, comme la souris (qui ne vit que 4 ans). Ils en ont conclu que ce n'est pas le défaut de stress oxydant qui favorise la longévité ou la santé de ces rongeurs, mais d'autres mécanisme cyto-protecteurs leur permettant de survivre aux altérations moléculaires d'oxydation[61]. Chez le Rat-taupe nu, cela pourrait s'expliquer par la prévalence de gènes réparateurs d'ADN[62] : mécanismes de mismatch repair, de jonction d'extrémités non homologues et de réparation par excision de base (cf. la théorie de l'accumulation de mutations).
Le cas des oiseaux
Parmi les oiseaux, les perroquets vivent environ 5 fois plus longtemps que les cailles. Pourtant, il a été démontré que la synthèse de dérivés réactifs de l'oxygène dans le cœur, les muscles squelettiques, le foie et les érythrocytes intacts était identique chez les perroquets et les cailles, et donc qu'il n'y avait aucune corrélation avec leur différence de longévité[63]. Ces remarques continuent de jeter le doute sur la validité de la théorie du vieillissement par le stress oxydant[63].
Thérapie à base d'antioxydants
Une conséquence de la théorie radicalaire est que les antioxydants comme la vitamine A, la vitamine C, la vitamine E α-Tocophérol, le bêta-Carotène et la Superoxyde dismutase ralentissent le processus de vieillissement en réduisant l'action oxydante des radicaux libres sur les molécules biologiques cible et même en inhibant la formation de radicaux libres. On cite souvent les antioxydants présents dans l'alimentation pour promouvoir la consommation de fruits et de légumes.
Néanmoins, quelques enquêtes récentes tendent à montrer que les régimes riches en antioxydants n'ont pas d'effet ou même, peuvent accroître la mortalité[64] - [65] - [66] - [67] - [68] - [69] de certains cancers. Cela dit, il faut signaler une sérieuse limitation dans chacune de ces enquêtes, à savoir qu'elles se fondaient sur la consommation essentielle de suppléments vitaminés de synthèse. Dans une communication plus récente, la consommation de fruits et de légumes a été corrélée positivement à la longévité et à la diminution du « risque de développer un cancer en général[70] ».
Dans la mesure où les mécanismes de défense anti-oxydants résultent de la synergie de plusieurs substances, les bienfaits des thérapies à base d'antioxydants ne peuvent être établis qu'en développant des modèles non-élémentaires.
Les partisans du rôle favorable des antioxydants l’expliquent par l’« hormèse » : l’apport d’antioxydants vient modérer les réactions biologiques normales contre les radicaux libres, donc à un système davantage sensible à l'oxydation[71]. En outre, une étude recente sur les habitudes alimentaires de 478 000 Européens tend à montrer que la consommation de fruits et de légumes a peu ou pas d'effet sur la prévention des cancers[72].
Notes
- D’après S. Hekimi, J. Lapointe et Y. Wen, « Taking a "good" look at free radicals in the aging process », Trends In Cell Biology, vol. 21, no 10, , p. 569-76.
- D’après M. Erbas et H. Sekerci, « Importance of free radicals and occurring during food processing. », GIDA / The Journal of FOOD, vol. 36, no 6, , p. 349-56.
- D’après T. Herrling, K. Jung et J. Fuchs, « The role of melanin as protector against free radicals in skin and its role as free radical indicator in hair », Spectrochimica Acta Part A: Molecular & Biomolecular Spectroscopy, vol. 69, no 5, , p. 1429–35 (DOI 10.1016/j.saa.2007.09.030)
- B. Halliwell, « Free radicals and antioxidants: updating a personal view », Nutrition Reviews, vol. 70, no 5, , p. 257–65 (DOI 10.1111/j.1753-4887.2012.00476.x)
- Cf. D. Harman, « Aging: a theory based on free radical and radiation chemistry », Journal of Gerontology, vol. 11, no 3, , p. 298–300 (PMID 13332224, DOI 10.1093/geronj/11.3.298)
- D. Harman,, « A biologic clock: the mitochondria? », Journal of the American Geriatrics Society, vol. 20, no 4, , p. 145–147 (PMID 5016631)
- Cf. Luigi Fontana, Linda Partridge et Valter D. Longo, « Extending Healthy Life Span—From Yeast to Humans », Science, vol. 328, no 5976, , p. 321–326 (PMID 20395504, PMCID 3607354, DOI 10.1126/science.1172539)
- Cf. V.I. Pérez, A. Bokov, H.V. Remmen, J. Mele, Q. Ran et Y. Ikeno et al., « Is the oxidative stress theory of aging dead? », Biochimica et Biophysica Acta (BBA) - General Subjects, vol. 1790, no 10, , p. 1005-14.
- Cf. Jeremy M. Van Rammsdonk, Siegfried Hekimi et Stuart K. Kim (dir.), « Deletion of the Mitochondrial Superoxide Dismutase sod-2 Extends Lifespan in Caenorhabditis elegans », PLoS Genetics, vol. 5, no 2, , e1000361 (PMID 19197346, PMCID 2628729, DOI 10.1371/journal.pgen.1000361, lire en ligne)
- D. Harman, « Aging: a theory based on free radical and radiation chemistry », J. Gerontol., vol. 11, no 3, , p. 298–300 (PMID 13332224, DOI 10.1093/geronj/11.3.298)
- D. Harman, « Origin and evolution of the free radical theory of aging: a brief personal history, 1954–2009 », Biogerontology, vol. 10, no 6, , p. 773–81 (DOI 10.1007/s10522-009-9234-2)
- Cf. J.R. Speakman et C. Selman, « The free-radical damage theory: Accumulating evidence against a simple link of oxidative stress to ageing and lifespan », BioEssays, vol. 33, no 4, , p. 255–9 (DOI 10.1002/bies.201000132)
- Cf. D. Clancy et J. Birdsall, « Flies, worms and the Free Radical Theory of ageing », Ageing Research Reviews, vol. 12, no 1, 2013 jan, p. 404-12 (DOI 10.1016/j.arr.2012.03.011).
- S. Chatterjee, O. Lardinois, S. Bhattacharjee, J. Tucker, J. Corbett, L. Deterding et al., « Oxidative stress induces protein and DNA radical formation in follicular dendritic cells of the germinal center and modulates its cell death patterns in late sepsis », Free Radical Biology and Medicine, vol. 50, no 8, , p. 988–99 (DOI 10.1016/j.freeradbiomed.2010.12.037)
- Y.C. Jang et H.V. Remmen, « The mitochondrial theory of aging: Insight from transgenic and knockout mouse models », Experimental Gerontology, vol. 44, no 4, , p. 256–60 (DOI 10.1016/j.exger.2008.12.006)
- J. Gruber, S. Schaffer et B. Halliwell, « The mitochondrial free radical theory of ageing--where do we stand? », Frontiers in Bioscience, vol. 13, , p. 6554–79 (DOI 10.2741/3174)
- Orchin M, Macomber RS, Pinhas A, Wilson RM, editors. The Vocabulary and Concepts of Organic Chemistry. 2 ed: John Wiley & Sons; 2005.
- Cui Hang, Kong Yahui et Zhang Hong, « Oxidative Stress, Mitochondrial Dysfunction, and Aging », Journal of Signal Transduction, vol. 2012, , p. 646354 (PMID 21977319, PMCID 3184498, DOI 10.1155/2012/646354)
- D’après C. Crean, N.E. Geacintov et V. Chafirovitch, « Intrastrand G-U cross-links generated by the oxidation of guanine in 5′-d(GCU) and 5′-r(GCU) », Free Radical Biology and Medicine, vol. 45, no 8, , p. 1125–34 (DOI 10.1016/j.freeradbiomed.2008.07.008)
- D’après M. Dizdaroglu et P. Jaruga, « Mechanisms of free radical-induced damage to DNA », Free Radical Research, vol. 46, no 4, , p. 382-419.
- D’après H. Pageon et D. Asselineau, « An in Vitro Approach to the Chronological Aging of Skin by Glycation of the Collagen: The Biological Effect of Glycation on the Reconstructed Skin Model », Annals of the New York Academy of Sciences, 1043e série, no 1, , p. 529-32.
- D’après V.V. Bamm, V.A. Tsemakhovitch et N. Chaklaï, « Oxidation of low-density lipoprotein by hemoglobin–hemichrome », The International Journal of Biochemistry & Cell Biology, vol. 35, no 3, , p. 349-58.
- D’après C. Richter, J.W. Park et B.N. Ames, « Normal oxidative damage to mitochondrial and nuclear DNA is extensive », PNAS, (lire en ligne).
- D’après I.B. Afanas'ev, « Free radical mechanisms of aging processes under physiological conditions », Biogerontology, vol. 6, no 4, , p. 283–90 (DOI 10.1007/s10522-005-2626-z)
- D. Bagchi et al "Oxygen free radical scavenging abilities of vitamins C and E, and a grape seed proanthocyanidin extract in vitro" "Research Communications in Molecular Pathology and Pharmacology" 1997.
- Cf. Hans K. Biesalski, « Free radical theory of aging », Current Opinion in Clinical Nutrition and Metabolic Care, vol. 5, no 1, , p. 5 -10.
- M. Sawada et J.C. Carlson, « Changes in superoxide radical and lipid peroxide formation in brain, heart and liver during the lifetime of the rat », Mechanisms Of Ageing And Development, vol. 41, , p. 125–37 (DOI 10.1016/0047-6374(87)90057-1)
- Chung HY, Song SH, Kim HJ, Ikeno Y, Yu BP, « Modulation of renal xanthine oxidoreductase in aging: gene expression and reactive oxygen species generation », The Journal of Nutrition, Health & Aging, vol. 3, no 1, , p. 19–23
- Jacobson A, Yan C, Gao Q, Rincon-Skinner T, Rivera A, Edwards J et al, « Aging enhances pressure-induced arterial superoxide formation », American Journal of Physiology Heart and Circulatory Physiology, vol. 293, no 3, , H1344–H50 (DOI 10.1152/ajpheart.00413.2007)
- D'après C.A. Hamilton, M.J. Brosnan, M. McIntyre, D. Graham et A.F. Dominiczak, « Superoxide excess in hypertension and aging: a common cause of endothelial dysfunction », Hypertension, vol. 37, , p. 529–34 (DOI 10.1161/01.hyp.37.2.529)
- A.J. Donato ,I. Eskurza, A.E. Silver, A.S. Levy, G.L. Pierce, P.E. Gates et al., « Direct evidence of endothelial oxidative stress with aging in humans: relation to impaired endothelium-dependent dilation and upregulation of nuclear factor-kappaB », Circulation Research, vol. 100, no 11, , p. 1659–66 (DOI 10.1161/01.res.0000269183.13937.e8)
- S.K. Moon, L.J. Thompson, N. Madamanchi, S. Ballinger, J. Papaconstantinou, C. Horaist et al, « Aging, oxidative responses, and proliferative capacity in cultured mouse aortic smooth muscle cells », American Journal of Physiology Heart and Circulatory Physiology, vol. 280, no 6, , H779–H88
- Chen H, Cangello D, Benson S, Folmer J, Zhu H, Trush MA et al., « Age-related increase in mitochondrial superoxide generation in the testosterone-producing cells of Brown Norway rat testes: relationship to reduced steroidogenic function? », Experimental Gerontology, vol. 36, no 8, , p. 1361–73 (DOI 10.1016/s0531-5565(01)00118-8)
- D’après Choksi KB, Roberts LJ, DeFord JH, Rabek JP, Papaconstantinou J, « Lower levels of F2-isoprostanes in serum and livers of long-lived Ames dwarf mice », Biochemical And Biophysical Research Communications, vol. 364, no 4, , p. 761–4 (DOI 10.1016/j.bbrc.2007.10.100)
- D’après Lener B, Kozieł R, Pircher H, Hütter E, Greussing R, Herndler-Brandstetter D et al., « The NADPH oxidase Nox4 restricts the replicative lifespan of human endothelial cells », The Biochemical Journal, vol. 423, no 3, , p. 363–74 (DOI 10.1042/bj20090666)
- D’après Rodríguez-Mañas L, El-Assar M, Vallejo S, López-Dóriga P, Solís J, Petidier R et al., « Endothelial dysfunction in aged humans is related with oxidative stress and vascular inflammation », Aging Cell, vol. 8, no 3, , p. 226–38 (DOI 10.1111/j.1474-9726.2009.00466.x)
- D’après T. Sasaki, K. Unno, S. Tahara, A. Shimada, Y. Chiba, M. Hoshino et al., « Age-related increase of superoxide generation in the brains of mammals and birds », Aging Cell, vol. 7, no 4, , p. 459–69 (DOI 10.1111/j.1474-9726.2008.00394.x)
- Mendoza-Núñez VM, Ruiz-Ramos M, Sánchez-Rodríguez MA, Retana-Ugalde R, Muñoz-Sánchez JL. Aging-related oxidative stress in healthy humans. The Tohoku Journal of Experimental Medicine. 2007;213(3) 261-8.
- M. Miyazawa , T. Ishii , K. Yasuda , S. Noda , H. Onouchi , P.S. Hartman, « The role of mitochondrial superoxide anion (O2(-)) on physiological aging in C57BL/6J mice », Journal of Radiation Research, vol. 50, no 1, , p. 73–83 (DOI 10.1269/jrr.08097)
- D’après D.D. Lund, Y. Chu, J.D. Miller, D.D. Heistad, « Protective effect of extracellular superoxide dismutase on endothelial function during aging », American Journal of Physiology Heart and Circulatory Physiology, vol. 296, no 6, , H1920–H5 (DOI 10.1152/ajpheart.01342.2008)
- D’après I. Afanassiev, « Signaling and Damaging Functions of Free Radicals in Aging-Free Radical Theory, Hormesis, and TOR », Aging And Disease, vol. 1, no 2, , p. 75–88
- D’après A.N. Lobatchev, « Role of mitochondrial processes in the development and aging of organism. Aging and cancer », VINITI, vol. 91, no 25, , p. 2172-78 (lire en ligne)
- D’après A.N. Lobatchev, « Biogenesis of mitochondria during cell differentiation and aging », VINITI, no 6756-В85, , p. 28 (lire en ligne)
- D’après J. Miquel, A.C. Economos, J. Fleming et al., « Mitochondrial role in cell aging », Exp. Gerontol., no 15, , p. 575–591
- D’après Richard Weindruch, « Calorie Restriction and Aging », Scientific American, , p. 49–52
- D’après S.K. Poovathingal, J. Gruber, B. Halliwell, R. Gunawan, « Stochastic drift in mitochondrial DNA point mutations: a novel perspective ex silico », PLOS Computational Biology, vol. 5, no 11, , e1000572 (DOI 10.1371/journal.pcbi.1000572)
- D’après D. Conte, S. Narindrasorasak, B. Sarkar, « In vivo and in vitro iron-replaced zinc finger generates free radicals and causes DNA damage », The Journal of Biological Chemistry, vol. 271, no 9, , p. 5125–30
- D'après G. J. Brewer, « Epigenetic oxidative redox shift (EORS) theory of aging unifies the free radical and insulin signaling theories », Experimental Gerontology, vol. 45, no 3, , p. 173–9 (DOI 10.1016/j.exger.2009.11.007)
- Cf. T.C. Brink, L. Demetrius, H. Lehrach et J. Adjaye, « Age-related transcriptional changes in gene expression in different organs of mice support the metabolic stability theory of aging », Biogerontology, vol. 10, no 5, , p. 549-64.
- D’après T.J. Schulz, K. Zarse, A. Voigt, N. Urban, M. Birringer, M. Ristow, « Glucose restriction extends Caenorhabditis elegans life span by inducing mitochondrial respiration and increasing oxidative stress », Cell Metabolism, vol. 6, no 4, , p. 280–93 (PMID 17908557, DOI 10.1016/j.cmet.2007.08.011, lire en ligne)
- D’après P.C. Tapia, « Sublethal mitochondrial stress with an attendant stoichiometric augmentation of reactive oxygen species may precipitate many of the beneficial alterations in cellular physiology produced by caloric restriction, intermittent fasting, exercise and dietary phytonutrients: "Mitohormesis" for health and vitality », Medical Hypotheses, vol. 66, no 4, , p. 832–43 (PMID 16242247, DOI 10.1016/j.mehy.2005.09.009)
- D’après R. Sohal, R. Mockett, W. Orr, « Mechanisms of aging: an appraisal of the oxidative stress hypothesis », Free Radic Biol Med, vol. 33, no 5, , p. 575–86 (PMID 12208343, DOI 10.1016/S0891-5849(02)00886-9)
- D’après R. Sohal, « Role of oxidative stress and protein oxidation in the aging process », Free Radic Biol Med, vol. 33, no 1, , p. 37–44 (PMID 12086680, DOI 10.1016/S0891-5849(02)00856-0)
- D’après S. Rattan, « Theories of biological aging: genes, proteins, and free radicals », Free Radic Res, vol. 40, no 12, , p. 1230–8 (PMID 17090411, DOI 10.1080/10715760600911303)
- D’après G. Bjelakovic, D. Nikolova, L.L. Gluud, R.G. Simonetti, C. Gluud, « Mortality in randomized trials of antioxidant supplements for primary and secondary prevention: systematic review and meta-analysis », The Journal of the American Medical Association, vol. 297, no 8, , p. 842–57 (PMID 17327526, DOI 10.1001/jama.297.8.842, lire en ligne). Cf. également Philip Taylor, « letter », sur Journal of the American Medical Association et la réponse de Sanford Dawsey.
- D'après I. Afanassiev, « Signaling and Damaging Functions of Free Radicals in Aging-Free Radical Theory, Hormesis, and TOR », Aging And Disease, vol. 1, no 2, , p. 75-88.
- D'après L. Castello., T. Froio, G. Cavallini, F. Biasi, A. Sapino, G. Leonarduzzi et al., « Calorie restriction protects against age-related rat aorta sclerosis », FASEB Journal, vol. 19, no 13, , p. 1863–5
- D'après Z. Ungvari, C. Parrado-Fernandez, A. Csiszar et R. de Cabo, « Mechanisms underlying caloric restriction and lifespan regulation: implications for vascular aging », Circulation Research, vol. 102, no 5, , p. 519-28.
- D'après L. Fontana, L. Partridge et V.D. Longo, « Extending healthy life span--from yeast to humans », Science, New York, vol. 328, no 5976, , p. 321-6.
- D’après G. Barja, « Mitochondrial oxygen consumption and reactive oxygen species production are independently modulated: implications for aging studies », Rejuvenation Research, vol. 10, no 2, 2007;, p. 215-24.
- Lewis KN, Andziak B, Yang T et Buffenstein R, « The naked mole-rat response to oxidative stress: just deal with it », Antioxid. Redox Signal., vol. 19, no 12, , p. 1388–99 (PMID 23025341, PMCID 3791056, DOI 10.1089/ars.2012.4911)
- S.L. MacRae, M.M. Croken, R.B. Calder, A. Aliper, B. Milholland, R.R. White, A. Javoronkov, V.N. Gladyshev, A. Seluanov, V. Gorbunova, Zhang ZD et Vijg J, « DNA repair in species with extreme lifespan differences », Aging (Albany NY), vol. 7, no 12, , p. 1171–84 (PMID 26729707, PMCID 4712340, DOI 10.18632/aging.100866)
- Montgomery MK, Hulbert AJ, Buttemer WA, « Does the oxidative stress theory of aging explain longevity differences in birds? I. Mitochondrial ROS production », Exp. Gerontol., vol. 47, no 3, , p. 203–10 (PMID 22123429, DOI 10.1016/j.exger.2011.11.006)
- D’après The Alpha-Tocopherol, Beta Carotine Cancer Prevention Study Group, « The effect of vitamin E and beta carotine on the incidence of lung cancer and other cancers in male smokers », New England Journal of Medicine, vol. 330, no 15, , p. 1029–35 (PMID 8127329, DOI 10.1056/NEJM199404143301501)
- Omenn GS, Goodman GE, Thornquist MD, Balmes J, Cullen MR, Glass A, etal, « Effects of a combination of beta carotine and vitamin A on lung cancer and cardiovascular disease », New England Journal of Medicine, vol. 334, no 18, , p. 1150–5 (PMID 8602180, DOI 10.1056/NEJM199605023341802)
- D’après G. Bjelakovic, D. Nikolova, R.G. Simonetti et C. Gluud, « Antioxidant supplements for prevention of gastrointestinal cancers: a systematic review and meta-analysis », Lancet, vol. 364, no 9441, , p. 1219–28 (PMID 15464182, DOI 10.1016/S0140-6736(04)17138-9)
- Miller ER 3rd, Pastor-Barriuso R, Dalal D, Riemersma RA, Appel LG, Guallar E., « Meta-analysis: High-dosage vitamin E supplementation may increase all-cause mortality », Annals of Internal Medicine, vol. 142, no 1, , p. 37–46 (PMID 15537682, DOI 10.7326/0003-4819-142-1-200501040-00110, lire en ligne)
- D'après Heart Protection Study Collaborative Group, « MRC/BHF Heart Protection Study of antioxidant vitamin supplementation in 20,356 high-risk individuals: a randomised placebo-controlled trial », Lancet, vol. 360, no 9326, , p. 23–33 (PMID 12114037, DOI 10.1016/S0140-6736(02)09328-5)
- Age-Related Eye Disease Study Research Group, « A Randomized, Placebo-Controlled, Clinical Trial of High-Dose Supplementation With Vitamins C and E and Beta Carotene for Age-Related Cataract and Vision Loss: AREDS Report No. 9 », Arch Ophthalmol, vol. 119, no 10, , p. 1439–52 (PMID 11594943, PMCID 1472812, DOI 10.1001/archopht.119.10.1439)
- Heiner Boeing, Angela Bechthold, Achim Bub, Sabine Ellinger, Dirk Haller, Anja Kroke, Eva Leschik-Bonnet, Manfred J. Müller, Helmut Oberritter, Matthias Schulze, Peter Stehle et Bernhard Watzl, « Critical review: vegetables and fruit in the prevention of chronic diseases », European Journal of Nutrition, vol. 51, no 6, , p. 637–663 (PMID 22684631, PMCID 3419346, DOI 10.1007/s00394-012-0380-y)
- D’après V. Calabrese, C. Cornelius, A. Trovato, M. Cavallaro, C. Mancuso et L. Di Rienzo et al., « The hormetic role of dietary antioxidants in free radical-related diseases », Current Pharmaceutical Design, vol. 16, no 7, , p. 877-83.
- D’après Boffetta P, Couto E et Wichmann J et al., « Fruit and vegetable intake and overall cancer risk in the European Prospective Investigation into Cancer and Nutrition (EPIC) », J. National Cancer Inst., vol. 102, no 8, , p. 529–37 (PMID 20371762, DOI 10.1093/jnci/djq072)