Chimiluminescence
La chimiluminescence, ou chimioluminescence, est la production de lumière à la suite d'une réaction chimique. Une réaction de ce type est l'oxydo-réduction du luminol (3-aminophthalhydrazide) par l'eau oxygénée (H2O2), par exemple, ou un quelconque oxydant. Durant une réaction de chimiluminescence, une molécule de type diester ou amide entre dans un état excité et transfère cette énergie à un accepteur (porteur de luminescence). Ce dernier, afin de revenir à son état fondamental, libère un photon, d'où la luminescence.

La bioluminescence de certains animaux (vers luisants, plancton, etc.), végétaux (champignons) et bactéries, est une forme naturelle de chimiluminescence.
Applications
- La chimiluminescence est la source des lasers dits « chimiques ».
- Utilisé dans un tube en plastique, ce phénomène permet d'obtenir une source de lumière de secours ou bien des objets (bracelets, colliers, cerceaux, etc.) décoratifs lors de fêtes nocturnes. Voir bâton lumineux (cyalume).
- En criminalistique, le phénomène permet de mettre en évidence des traces de sang peu ou pas visibles à l'œil nu (dans ce cas, le luminol réagit avec les ions fer des globules rouges, en produisant de la lumière).
- Lors d'études environnementales, le phénomène peut être utilisé pour la détection du dioxyde d'azote : ce gaz réagit bien avec le luminol.
- Il existe également de nombreuses applications médicales à ce phénomène, comme la détection de cellules cancéreuses ou le dépistage des infarctus cardiaques.
- En sciences judiciaires (police scientifique), pour l'analyse d'explosifs ayant un ou plusieurs groupements NO2 (ex: TNT, Nitroglycérine, etc.)
Principe
Il existe deux types de chimiluminescence :
- la chimiluminescence directe, dans laquelle le photon émis provient directement de la désexcitation de la molécule excitée ;
- la chimiluminescence indirecte, dans laquelle l'excitation est transmise à une molécule intermédiaire (un fluorophore) qui, en se désexcitant, émet un photon.
Détection d'explosifs
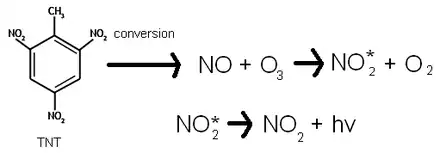
Avec un détecteur de chimiluminescence, on peut détecter des explosifs ayant un ou plusieurs groupements NO2. Le ou les explosifs se séparent par chromatographie puis se décomposent en NO à l'aide de chaleur. Après cette décomposition, NO réagit avec de l'ozone O3 pour former du NO2 à l'état excité, NO2*. Ensuite NO2* perd de l'énergie et rejoint son état fondamental en émettant de la lumière (voir figure ci-contre). La lumière émise est mesurée par un photomultiplicateur (PM), puis un signal observable est obtenu sous forme d'un pic sur un chromatogramme. L'intensité de la lumière émise est proportionnelle à la quantité de NO, donc à celle des molécules de départ.
Exemples de composés utilisés
Diesters permettant la luminescence en présence d'eau oxygénée et de rubrène
| Ester | Intensité de l'émission | Durée (en minutes) |
|---|---|---|
| bis(4-nitrophénol) oxalate | Forte | 15-20 |
| bis(p-cresyl) oxalate | Pas d'émission | - |
| bis(2,4-dinitrophénol) oxalate | Très forte | 10-15 |
| bis(2,4,6-trichlorophénol) oxalate | Forte | 15-20 |
| bis(3,4,6-trifluorophénol) oxalate | Forte | <5 |
| bis(3,4,5-trimethoxyphénol) oxalate | Pas d'émission | - |
Chimiluminescence infrarouge
Dans la cinétique chimique, la chimiluminiscence infrarouge signifie l'émission des photons infrarouges par des molécules d'un produit de réaction en état d'excitation vibrationnelle immédiatement après leur formation. Les intensités des lignes d'émission infrarouge sont employées afin de mesurer les peuplements des états vibrationnels des molécules de produit[1] - [2].
L'observation de la chimiluminescence infrarouge est employée comme technique de la cinétique par John Polanyi, qui s'en sert pour étudier la nature attractive ou répulsive d'une surface d'énergie potentielle d'une réaction en phase gazeuse. En général la luminescence est beaucoup plus intense aux réactions qui possèdent une surface attractive, ce qui indique que ce genre de surface favorise la déposition de l'énergie sous forme d'excitation vibrationnelle. Par contre aux réactions qui possèdent une surface d'énergie potentielle il y a peu de luminescence infrarouge, ce qui indique que l'énergie est déposée surtout sous forme d'énergie translationnelle[3].
Références
Sources
- Champiat Dominique et Jean Paul Larpent, Biochimiluminescence. Principes et applications, éd. Masson, coll. « Biotechnologies », 1993, 531 p.
- (en) Champiat Dominique et al., « Applications of biochemiluminescence to HACCP » dans Luminescence, mars-, vol. 16, numéro 2, p. 193-8
- (en) Meilin Liu, Zhen Lin et Jin-Ming Lin, « A review of chemiluminescence detection in food analysis » dans Analytica Chimica Acta, vol. 670, p. 1-10
- (en) Ana M. Garcia-Campana et Willy R.G. Baeyens, Chemiluminescence in Analytical Chemistry, Marcel Dekker, 2001, 621 p. (ISBN 0-8247-0464-9)
- (en) Synthesis of Chemiluminescent Esters: A Combinatorial Synthesis Experiment for Organic Chemistry Students R. Duarte, Janne T. Nielsen et Veljko Dragojlovic, Journal of Chemical Education, 2004, 81 (7), p 1010