Syndrome métabolique
Le syndrome métabolique désigné par les acronymes SMet (pour syndrome métabolique) ou MetS (pour Metabolic syndrome chez les anglophones) désigne l'association d'une série de problèmes de santé ayant en commun un mauvais métabolisme corporel causé par un excès de graisse viscérale dans la région abdominale[1].
| Spécialité | Endocrinologie et médecine interne |
|---|
| CIM-9 | 277.7 |
|---|---|
| OMIM | 605552 |
| DiseasesDB | 31955 |
| MedlinePlus | 007290 |
| eMedicine | 165124 |
| MeSH | D024821 |
| Patient UK | Metabolic-syndrome |
![]() Mise en garde médicale
Mise en garde médicale
Il fait partie des syndromes émergents associés à l'obésité. On ne peut pas encore affirmer qu'il s'agit vraiment d'une maladie plutôt qu'un simple regroupement de facteurs de risque plus ou moins liés par une origine, des cibles métaboliques ou des mécanismes communs. Il y a cependant consensus sur le fait que le syndrome métabolique détecté chez une personne n'ayant déclaré aucun symptôme particulier correspond à un risque d'accident cardio-vasculaire multiplié par trois par rapport à un individu réellement en bonne santé.
Description
Le syndrome métabolique décrit un état qui est considéré comme préfigurant plusieurs maladies graves :
- diabète de type 2 (DT 2), avec par exemple un risque sept fois plus élevé chez les Finlandais porteurs de SMET[2] que pour le reste de la population ;
- troubles cardiovasculaires ;
- accident vasculaire cérébral (AVC) ; risque 1,26 fois plus élevé[3] à 2,2 fois plus élevé selon l'OMS, avec des bases méthodologiques moins strictes.
Pourraient s'y ajouter :
- dépression ou anxiété[4] ;
- déclin cognitif[5] et peut-être démence[6]... ou d'autres maladies en cours d'étude ;
- cancers ? Les études épidémiologiques reliant le syndrome métabolique au cancer sont rares, mais Stephanie Cowey de l'université d'Alabama note que presque toutes les composantes du syndrome métabolique ont été individuellement plus ou moins liés au développement du cancer. Deux études au moins montrent que le simple regroupement des éléments du syndrome métabolique augmente considérablement le risque de mortalité par le cancer du côlon par rapport aux composants individuels. Tous les processus ou sous-processus décrits par ce syndrome (insulinorésistance, l'activité aromatase, la production d'adipokine, l'angiogénèse, l'exploitation de glucose, et le stress oxydatif / les dommages à l'ADN) peuvent synergiquement concourir à favoriser le cancer, plus que les composants du syndrome pris séparément. En quelque sorte, la somme des parties serait un facteur de risque supérieur à l'addition du risque de chaque composante[7]. Les auteurs concluent que d'éventuels liens avec d'autres cancers devraient être explorés.
Tabagisme et/ou alcoolisme augmentent encore le risque cardiovasculaire et de cancer,
Enjeu de santé publique
Comme le cancer, la vulnérabilité cardiovasculaire[8], les allergies, la délétion de la spermatogenèse et d'autres syndromes émergents très probablement multifactoriels, il s'agit d'un problème de santé publique d'enjeu mondial, qui invite le médecin et l'épidémiologue, mais aussi le politique à une approche plus holistique et pluridisciplinaire de la santé, et qui justifie des actions de détection (monitoring épidémiologique et éco-épidémiologique), information/prévention et suivi des personnes à risque. D'autant que le dépistage est simple et peu coûteux. Il suffirait d'une simple visite médicale scolaire ou d'entreprise associant une mesure du tour de taille, et un taux de triglycérides (prise de sang) pour repérer 80 % des patients victimes d'un syndrome métabolique. Chez les 20 % restants, tant que le pancréas réussit à maintenir une glycémie proche de la norme, le syndrome métabolique est difficile voire impossible à détecter par les tests courants de glycémie. De simple mesures de l'indice du poids corporels et du tour de taille suffisent à détecter un nombre significatif des adolescentes affectées par ce syndrome[9].
Un meilleur dépistage permettrait souvent d'éviter l’évolution du syndrome vers des maladies graves et invalidantes (diabète de type 2 ou troubles cardiovasculaires).
Définition(s)
Il en existe plusieurs, qui ont varié dans le temps et selon les organismes de santé ou les pays (définition OMS de 1998, de l'EGIR, European Group for the study of Insulin Resistance en 1999, du NCEP-ATP III (National Cholesterol Education / Program-Adult Treatment Panel III) en 2001 et 2005, ou de l'IDF, International Diabetes Federation, en 2005), mais il y a consensus pour parler de « syndrome métabolique » dans les cas où au moins trois des problèmes suivants sont associés chez la même personne[10] ;
- taux d’insuline anormalement élevé (qui expliquerait le risque de mortalité cardio-vasculaire plus élevée associé à ce syndrome ainsi qu'un risque de diabète de type 2, induit par épuisement du pancréas qui doit produire toujours plus d’insuline pour réduire l'hyperglycémie quand elle existe ; ce syndrome peut néanmoins exister chez des non-diabétiques[11].
- hypercholestérolémie avec un faible [12]taux de cholestérol HDL (le « bon » cholestérol) inférieur à 1,04 mmol/l pour les hommes, 1,29 mmol/l (46 mg/dl) pour les femmes.
- hypertension (pression artérielle trop élevée, c'est-à-dire >140 mmHg de pression systolique(maxima) et/ou >90 mmHg de pression diastolique(minima) ; un traitement anti-hypertenseur est à prendre en compte comme critère) ; le critère "hypertension" est plus fréquent chez les hommes[13].
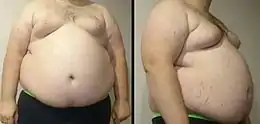
- excès de poids surtout s'il s'agit d'une obésité viscérale (tour de taille supérieur à 102 cm pour les hommes, et à 88 cm pour les femmes) ; ce critère est plus fréquent chez les femmes, comme celui du HDL-cholestérol bas[14] ; l'embonpoint augmente aussi le risque d’athérosclérose. Chez la femme l'obésité viscérale donne l'impression que la patiente est enceinte.
- hyperglycémie, c'est-à-dire un taux excessif de sucres dans le sang (triglycérides sanguins supérieurs à 1,6 ou 1,7 mmol/l (ou 150 mg/dl) et/ou glycémie (mesurée par un test à jeun) supérieure ou égale à 6,1 mmol/l (ou 110 mg/dl) ; toute hyperglycémie durable augmente le risque cardiovasculaire, via le taux de mauvais cholestérol et de triglycérides (lipides sanguins) qui affecte les parois artérielles, mais aussi en tant que facteur d’hypertension.
Remarque : Les mesures sont généralement faites en mmol/l, sauf aux États-Unis, où le décilitre (mg/dl) domine encore.
D'autres critères pourraient s'ajouter à ceux-ci, en fonction des progrès de la recherche ;
- L'inflammation, mesurée par le taux de protéine C-réactive et l'interleukine 6 pourraient bientôt en faire partie[15].
- une microalbuminurie (Une microalbuminurie et/ou une protéinurie doivent être confirmées sur les urines des 24 h.)[16]. La microalbuminurie est un bon marqueur indépendant de risque cardiovasculaire, mais aussi un marqueur de succès thérapeutique.
- un syndrome ovarien polykystique ou syndrome des ovaires polykystiques ou SOP, qui est une perturbation métabolique caractérisée par une hyperandrogénie (hirsutisme et virilisation), une infertilité par absence d’ovulation, des troubles du cycle menstruel et une obésité) ; le SOP semblant ici pouvoir être à la fois une cause et une conséquence du syndrome métabolique, souvent associé à une obésité et à une insulino-résistance.
- Divers indices (en cours d'étude) invitent à penser qu'il existe des liens entre le syndrome métabolique et d’autres maladies (ex. : Syndrome d'Apnées Obstructives du Sommeil[17] souvent associée à l'obésité et qui toucherait environ 18 millions de nord américains, ou des maladies hormono-dépendantes graves comme le cancer du sein, de l’utérus, de la prostate ou du testicule, ainsi qu'avec le cancer du côlon (le facteur alimentaire pouvant être en cause) et peut-être avec la maladie d’Alzheimer.
La définition de l’OMS modifiée privilégie l’insulinorésistance mise en évidence par l’existence d’une glycémie à jeun supérieure ou égale à 6,1 mmol/l ou d’une insulinémie à jeun dans le quartile supérieur, associée à deux ou plus des critères suivants :
- BMI-IMC supérieur ou égal à 30 kg/m², ou rapport taille-hanche supérieur à 0,9 chez l’homme, ou 0,85 chez la femme
- cholestérol HDL inférieur à 0,9 mmol/l pour les hommes (1,0 mmol/l pour les femmes) ou triglycérides supérieurs à 1,7 mmol/l
- Pression artérielle supérieure ou égale à 140 / 90 mmHg ou traitement anti-hypertenseur
- Une HGPO sur 75 gr de glucose avec un seuil pour la glycémie à 2 heures fixé à 7,8 mmol/l
Causes
L’étiologie du syndrome métabolique est une double résistance à l’insuline (insulino-résistance) et à la leptine[18]. L'effet conjugué du blocage des deux systèmes de régulation stimule la surconsommation alimentaire et la sédentarité, et in fine de l'obésité[19].
- L'insuline, hormone pancréatique régulatrice joue un rôle métabolique majeur via le contrôle la distribution du glucose dans l'organisme et les cellules. Une cellule devenue insulino-résistante n’absorbe plus normalement le glucose qui se retrouve alors trop concentré dans le sang, alors que les cellules en manquent (cf. diabète sucré), ce qui incite le pancréas à produire plus d’insuline jusqu'à ce que cette augmentation ne compense plus l'insulinorésistance des cellules, situation qui aboutit à une glycémie trop élevée.
- La leptine est aussi une hormone, mais produite par les tissus adipeux[20], elle indique au corps qu'il a des réserves qu'il ne doit plus manger et qu'il peut dépenser cette énergie[21]. Mais, chez les obèses, des taux très élevés de leptine ne provoquent plus le blocage de l'appétit et la stimulation de l'activité physique[22], ce qui serait dû au fait que de forts taux d'insuline bloqueraient l'action de la leptine.
Les causes du syndrome métabolique sont essentiellement la consommation de grande quantité de sucre raffiné[23] (non lié à une matrice végétale comme dans un fruit), notamment de fructose transformé[24] et d'aliment à haut index glycémique (glucides transformés, y compris amidon cuit improprement désigné comme "sucre lent")[25], associées à des prédispositions génétiques[26]. Les régimes plus pauvres en glucides réduisent les risques de syndrome métabolique[27].
On a récemment recherché chez la femme ménopausée d'éventuels liens entre syndrome métabolique et hyperandrogénie (une relation possible était suggérée par l'étude des cas de syndrome des ovaires polykystiques). Les mesures de taux d'estradiol, de testostérone, d'hormone sexuelle et de la Sex hormone-binding globulin ou SHBG, liée ou libre, ont permis de calculer un « indice androgénique » (FAI) chez 212 femmes ménopausées n'ayant pas été traitées par hormonothérapie. Celles qui présentaient un syndrome métabolique (au sens de la définition ATP III modifiée) avaient des taux d'estradiol élevé. Or, c'est l'hormone qui renforce l'apport de lipides aux seins, hanches, cuisses lors de la puberté. De même, ces femmes présentaient un taux élevé de testostérone et un indice FAI élevé, alors que leur taux de SHBG était au contraire très bas. La SHBG est une molécule qui capte et inhibe ces hormones, la biodisponibilité des hormones sexuelles est élevée quand le niveau de SHBG est bas.
Un indice FAI élevé et une SHBG basse étaient statistiquement associés à toutes les composantes du syndrome métabolique, même chez les femmes présentant un indice de masse corporelle (IMC) <26,7 kg/m². Un « profil hormonal androgène » est donc chez la femme ménopausée associé à la fois aux composants individuels du syndrome métabolique et au regroupement des anomalies métaboliques de ces femmes[28].
Origines et facteurs de prédispositions
Plusieurs facteurs sont réputés favoriser ce syndrome :
- l’hérédité parfois (clairement quand ce syndrome est associé à un diabète de type 2 même si les gènes responsables n'ont pas encore été identifiés ni les marqueurs correspondants[29])
- sédentarité (mode de vie où les efforts physiques sont limités)
- mauvaise alimentation (trop de sucre, viandes, alcool et de graisses, pas assez de fruits et légumes, ou boisson ou aliments contenant certains perturbateurs endocriniens, phytoestrogènes), cause parfois traduite en France par la notion de « malbouffe » généralement source d'hypertension, d'hypertriglycéridémie ou d'hyperglycémie avec déficit de cholestérol HDL (le bon cholestérol) dans le sang.
Une étude de 2019 évoque un lien (pas nécessairement de causalité) entre une charge corporelle en aluminium (Al) élevée et l'obésité (et peut-être le syndrome métabolique) : chez les 30–50 ans (non exposés professionnellement), plus les taux d'aluminium dans les cheveux et l'urine sont supérieurs à la moyenne, plus la personne risque d'être obèse)[30] ; les sujets obèses (non exposés professionnellement) présentent 31% et 46% d’aluminium en plus dans leurs cheveux et urines par rapport aux sujets témoins maigres. La présence d'hypertension (41% des cas), d'athérosclérose (8%), de diabète sucré de type 2 (10%) et de stéatose hépatique non alcoolique (53%) chez les patients obèses n'était par contre pas associée aux taux d'Al chez les sujets étudiés[30]. Mais un taux élevé d'Al urinaire, une hypertension et la NAFLD étaient statistiquement significativement et directement associés à l'IMC. Des études cliniques et expérimentales complémentaires sont nécessaires pour démontrer un éventuel lien de cause à effet et de possibles effets directs de l'Al sur le tissu adipeux et le métabolisme des graisses[30].
- « Surpoids abdominal » ; mais ce facteur a peut-être été surestimé ; L'Association Japonaise de Médecine Interne définissait le syndrome métabolique comme associant obligatoirement un surpoids abdominal et au moins deux autres facteurs parmi hypertension, hypertriglycéridémie, hyperglycémie, déficit de cholestérol-HDL sanguin. Après avoir étudié 34 000 sujets parmi 140 000 Japonais suivis depuis 1990 (mode de vie, alimentation et santé), une étude[31] montre que des patients dont le tour de taille est inférieur à 85 cm pour les hommes et 90 cm pour les femmes (valeurs-guide de l'Association Japonaise de Médecine Interne) sont aussi exposés à ce syndrome[32] - [33].
Prévalence
La prévalence varie selon la région géographique, l'ethnie, la culture, le sexe (masculin ou féminin), le niveau de développement du pays ou de la classe sociale considérée (cf. diététique, taux et sortes d’activité physique, espérance de vie et sexe-ratio[34]), l'âge et selon la définition retenue, mais il y a consensus pour reconnaître que ce syndrome est globalement de plus en plus fréquent, y compris dans les pays pauvres, bien qu'avec des variations régionales fortes qui peuvent aussi cacher des variations de la proportion ou répartition des « symptômes » retenus comme critères définissant le SMET.
Tendances/prospective : augmentation différenciée selon les pays ?
Préalables :
- certaines études ont dû corriger les tendances obtenues à partir des statistiques anciennes, car 5 % de l'augmentation mesurée (en données non corrigées) était due à une redéfinition de l'hyperglycémie à jeun (seuil de 110 mg/dl abaissé[35] à 100 mg/dl, ce qui a modifié les statistiques relatives à l'hyperglicémie et au SMet qui reprend ce seuil dans ses critères aux États-Unis[36])
- Le SMET étant défini par plusieurs facteurs, il convient de différencier les aspects quantitatifs et qualitatifs qui peuvent varier indépendamment du taux global de prévalence.
Épidémiologie : le SMet semble par exemple, en tant que syndrome, et en termes de prévalence, s'être stabilisé au Mexique ; alors que certains sous-critères (« obésité » et « hyperglycémie à jeun ») sont en forte croissance, mais compensés par la réduction d'autres critères (déclin de la triglycéridémie et de l'hypertension)[37].
Le SMet est par contre encore en forte croissance aux États-Unis : 23,7 % des citoyens des États-Unis en sont victimes (données corrigées selon nouveaux modes de calculs, contre 21 % en données non corrigées). La hausse est plus rapide ces dernières années. En 6 ans seulement (1988 à 1994), le SMet y a augmenté de 6,7 % chez les 20-29 ans, de + 43,5 % chez les 60-69 ans et de + 42 % chez les 70 ans et plus. Il a encore augmenté de + 27 % de 1999 à 2000, surtout chez les femmes (+ 23,5 %, contre +2,2 % chez les hommes). Ce qui correspond (sur la base de la définition révisée) à 50 millions de personnes touchées aux États-Unis en 1990 puis 64 millions de personnes dix ans plus tard, en 2000. Les chiffres nord-américains ne laissent pas apparaître d'amélioration malgré une prévention accrue des autorités de santé. Peut-être parce que les messages d'éducation sanitaire ne peuvent contrecarrer le poids de la publicité et du marché qui incite à consommer des produits trop sucrés et trop salés, et à une vie plus sédentaire et plus dépendante de la voiture. Mais peut-être aussi parce que ce syndrome pourrait être la conséquence de facteurs de risque plus discrets tels que des perturbateurs endocriniens influant sur le métabolisme des graisses, de manière plus irréversible si le patient en a été victime in utero. Le tissu adipeux, comme le foie, la surrénale et le sein), produit lui-même une petite quantité d'œstrogènes, via des enzymes (aromatases) qui transforment des hormones en œstrogènes. Une faible activité physique et une alimentation riche en graisses et en certains œstrogènes augmente le risque d'exposition au SMet.
Le principal sous-facteur expliquant la prévalence croissante en Amérique du Nord est en effet la croissance de l’obésité abdominale et de l'hypertension artérielle, et, dans une moindre mesure, la hausse de l'hypertriglycéridémie, et une diminution du taux de bon cholestérol, ce qui peut évoquer une cause pseudo-hormonale. La croissance la plus rapide est mesurée chez les femmes de 20-39 ans qui ont vu leur hypertriglycéridémie et hypertension artérielle fortement augmenter ; c'est une classe d'âge qui semble plus exposée au tabac et à l'alcool, et peut-être à la somatotropine bovine (hormone de croissance dopant la production de lait chez les vaches, interdite presque partout dans le monde, mais produit vétérinaire pour vaches laitières le plus vendu aux É.-U.[38]), à d'autres hormones de croissance utilisée comme médicament ou dans l'alimentation animale ou à d'autres perturbateurs (il s'agit aussi de la première ou seconde génération distilbène)[39]. Le temps de loisir et le niveau d'activité physique semblent pourtant être restés stables de 1990 à 1998. L'usage croissant de la voiture au détriment de la marche à pied ou du vélo est évoqué comme cause possible, de même que le travail sédentaire devant l'ordinateur.
Variations géographiques
Près de 47 millions de personnes seraient victimes du SMet aux États-Unis (ou près d'un adulte sur 4 ou sur 5, selon la définition retenue et environ 1 adolescent sur 10 à la fin des années 1990[40] au point qu'il pourrait devenir la première source de maladies cardiovasculaires, avant le tabagisme[41]. Selon les critères NCEP-ATPII, chez les sujets d’âge moyen, on n'observait pas dans les années 1980-1990 de différence homme-femme aux États-Unis (étude NHANES sur 8814 sujets américains de 20 ans et plus (de 1988 à 1994) mais de fortes différences liées à l'âge ; une moyenne de 23,7 % de porteurs du SMET ne doit pas cacher une prévalence plus forte chez les plus âgés (43,5 % des 60-69 ans étaient touchés) contre 6,7 % chez les 20-29 ans[42]. Une différence selon le sexe apparaît nettement avec l'âge (implication hormonale liée à la ménopause ?) ; ainsi le SMET était détecté au début des années 2000 chez 31 % de femmes et 23 % d’hommes (pour 3585 américains avec une moyenne d'âge de 72 ans)[43]. En Europe, à la même époque, chez 508 suédois de 70 ans : 19,2 % de femmes et 26,3 % d’hommes en étaient victimes[44] alors que - toujours en Europe - au début des années 2000, 15 % des adultes en étaient victimes[45].
Les adultes sont donc majoritairement touchés (40 % des plus de 50 ans aux États-Unis et près de 30 % en Europe), mais dans les pays riches les jeunes adultes, et même l'enfant sont de plus en plus touchés[46].
La France compte parmi les pays les moins touchés, peut être en raison d'une exception culturelle alimentaire[47].
Symptômes
Aucun symptôme ne décrit spécifiquement le syndrome métabolique lui-même car il est défini par la conjonction de différents facteurs de risque ayant chacun leur symptomatologie. L'apparition d'un symptôme signifie que le syndrome s’est mué en une maladie, par exemple en diabète de type 2 ou en athérosclérose.
Profil de risque
Le profil type est celui d'un individu sédentaire ou devenu sédentaire, à faible taux de cholestérol HDL et à taux élevé de triglycérides, touché par l'embonpoint ou une obésité (indice de masse corporelle > 30), hypertendu ; il s'agit plus souvent d'un homme de plus de 50 ans ou d'une femme de plus de 60 ans (avec risque augmenté si atteinte du syndrome ovarien polykystique et/ou ayant connu un diabète gestationnel ou ayant donné naissance à un bébé de plus de 4 kg). Mais les patients touchés sont de plus en plus jeunes (en 1999, 11,5 % de 2244 écoliers québécois de 9, 13 et 16 ans, présentaient un syndrome métabolique).
Le risque augmente avec des antécédents familiaux de diabète de type 2 (origine génétique ou type d'alimentation peuvent être en cause) et si l'origine ethnique est hispanique, afro-américaine, amérindienne, polynésienne ou asiatique (sans que l'on sache à ce jour faire la part entre causes génétiques éventuelles et causes culturelles ou socio-économiques).
Prévention et inversion des symptômes
- Conserver ou retrouver un poids normal (IMC<25)
- alimentation saine: pauvre en sel et en aliments à fort Indice Glycémique comme le sucre et féculents (céréales, riz, pain, pâte, etc.)[48], riche en aliments à Indice Glycémique bas et en fibres (pour l'hypertension[49]), riche en protéine[50] en fruits, fruits secs et légumes, riche en lipides (sauf oméga 6, trop souvent en excès dans l'alimentation occidentale) et en produits laitiers.
Un régime de type « méditerranéen » serait efficace[51], les régimes pauvres en glucides[52] et "paléolithique" ont aussi fait leurs preuves[53].
- activité physique: marche rapide, natation, jogging, cyclisme, etc. Quand elle est suffisante (au moins 30 minutes par jour et au moins cinq jours par semaine, et assez intense pour induire une augmentation du rythme cardiaque et une transpiration), l'activité musculaire prévient :
- les risques cardiovasculaires et de diabète ; Chez un occidental obèse souffrant d’insulino-résistance, perdre 4 % de son poids et faire une activité physique (20 à 30 minutes par jour) suffisent à diviser par deux (- 58 %) l’incidence du diabète de type 2, plus efficacement qu'avec un anti-diabétique oral (metformine). C'est ce qu'ont montré deux études cliniques, l'une en Finlande (avec 522 sujets suivis durant 3,3 ans[54]) et l'autre aux États-Unis (avec 3 224 sujets suivis durant 2,8 ans[55]. Une étude clinique chinoise sur 577 sujets suivis 10 ans durant a également montré que l’exercice physique et un régime alimentaire faible en calories diminuait dans cet échantillon l’incidence du diabète de 42 %[56].
- La résistance à l’insuline (l'activité des muscles « brûle » des sucres et des graisses, même en cas de forte résistance à l’insuline. La glycémie et le taux sanguin d’insuline en sont réduits).
- La résistance à la leptine.
- la prise de poids (en diminuant l'embonpoint et le risque cardio-vasculaire.
Traitement
Le syndrome métabolique n'est étudié que depuis quelques années et on ne connaît pas de médicament susceptible de le traiter globalement.
On ignore encore si ne traiter que les facteurs du syndrome pour diminuer les risques de souffrir d’un trouble plus grave suffit (pour l’hypertension, l’hypercholestérolémie, etc.)[57]. Inviter et aider préventivement ou curativement le patient à modifier ses habitudes de vie semble souvent efficace et ce qu'il y a de moins couteux pour la société et la sécurité sociale et les assureurs là où ils existent[58].
L’obésité est parfois traitée par des coupe-faim (ex : sibutramine) ou par des molécules inhibant l’absorption de gras (orlistat). Des antidiabétiques oraux utilisés pour traiter le diabète de type 2 comme la metformine peuvent aider à contrer l’insulino-résistance chez les personnes atteintes de syndrome métabolique. Des médicaments traitent séparément l’hypertension et l’hypercholestérolémie, l’aspirine diminue le risque cardiovasculaire, etc.
Respecter la triade : « Retrouver un poids normal/ manger sain /avoir une activité physique régulière » permet de fortement réduire le risque de développer le diabète de type 2.
La supplémentation en vitamine D améliore un peu quelques paramètres biologiques associés à ce syndrome[59].
Espoirs de traitement nouveaux
On étudie notamment l'intérêt des composés suivants :
- certains acides gras polyinsaturés (omega-6) ; l'acide linoléique conjugué (ALC), acide gras essentiel de la chaîne des oméga-6 qui - chez l'animal - semble favoriser l'action cellulaire de l’insuline, réduire le taux de mauvais cholestérol et le tissu adipeux, mais les tests cliniques ne sont pas toujours concluants chez l'Homme[60] - [61], le traitement pouvant avoir quelques inconvénients et même en cas d’obésité abdominale accroître la résistance de ces patients à l’insuline[62].
- Extrait de cannelle. L'expérimentation animale laisse penser que cette épice peut réduire l’insulinorésistance[63] - [64].
Chez l'homme, une étude clinique sur 60 diabétiques de type 2 a montré que la cannelle (de 1 à 6 g/jour durant 40 jours) réduit la glycémie (de 18 % à 29 %), la cholestérolémie (de 12 % à 26 %) et la triglycéridémie (de 23 % à 30 %)[65].
Démence
Une première étude (via le suivi durant 4 ans de 7087 personnes de 65 ans et plus dans trois villes françaises) a cherché d'éventuelles associations entre le syndrome métabolique (et/ou ses composantes) et le risque de démence (vasculaire ou de type maladie d'Alzheimer). Les composantes étudiées étaient hypertension, embonpoint, triglycémie élevée, faible taux de cholestérol HDL, hyperglycémie à jeun. 15,8 % des sujets répondaient à la définition du MEts (définie selon NCEP ATP III) et ce METS était bien un facteur prédictif de risque de démence (vasculaire mais pas de type Alzheimer), indépendamment des caractéristiques socio-démographiques et génétiques (génotype de l'apolipoprotéine E pris en compte).
Une hypertriglycéridémie était significativement associée au risque de démence vasculaire.
Le diabète (mais non la glycémie à jeun), était significativement associée aux deux formes de démence (chez ces personnes âgées), ce qui montre l'importance des démarches de prévention en amont.
Critique et controverse
L’intérêt clinique d'un diagnostic de syndrome métabolique (plutôt que de diagnostiquer ses syndromes constituants) est remise en cause par plusieurs études, l'une parue notamment dans la revue The Lancet[66] ou même La revue Prescrire qui a publié un article en 2006[67]. Des associations de diabétiques ont identifié plusieurs critiques sur l'utilité clinique du syndrome métabolique[68].
Par ailleurs, le rimonabant (mis sur le marché sous la marque Acomplia), un médicament proposé par l'industrie pharmaceutique, poussé par une grande campagne de médiatisation le présentant comme capable de traiter le syndrome métabolique, a été rapidement retiré du marché pour causes d'effets secondaires trop importants : il induisait chez un nombre significatif de patient des effets psychiques de type dépression, voire suicide… qui ont concerné plus d’un millier de patients…[69]
Rien qu'en France, 220 000 patients ont été traités par ce médicament de à avant son interdiction, un an et demi après son autorisation de mise sur le marché (donnée alors qu'il avait été interdit aux Etats-Unis en raison de ses effets secondaires)[70].
Notes et références
- MSD Manuals - Troubles nutritionnels : Syndrome métabolique - Adrienne Youdim, MD, David Geffen School of Medicine at UCLA - août 2021 : « Le développement du syndrome métabolique dépend de la distribution ainsi que de la quantité de graisse. [...] L'excès de graisse abdominale induit un excès d'acides gras libres dans la veine porte, augmentant l'accumulation de lipides dans le foie et dans les cellules musculaires. Les cellules graisseuses peuvent également s'accumuler dans les muscles. Une insulino-résistance, se développe, avec une hyperinsulinémie. Le métabolisme du glucose est perturbé et une dyslipidémie et une HTA peuvent se développer. L'uricémie est fréquemment élevée (augmentant le risque de goutte) et un état préthrombotique se développe (avec augmentation du fibrinogène et de l'inhibiteur I de l'activateur du plasminogène) et un état inflammatoire se développe. »
- Étude prospective ayant porté sur 1 005 hommes finlandais suivis durant 4 ans (sur la base des critères OMS) ont un risque 7 fois plus élevé de développer un DT 2. Laaksonen et al. « Metabolic syndrome and development of diabetes mellitus: application (…) » Am. J. Epidemiol. 2002
- 13 études prospectives, 92 732 sujets, association entre présence du SMet et risque d’AVC : OR = 1,60 [1,48 – 1,75] (OR = 2,2 avec les critères OMS et 1,60 avec NCEP-ATPIII, pas de différence significative). Li et al. « Association between metabolic syndrome and risk of stroke: a meta-anlysis of cohort studies » Cerebrovasc Dis. 2008 Résumé
- Une étude transversale ayant porté sur 2 917 sujets, a montré que le SMET est significativement associé à un risque risque psychosocial (OR = 1,30 [1,12 – 1,52]). Vogelzangs N et al. « Psychosocial risk factors and the metabolic syndrome in elderly persons: findings from the Health, Aging and Body Composition study » J Gerontol A Biol Sci Med Sci. 2007
- (en) Yaffe. « MetS and cognitive decline: Is the sum greater than the parts? » Alzheimer Dis Assoc Disord. 2007
- (en) Raffaitin et al. « Metabolic syndrome and risk for incident Alzheimer’s disease or vascualr dementia: the Three-City study » Diabetes Care Résumé
- (en) Stephanie Cowey & Robert W. Hardy « The Metabolic Syndrome ; A High-Risk State for Cancer? » Am J Pathol. Novembre 2006 ; American Society for Investigative Pathology ; 169(5): 1505–1522. DOI 10.2353/ajpath.2006.051090 PMCID: PMC1780220 Résumé
- Reaven G ; Metabolic syndrome: pathophysiology and implications for management of cardiovascular disease. Circulation 106:286–288, 2002
- Étude ayant porté sur 185 adolescentes nord-américaines (moyenne d'âge : 14 ans) dont 18 % présentaient un SMet (Sarah Mamhi et al. Identifying Adolescent Metabolic Syndrome Using Body Mass Index and Waist Circumference, Prev Chronic Dis. Octobre 2008 ; 5(4): A115. online 2008 09 15. résumé de l'étude
- Third Report of the Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III), National Heart, Lung, and Blood Institute, National Institutes of Health. National Cholesterol Education Program, mai 2001. NHLBI
- Hu G, Qiao Q, et al; DECODE Study Group. Prevalence of the metabolic syndrome and its relation to all-cause and cardiovascular mortality in nondiabetic European men and women. Arch Intern Med. 24 mai 2004 ;164(10):1066-76
- « Zoom sur le syndrome métabolique », sur fedecardio.org (consulté le )
- Dallongeville et al. The association of metabolic disorders with the metabolic syndrome is different in men and women. Ann nutr Metab, 2004
- Dallongeville et al. The association of metabolic disorders with the metabolic syndrome is different in men and women. Ann nutr Metab, 2004
- Doelle, Gregory C. The clinical picture of metabolic syndrome. Postgraduate Medecine: Jul 2004, Jul;116(1):30-2, 35-8.
- page sur la microalbuminurie comme facteur de risque cardiovasculaire chez l'hypertendu notamment(consulté 2008 12 07]
- Parish JM; Adam T; Facchiano L. Relationship of metabolic syndrome and obstructive sleep apnea. J Clin Sleep Med 2007;3(5):467-472.)
- http://authoritynutrition.com/the-bitter-truth-about-fructose/
- http://authoritynutrition.com/leptin-101/
- Margetic S, Gazzola C, Pegg GG, Hill RA.Leptin: a review of its peripheral actions and interactions.Int J Obes Relat Metab Disord. 2002 Nov;26(11):1407-33.
- Margaret B Allison and Martin G Myers Jr. 20 YEARS OF LEPTIN: Connecting leptin signaling to biological function. Endocrinol October 1, 2014 223T25-T35 doi: 10.1530/JOE-14-0404J
- Considine RV, Sinha MK, Heiman ML, Kriauciunas A, Stephens TW, Nyce MR, Ohannesian JP, Marco CC, McKee LJ, Bauer TL, et al. Serum immunoreactive-leptin concentrations in normal-weight and obese humans. N Engl J Med. 1996 Feb 1;334(5):292-5.
- Spreadbury I. Comparison with ancestral diets suggests dense acellular carbohydrates promote an inflammatory microbiota, and may be the primary dietary cause of leptin resistance and obesity..Diabetes Metab Syndr Obes. 2012;5:175-89. doi: 10.2147/DMSO.S33473. Epub 2012 Jul 6.
- Richard J Johnson, Mark S Segal, Yuri Sautin, Takahiko Nakagawa, Daniel I Feig, Duk-Hee Kang, Michael S Gersch,Steven Benner, and Laura G Sánchez-Lozada. Potential role of sugar (fructose) in the epidemic of hypertension, obesity and the metabolic syndrome, diabetes, kidney disease, and cardiovascular disease. Am J Clin Nutr October 2007vol. 86 no. 4 899-906
- Silva FM, Steemburgo T, de Mello VD, Tonding SF, Gross JL, Azevedo MJ. High dietary glycemic index and low fiber content are associated with metabolic syndrome in patients with type 2 diabetes. J Am Coll Nutr. 2011 Apr;30(2):141-8.
- Jean Dallongeville et al; "The APOA5 Trp19 allele is associated with metabolic syndrome via its association with plasma triglycerides" ; BMC Med Genet. 2008; 9: 84. online 2008 09 12. doi:10.1186/1471-2350-9-84. PMCID: PMC2551592 Lire l'étude (en anglais)
- Finley CE, Barlow CE, Halton TL, Haskell WL.J. Glycemic index, glycemic load, and prevalence of the metabolic syndrome in the cooper center longitudinal study. Am Diet Assoc. 2010 Dec;110(12):1820-9. doi: 10.1016/j.jada.2010.09.016.
- Melissa E. Weinberg & al. Low Sex-Hormone Binding Globulin is Associated with the Metabolic Syndrome in Postmenopausal Women, Metabolism. 1er nov 2007 ; 55(11): 1473–1480. doi: 10.1016/j.metabol.2006.06.017. PMCID: PMC1633722 / NIHMSID: NIHMS12173
- page sur le syndrome métabolique de la revue Esculape
- Tinkov A.A, Skalnaya M.G, Aaseth J, Ajsuvakova O.P, Aschner M & Skalny A.V (2019) Aluminium levels in hair and urine are associated with overweight and obesity in a non-occupationally exposed population. Journal of Trace Elements in Medicine and Biology, 56, 139-145 (https://www.sciencedirect.com/science/article/pii/S0946672X19302548 résumé).
- étude dite « Japan Public Health Center-Based Prospective Study » conduite par le Pr Shoichiro Tsugane du Centre National du cancer).
- Brève intitulée Influence des composantes du syndrome métabolique sur la mortalité (BE Japon 501 de l'ambassade de France au Japon, datée du 2009 05 18)
- Site de l'étude JPHC; en japonais
- Cameron et al. The metabolic syndrome: prevalence in worldwide populations. Endocrinol Metab Clin North Am, 2004
- Genuth S et al. Expert Committee on the Diagnosis and Classification of Diabetes Mellitus: follow-up report on the diagnosis of diabetes mellitus. Diabetes Care 26:3160–3167, 2003
- Grundy SM et al. : Definition of metabolic syndrome: report of the National Heart, Lung, and Blood Institute/American Heart Association conference on scientific issues related to definition. Circulation 109:433–438, 2004
- Lorenzo et al. The prevalence of the metabolic syndrome did not increase in Mexico City between 1990-1992 and 1997-1999 despite more central obesity. Diabetes Care, 2005
- J Smith, « Whistleblowers, Threats, and Bribes: A Short History of Genetically Engineered Bovine Growth Hormone », Council for Responsible Genetics, (consulté le )
- Ford et al. Increasing prevalence of the metabolic syndrome among US adults. Diabetes Care, NHANES, 2004 Lire l'article (pdf) (consulté 2008 12 07)
- Étude faite sur la base de critères NCEP ATP III adaptés, faute de définition standardisée en pédiatrie, pour 1960 personnes de 12 ans et plus, suivies de 1988 à 1994 ; selon Ferranti et al. Prevalence of the metabolic syndrome in American adolescents: findings from the Third National health and Nutrition Examination Survey. Circulation, 2004
- Deen, Darwen. Metabolic Syndrome: Time for Action. Am Fam Physician 2004;69:2875-82,2887-8
- Ford et al. Prevalence of the metabolic syndrome among US adults: findings from the third National Health and Nutrition Examination Survey. JAMA, 2002
- Mcneill et al. Metabolic syndrome and cardiovascular disease in older people : the cardiovascular health study. J Am Geratr Soc, 2006
- Gause-Nilsson et al. Prevalence of metabolic syndrome in an elderly Swedish population. Acta diabetol, 2006
- Hu G, Qiao Q, et al; DECODE Study Group. Prevalence of the metabolic syndrome and its relation to all-cause and cardiovascular mortality in nondiabetic European men and women. Arch Intern Med. 24 mai 2004 ;164(10):1066-76
- Lambert M, Paradis G, et al. Insulin resistance syndrome in a representative sample of children and adolescents from Quebec, Canada. Int J Obes Relat Metab Disord. 2004 Jul;28(7):833-41.
- Voir graphique de la page 5 de la Présentation de Christelle Raffaitin (déjà citée)
- Présentation du Dr Robert Lustig, "Sugar the bitter truth"
- Esposito K, Pontillo A, et al. Effect of weight loss and lifestyle changes on vascular inflammatory markers in obese women: a randomized trial. JAMA. 2003 Apr 9;289(14):1799-804
- H. von Bibraa,G. Wulfb, M. St John Suttonc, A. Pfütznerd,T. Schustere,P. Heilmeyerb. Low-carbohydrate/high-protein diet improves diastolic cardiac function and the metabolic syndrome in overweight-obese patients with type 2 diabetes. IJC Metabolic & Endocrine Volume 2, March 2014, Pages 11–18.
- Esposito K, Marfella R, et al. Effects of a mediterranenan-style diet on endothelial dysfunction and markers of vascular inflammation in the metabolic syndrome: a randomized trial. JAMA. 2004 Sep 22;292(12):1440-6
- http://authoritynutrition.com/can-low-carb-cure-health-problems/
- David C. Klonoff, M.D., FACPThe Beneficial Effects of a Paleolithic Diet on Type 2 Diabetes and Other Risk Factors for Cardiovascular Disease.J Diabetes Sci Technol. Nov 2009; 3(6): 1229–1232.Published online Nov 2009. PMCID: PMC2787021
- Tuomilehto J, Lindstrom J, et al.; Prevention of type 2 diabetes mellitus by changes in lifestyle among subjects with impaired glucose tolerance. Finnish Diabetes Prevention Study Group. N Engl J Med. 3 mai 2001 ;344(18):1343-50
- l Knowler WC, Barrett-Connor E, et al; Reduction in the incidence of type 2 diabetes with lifestyle intervention or metformin. Diabetes Prevention Program Research Group. N Engl J Med. 2002 Feb 7;346(6):393-403)
- Pan XR, Li GW, et al. Effects of diet and exercise in preventing NIDDM in people with impaired glucose tolerance. The Da Qing IGT and Diabetes Study. Diabetes Care. 1997 Apr;20(4):537-44.
- Reaven, Peter. Metabolic Syndrome. J Insur Med 2004;36:132-42.
- Stone, Neil J. Focus on lifestyle change and the metabolic syndrome. Endocrinol Metab Clin North Am. 2004 Sep;33(3):493-508, v-vi. Review.
- Kai-Jie Qi, Zhong-Tao Zhao, Wen Zhang et Fang Yang, « The impacts of vitamin D supplementation in adults with metabolic syndrome: A systematic review and meta-analysis of randomized controlled trials », Frontiers in Pharmacology, vol. 13, , p. 1033026 (ISSN 1663-9812, PMID 36278155, PMCID 9581173, DOI 10.3389/fphar.2022.1033026, lire en ligne, consulté le )
- Riserus U, Berglund L, Vessby B. Conjugated linoleic acid (CLA) reduced abdominal adipose tissue in obese middle-aged men with signs of the metabolic syndrome: a randomised controlled trial. Int J Obes Relat Metab Disord. 2001 Aug;25(8):1129-35
- Lamarche B, Desroches S. Metabolic syndrome and effects of conjugated linoleic acid in obesity and lipoprotein disorders: the Quebec experience. Am J Clin Nutr. 2004 Jun;79(6 Suppl):1149S-1152S. Review.
- Riserus U, Basu S, et al. Supplementation with conjugated linoleic acid causes isomer-dependent oxidative stress and elevated C-reactive protein: a potential link to fatty acid-induced insulin resistance. Circulation. 2002 Oct 8;106(15):1925-9
- Qin B, Nagasaki M, et al. Cinnamon extract prevents the insulin resistance induced by a high-fructose diet. Horm Metab Res. 2004 Feb;36(2):119-25.
- Qin B, Nagasaki M, et al. Cinnamon extract (traditional herb) potentiates in vivo insulin-regulated glucose utilization via enhancing insulin signaling in rats.Diabetes Res Clin Pract. 2003 Dec;62(3):139
- Khan A, Safdar M, et al. Cinnamon improves glucose and lipids of people with type 2 diabetes. Diabetes Care. 2003 Dec;26(12):3215-8.
- (en) Richard Kahn, « Metabolic syndrome—what is the clinical usefulness? », Lancet, vol. 371, no 9628, , p. 1892–1893 (DOI 10.1016/S0140-6736(08)60731-X)
- http://www.prescrire.org/Fr/3/31/23728/0/2006/ArchiveNewsDetails.aspx?page=4
- (en) Kahn R, Buse J, Ferrannini E, Stern M, « The metabolic syndrome: time for a critical appraisal. Joint statement from the American Diabetes Association and the European Association for the Study of Diabetes », Diabetes Care, vol. 28, no 9, , p. 2289–2304 (PMID 16123508, DOI 10.2337/diacare.28.9.2289)
- Stéphane Olivesi (2013), « L’information sous influence scientifique », Revue française des sciences de l’information et de la communication En ligne, 3 | mis en ligne le 01 août 2013, consulté le 30 novembre 2019. URL=http://journals.openedition.org/rfsic/594 ; DOI : 10.4000/rfsic.594
- (en) « Rimonabant - Mieux vaut tard que jamais », Que Choisir,
Voir aussi
Articles connexes
Liens externes
- , le site de l'obésité abdominale et du syndrome métabolique
- Épidémiologie du syndrome métabolique, par Christelle Raffaitin du CHU de Bordeaux, INSERM U897, séminaire Recherche et pratique en santé publique 2008 11 06, ISPED
- Site d’information sur les traitements, complications, prévention et études cliniques liés au diabète et à l’insulino-résistance.
- Régime DASH (régime diététique proposé par les National Institutes of Health américains pour diminuer l’hypertension, et conseillé contre le syndrome métabolique car pauvre en gras, sucres rapides et riche en fibres.
- American Diabetes Association Dossier « The Metabolic Syndrome »
- American Heart Association. « Metabolic Syndrome »
- Family Doctor « Insulin Resistance Syndrome »
- Health and Age. Syndrome X – Again!
- National Center for Chronic Disease Prevention and Health Promotion, National Diabetes Fact Sheet