Aromatase
L’aromatase est une glycoprotéine ayant fonction d'enzyme et il s'agit plus exactement d'un « complexe enzymatique » microsomial associant le cytochrome P450 aromatase (P450arom) et d'une réductase ubiquitaire. Ce complexe enzymatique est responsable de la biosynthèse des œstrogènes hormones fondamentales pour la physiologie du développement et de la reproduction, mais semble aussi en cause dans la genèse de certains cancers dits estrogéno-dépendants.
L'aromatase fait partie de la superfamille du cytochrome P450, dont la fonction est d'aromatiser les androgènes et ainsi produire des œstrogènes.
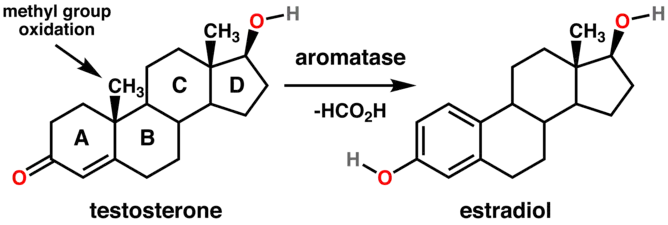
Les stéroïdes sont composés de 4 cycles (nommés de A à D sur la figure ci-dessous). L'aromatase transforme le cycle situé le plus à gauche (le cycle noté A) du stéroïde en cycle aromatique (d'où le nom d'aromatase), par le biais d'une oxydation et de la perte d'un groupement méthyle.
Fonction
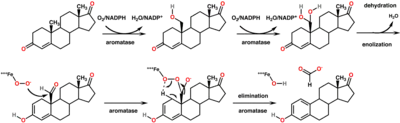
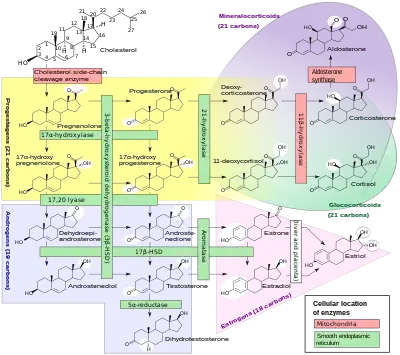
La principale activité de cette enzyme est de transformer l'Androstènedione en estrone et la testostérone en estradiol.
Le gène correspondant code une partie de la superfamille d'enzymes du cytochrome P450. Les protéines du cytochrome P450 sont des mono-oxygénases qui catalysent de nombreuses réactions impliquées dans le métabolisme des drogues et la synthèse du cholestérol, des stéroïdes, et d'autres lipides. Cette protéine se situe au niveau du réticulum endoplasmique et catalyse les dernières étapes de la biosynthèse des androgènes en œstrogènes. Ces étapes sont constituées de trois hydroxylations successives du groupement méthyle de l'androgène situé en position 19 suivies par l'élimination du groupement méthyle en acide méthanoïque ainsi que l'aromatisation du cycle A. Des mutations au niveau de ce gène peuvent avoir pour conséquence une augmentation ou une diminution de l'activité de l'aromatase; les phénotypes associés suggèrent que les œstrogènes ont tant une fonction d'hormone stéroïdienne sexuelle qu'une fonction dans la croissance ou la différenciation.
Elle semble participer au processus de développement de certains cancers. En effet l'aromatase est retrouvée au sein de tumeurs et à leur proximité (dans 60 à 70 % des cas e cancers du sein par exemple), et dans d'autres cancers hormone-dépendants ; elle pourrait notamment participer à leur croissance chez la femme ménopausée. Inhiber ce « complexe enzymatique »au moyen de molécules stéroïdiennes ayant une forte affinité chimique pour lui, telles que le formestane ou l'exémestane (irréversibles) et/ou non-stéroïdiennes tels que le létrozole ou l'anastrozole (réversibles) pourrait donc être un moyen de freiner ce type de cancer[2].
Génomique
Le gène CYP19, localisé sur le chromosome 15q21.1 code chez l'homme l'enzyme aromatase[3]. Les œstrogènes peuvent être synthétisés dans d'autres organismes, mais par des mécanismes encore inconnus.
Localisation dans les cellules et les tissus
Le complexe enzymatique aromatase est ubiquitaire. On le retrouve dans le réticulum endoplasmique de la cellule, et son activité est régulée par des promoteurs spécifiques aux tissus, qui sont à leur tour contrôlés par des hormones et d'autres facteurs.
L'aromatase peut être trouvée dans de nombreux tissus comme les gonades[4], le cerveau, le tissu adipeux, le placenta, les vaisseaux sanguins, la peau, les os, la muqueuse utérine ainsi que dans les tissus de l'endométriose, du léiomyome utérin, du cancer du sein et du cancer de l'endomètre.
De manière un peu surprenante de l'aromatase fonctionnelle est aussi présent dans les gonades mâles ( testicules, chez l'homme comme chez l'animal, mais pas toujours dans les mêmes cellules ; on retrouve cette enzyme dans les cellules de Sertoli chez l'homme. Elle transformerait la testostérone synthétisée par les cellules de Leydig en estrogènes, indispensable (meme si en quantité très faible par rapport aux femmes) à une spermatogénèse de bonne qualitée.
Activité
Plusieurs facteurs sont connus pour augmenter l'activité de l'aromatase ; ce sont l'âge, l'obésité, l'insuline, les gonadotropines et l'alcool[5].
Inversement l'activité de l'aromatase est diminuée par des inhibiteurs tels que la prolactine, les hormones antimullériennes, la consommation de tabac et l'herbicide glyphosate[6].
L'activité de l'aromatase est améliorée au niveau de certains tissus dépendants aux œstrogènes, comme ceux proches des tissus du sein, du cancer de l'endomètre, de l'endométriose et du léiomyome utérin. Le dosage du relâchement de l'eau tritiée est une technique utilisée afin de mesurer l'activité de l'aromatase, mise au point par Thompson et Siiteri.
Troubles
Hyperactivité
Un certain nombre de chercheurs ont établi un rapport sur un syndrome plutôt rare d'excès de l'activité de l'aromatase. Chez les garçons, ce syndrome peut mener à une gynécomastie et chez les filles à une puberté précoce ou à une gigantomastie.
Déficience
Ce syndrome est dû à une mutation du gène CYP19. L'accumulation d'androgènes durant la grossesse peut entraîner une virilisation des filles à la naissance (les garçons ne sont pas affectés). Les filles auront des aménorrhées primaires.
Mutation de l'aromatase
Un homme présentant une mutation de l'aromatase est quasiment stérile et n'arrête pas sa croissance car ses cartilages de conjugaison ne sont pas soudés.
Inhibiteurs de l'aromatase
Naturels
Médicaments
L'inhibition de l'enzyme mène à un grand hypoestrogénisme (un faible taux d'œstrogènes). Néanmoins, ces inhibiteurs à aromatase sont utiles pour le traitement des patients souffrant de cancer du sein dont les lésions se sont avérées être réceptrices aux œstrogènes. Un exemple de substance inhibitrice est le létrozole, autrefois vendu sous le nom de 'Femara'. Les inhibiteurs de l'aromatase commencent à être prescrits aux hommes dans le cadre d'une thérapie de remplacement de la testostérone de façon à maintenir un niveau constant d'œstrogènes, pour ne pas avoir de pic de sécrétion d'œstrogènes lorsque des doses de testostérones sont introduites dans leurs organismes.
Articles connexes
Notes et références
- (en) Vaz ADN, chap. 1 « Cytochrome activation by cytochromes P450: a role for multiple oxidants in the oxidation of substrates », dans Michael Fisher, Jae Kyu Lee et Robert E. Obach, Drug metabolizing enzymes: cytochrome P450 and other enzymes in drug discovery and development, Lausanne, Suisse, FontisMedia SA, (ISBN 0-8247-4293-1)
- Auvray P, Bichat F & Genne P (2000) Evaluation préclinique de l'activité antitumorale des inhibiteurs de l'aromatase. Bulletin du cancer, 87(12), 7-22.| résumé
- (en) K Toda et Y Shizuta, « Molecular cloning of a cDNA showing alternative splicing of the 5'-untranslated sequence of mRNA for human aromatase P-450 », Eur. J. Biochem., vol. 213, no 1, , p. 383–9 (PMID 8477708, DOI 10.1111/j.1432-1033.1993.tb17772.x)
- Carreau S & Levallet J (1997) Activité aromatase dans les cellules germinales mâles: quelle signification fonctionnelle ?. Andrologie, 7(3), 305.
- (en) Aatif Hussain et Jacques Gilloteaux, « The human testes: Estrogen and ageing outlooks », Translational Research in Anatomy, vol. 20, , p. 100073 (ISSN 2214-854X, DOI 10.1016/j.tria.2020.100073, lire en ligne, consulté le )
- (en) C. Gasnier, C. Dumont, W. Benachour, E. Clair, M. C. Chagnon et G. E. Séralini, « Glyphosate-based herbicides are toxic and endocrine disruptors in human cell lines », Toxicology, vol. 262, no 3, , p. 184–91 (PMID 19539684, DOI 10.1016/j.tox.2009.06.006).
- Balunas MJ, Su B, Brueggemeier RW, Kinghorn AD, « Natural products as aromatase inhibitors », Anti-Cancer Agents in Medicinal Chemistry, vol. 8, no 6, , p. 646–82 (PMID 18690828, PMCID 3074486, DOI 10.2174/1871520610808060646)
- Satoh K, Sakamoto Y, Ogata A, Nagai F, Mikuriya H, Numazawa M, Yamada K, Aoki N, « Inhibition of aromatase activity by green tea extract catechins and their endocrinological effects of oral administration in rats », Food and Chemical Toxicology, vol. 40, no 7, , p. 925–33 (PMID 12065214, DOI 10.1016/S0278-6915(02)00066-2)
- Kapiszewska M, Miskiewicz M, Ellison PT, Thune I, Jasienska G, « High tea consumption diminishes salivary 17beta-estradiol concentration in Polish women », The British Journal of Nutrition, vol. 95, no 5, , p. 989–95 (PMID 16611391, DOI 10.1079/BJN20061755)
- Le Bail JC, Pouget C, Fagnere C, Basly JP, Chulia AJ, Habrioux G, « Chalcones are potent inhibitors of aromatase and 17beta-hydroxysteroid dehydrogenase activities », Life Sciences, vol. 68, no 7, , p. 751–61 (PMID 11205867, DOI 10.1016/S0024-3205(00)00974-7)
- Doering IL, Richter E, « Inhibition of human aromatase by myosmine », Drug Metabolism Letters, vol. 3, no 2, , p. 83–6 (PMID 19601869, DOI 10.2174/187231209788654045)
- Biegon A, Kim SW, Logan J, Hooker JM, Muench L, Fowler JS, « Nicotine blocks brain estrogen synthase (aromatase): in vivo positron emission tomography studies in female baboons », Biological Psychiatry, vol. 67, no 8, , p. 774–7 (PMID 20188349, PMCID 2904480, DOI 10.1016/j.biopsych.2010.01.004)
- Wang Y, Lee KW, Chan FL, Chen S, Leung LK, « The red wine polyphenol resveratrol displays bilevel inhibition on aromatase in breast cancer cells », Toxicological Sciences, vol. 92, no 1, , p. 71–7 (PMID 16611627, DOI 10.1093/toxsci/kfj190)
- Siler U, Barella L, Spitzer V, Schnorr J, Lein M, Goralczyk R, Wertz K, « Lycopene and vitamin E interfere with autocrine/paracrine loops in the Dunning prostate cancer model », FASEB Journal, vol. 18, no 9, , p. 1019–21 (PMID 15084515, DOI 10.1096/fj.03-1116fje)
- Om AS, Chung KW, « Dietary zinc deficiency alters 5 alpha-reduction and aromatization of testosterone and androgen and estrogen receptors in rat liver », The Journal of Nutrition, vol. 126, no 4, , p. 842–8 (PMID 8613886, lire en ligne)
- Ye L, Chan FL, Chen S, Leung LK, « The citrus flavonone hesperetin inhibits growth of aromatase-expressing MCF-7 tumor in ovariectomized athymic mice », The Journal of Nutritional Biochemistry, vol. 23, no 10, , p. 1230–7 (PMID 22209285, DOI 10.1016/j.jnutbio.2011.07.003)