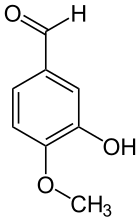
Isovanilline
L'isovanilline est un composé aromatique de formule C8H8O3. Elle est constituée d'un cycle de benzène substitué par un groupe aldéhyde, un groupe méthoxyle (-OCH3) et un groupe hydroxyle. Comme son nom l'indique, c'est un isomère de la vanilline, dont elle ne diffère que par l'inversion de position des groupes hydroxyle et méthoxyle. Elle fait ainsi partie du groupe des isovanilloïdes, les composés isomères des vanilloïdes. C'est un composé utilisé en synthèse dans les industries cosmétique, agroalimentaire et pharmaceutique.
| Isovanilline | |
| |
| Identification | |
|---|---|
| Synonymes |
3-hydroxy-4-méthoxybenzaldéhyde |
| No CAS | |
| No ECHA | 100.009.724 |
| No CE | 210-694-9 |
| No RTECS | CU6540000 |
| PubChem | 12127 |
| SMILES | |
| InChI | |
| Apparence | poudre marron clair[1] |
| Propriétés chimiques | |
| Formule | C8H8O3 [Isomères] |
| Masse molaire[2] | 152,147 3 ± 0,007 9 g/mol C 63,15 %, H 5,3 %, O 31,55 %, |
| pKa | 8,89 à 25 °C[3] |
| Propriétés physiques | |
| T° fusion | 113 à 115 °C[1] |
| T° ébullition | 179 °C (15 mmHg)[1] |
| Cristallographie | |
| Système cristallin | monoclinique[4] |
| Classe cristalline ou groupe d’espace | (no 14) [4] |
| Précautions | |
| SGH[1] | |
 |
|
| Écotoxicologie | |
| DL50 | 1 470 mg·kg-1 (chien, i.v.)[5] 1 276 mg·kg-1 (rat, i.p.)[6] |
| LogP | 0,97[7] |
| Unités du SI et CNTP, sauf indication contraire. | |
Occurrence naturelle

L'isovanilline a été isolée et caractérisée en 1882 par Rudolf Wegscheider[8], un chimiste autrichien. Elle est notamment présente dans le manioc[9] et Mondia whitei[10] - [11].
Propriétés
L'isovanilline se présente sous la forme d'une poudre marron clair, qui fond vers 113–115 °C[1] et bout vers 179 °C à pression réduite (20 hPa)[1]. Elle est légèrement soluble dans l'eau chaude mais quasiment insoluble dans l'eau froide ; elle est soluble dans le chloroforme, l'éthanol, l'éther, le méthanol et l'acide acétique glacial[8]. Elle cristallise dans le système monoclinique et le groupe d'espace P21/a (no = 14), de paramètres a = 851,7 pm, b = 1338,0 pm, c = 639,0 pm, β = 97,21° avec quatre unités par maille[4].
L'isovanilline dérive structurellement du benzaldéhyde et du gaïacol. C'est un isomère de position de la vanilline où les groupes méthoxyle et hydroxyle sont inversés. Contrairement à la vanilline, l'isovanilline est quasiment inodore[12].
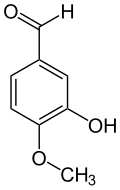
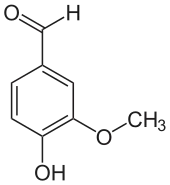
Isovanilline Vanilline
Elle est soluble dans une solution de chlorure de fer(III) mais ne forme aucune couleur[8]. Le pKA de son groupe phénol est de 8,89 (25 °C)[3], plus faible que celle du phénol (9,99[3]). Cela s'explique par l'effet -M du groupe aldéhyde qui stabilise légèrement la forme déprotonée.
L'isovanilline est un inhibiteur sélectif de l'aldéhyde oxydase. Ce n'est pas un substrat de cette enzyme et elle est métabolisée en acide isovanillique par l'aldéhyde déshydrogénase[13] - [14] - [15] - [16] - [17].
Extraction et synthèse
Extraction de l'isovanilline naturelle
L'isovanilline peut être extraite par divers solvants mais aussi par entraînement à la vapeur à partie des racines séchées de Mondia whitei[10] - [11] - [18].
Synthèse
Il existe de nombreuses méthodes de synthèse de l'isovanilline[19] :
- Réaction de l'héliotropine (1,3-benzodioxole-5-carbaldéhyde) avec l'éthanolate de sodium en présence de chlorure de cuivre(I) dans le diméthylformamide[20] ;
- Déméthylation sélective du vératraldéhyde (3,4-diméthoxybenzaldéhyde) par la méthionine dans l'acide méthylsulfonique[21]. La réaction est lente, et la sélectivité est faible.
- L'O-méthylation sélective du protocatéchualdéhyde (3,4-dihydroxybenzaldéhyde) par l'iodométhane en présence d'hydrure de sodium dans le diméthylsulfoxyde a un rendement d'environ 65 %[22].
- Formylation du gaïacol (o-méthoxyphénol), protégé sous forme d'acétate, par le dichloro(méthoxy)méthane en présence de tétrachlorure de titane dans le dichlorométhane. Le 3-acétoxy-4-méthoxybenzaldéhyde est ensuite hydrolysé par l'hydroxyde de sodium[23].
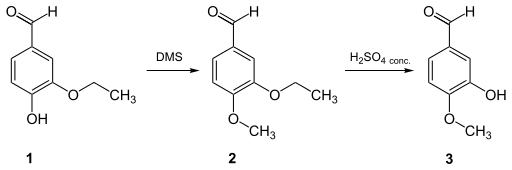
- L'isovanilline peut être obtenue avec de bons rendements par clivage sélectif d'un 3-alcoxy-4-méthoxybenzaldéhyde par action d'un acide fort sur le groupe alkyle en position 3 ; le groupe alcoxyle doit comporter au moins deux atomes de carbone. Il est par exemple possible de partir de l'éthylvanilline (1), qui est alors méthylée par le sulfate de diméthyle (DMS) pour former le 3-éthoxy-4-méthoxybenzaldéhyde (2), qui est ensuite clivé sélectivement par l'acide sulfurique en isovanilline (3)[19] :
Utilisations
L'isovanilline est utilisée comme « bloc de construction » pour la synthèse d'autres composés dans les industries pharmaceutique, cosmétique et agroalimentaire[19] - [24] - [25] - [26]. L'isovanilline est par exemple un précurseur dans la synthèse totale de la morphine[27] - [28].
Dérivés structurels
L'alcool isovanillique (3-hydroxy-4-méthoxybenzylalcool) est produit par réduction de l'isovanilline. L'acide isovanillique (acide 3-hydroxy-4-méthoxybenzoïque) est produit par oxydation, par exemple par voie enzymatique[17].
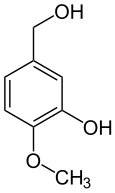

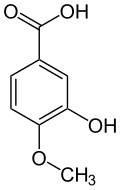
Alcool isovanillique Isovanilline Acide isovanillique
L'isoéthylvanilline (3-hydroxy-4-éthoxybenzaldéhyde) est un dérivé structurel de l'isovanilline, obtenu en remplaçant le groupe méthyle par un groupe éthyle. La relation entre les deux composés est analogue à celle entre la vanilline et l'éthylvanilline.
L'isoacétovanillone (3-hydroxy-4-méthoxyacetophénone) est similaire à l'isovanilline, en remplaçant le groupe aldéhyde par un groupe acétyle. La relation entre les deux composés est analogue à celle entre la vanilline et l'acétovanillone (apocynine).
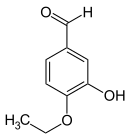

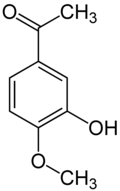
Isoéthylvanilline Isovanilline Isoacétovanillone
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Isovanillin » (voir la liste des auteurs).
- Fiche Sigma-Aldrich du composé 3-Hydroxy-4-methoxybenzaldehyde, consultée le 15 mai 2019.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, (ISBN 0-8493-0303-6), p. 434, no 54.
- (en) Fujiko Iwasaki, « The Crystal Structure of 3-Hydroxy-4-methoxybenzaldehyde (Isovanillin) », Chemistry Letters, vol. 2 (3), , p. 227–228 (DOI 10.1246/cl.1973.227)
- Caujolle F., Gout R., Meynier D., « Choleretic activity of isovanillin and ethylisovanillin in dogs », Annales Pharmaceutiques Francaises, vol. 14, , p. 456 (PMID 13382059)
- Comptes-rendus hebdomadaires des séances, Académie des Sciences. Vol. 243, Pg. 609, 1956.
- Fiche (en) « Isovanilline », sur ChemIDplus, consulté le 15 mai 2019.
- (de) Rudolf Wegscheider, « Über Isovanillin », Monatshefte für Chemie, vol. 3 (1), , p. 789–795 (DOI 10.1007/BF01516846)
- (en) Bo Yi, Lifei Hu, Wenli Mei, Kaibing Zhou, Hui Wang, Ying Luo, Xiaoyi Wei, Haofu Dai, « Antioxidant Phenolic Compounds of Cassava (Manihot esculenta) from Hainan », Molecules, vol. 16, , p. 10157–10167 (DOI 10.3390/molecules161210157)
- (en) Neil A. Koorbanally, Dulcie A. Mulholland, Neil R. Crouch, « Isolation of Isovanillin from Aromatic Roots of the Medicinal African Liane, Mondia whitei », Journal of Herbs, Spices & Medicinal Plants, vol. 7 (3), , p. 37–43 (DOI 10.1300/J044v07n03_05)
- (en) Kavaka W. Mukonyi, Isaiah O. Ndiege, « 2-Hydroxy-4-methoxybenzaldehyde: Aromatic Taste Modifying Compound from Mondia whytei Skeels », Bull. Chem. Soc. Ethiop., vol. +15 (2), , p. 137–141
- (en) Toru Egawa, Akiyo Kameyama, Hiroshi Takeuchi, « Structural determination of vanillin, isovanillin and ethylvanillin by means of gas electron diffraction and theoretical calculations », Journal of Molecular Structure, vol. 794 (1–3), , p. 92–102 (DOI 10.1016/j.molstruc.2006.01.042)
- (en) Georgios I. Panoutsopoulos, Christine Beedham, « Enzymatic oxidation of phthalazine with guinea pig liver aldehyde oxidase and liver slices: inhibition by isovanillin », Acta Biochimica Polonica, vol. 51 (4), , p. 943–951 (PMID 15625566)
- (en) Georgios I. Panoutsopoulos, Demetrios Kouretas, Christine Beedham, « Contribution of Aldehyde Oxidase, Xanthine Oxidase, and Aldehyde Dehydrogenase on the Oxidation of Aromatic Aldehydes », Chemical Research in Toxicology, vol. 17 (10), , p. 1368–1376 (PMID 1548789, DOI 10.1021/tx030059u)
- (en) Georgios I. Panoutsopoulos, « Phenylacetaldehyde oxidation by freshly prepared and cryopreserved guinea pig liver slices: the role of aldehyde oxidase », International Journal of Toxicology, vol. 24 (2), , p. 103–109 (PMID 16036769, DOI 10.1080/1091581059093637)
- (en) Georgios I. Panoutsopoulos, Christine Beedham, « Metabolism of isovanillin by aldehyde oxidase, xanthine oxidase, aldehyde dehydrogenase and liver slices », Pharmacology, vol. 73 (4), , p. 199–208 (PMID 15627845, DOI 10.1159/000082860)
- (en) Georgios I. Panoutsopoulos, Christine Beedham, « Enzymatic Oxidation of Vanillin, Isovanillin and Protocatechuic Aldehyde with Freshly Prepared Guinea Pig Liver Slices », Cell Physiol Biochem, vol. 15 (1–4), , p. 89–98 (PMID 15665519)
- Patent DE102009046126: Orally consumable preparation, useful e.g. in cosmetic preparation e.g. lipstick and as baked goods, comprises naturally occurring sweet-tasting substances and a root extract of Mondia whitei containing 2-hydroxy-4-methoxybenzaldehydei.
- Patentschriften: PatentDE: Verfahren zur Herstellung von Isovanillin; United States Patent 5648552: Process for the preparation of isovanillin.
- N. Yu. Baratov, V. I. Vinogradova, M. S. Yunusov, « Reaction of 3,4-methylenedioxybenzaldehydes with sodium methoxide », Zh. Org. Khim., vol. 27 (7), , p. 1578–1579
- Nobutaka Fujii, Hiroshi Irie, Haruaki Yajima, « Regioselective Cleavage of Aromatic Methyl Ethers by Methanesulphonic Acid in the Presence of Methionine », J. Chem. Soc., Perkin Trans. 1, vol. 20, , p. 2288–2288 (DOI 10.1039/P19770002288)
- Satinder V. Kessar, Yash P. Gupta, Taj Mohammed, (Miss) Manju Goyal, Kewal K. Sawal, « Regioselective Mono-O-alkylation of some Pyrocatechoxide Dianions », J. Chem. Soc., Chem. Commun., vol. 7, , p. 400–401 (DOI 10.1039/C39830000400)
- (en) Maria Luisa Scarpati, Armandodoriano Bianco, Livia Mascitelli, Pietro Passacantilli, « Selective Formylation of Diphenols », Synth. Commun., vol. 20 (17), , p. 2565–2572 (DOI 10.1080/00397919008051462)
- (en) Keng-Shiang Huang, Eng-Chi Wang, « Synthesis of Substituted Indenes from Isovanillin via Claisen Rearrangement and Ring-closing Metathesis », Journal of the Chinese Chemical Society, vol. 51, , p. 383–39 (DOI 10.1002/jccs.200400060)
- (en) Sie-Rong Li, Chung-Jung Shu, Liang-Yeu Chen, Hsing-Ming Chen, Po-Yuan Chen, Eng-Chi Wang, « Synthesis of substituted 2-aroyl-3-methylchromen-4-ones from isovanillin via 2-aroyl-3-methylchroman intermediate », Tetrahedron, vol. 65 (42), , p. 8702–8707 (DOI 10.1016/j.tet.2009.08.04)
- (en) Roger M. Davey, N. Patrick J. Stamford, « Catalytic enamines from dialkylamide-dialkylacetals », Tetrahedron Letters, vol. 53 (20), , p. 2537–2539 (DOI 10.1016/j.tetlet.2012.03.028)
- Uchida, Kenji, Yokoshima, Satoshi, Kan, Toshiyuki et Fukuyama, Tohru, « Total Synthesis of (±)-Morphine », Organic Letters, vol. 8, no 23, , p. 5311–5313 (PMID 17078705, DOI 10.1021/ol062112m)
- Uchida, Kenji, Yokoshima, Satoshi, Kan, Toshiyuki et Fukuyama, Tohru, « Total Synthesis of (±)-Morphine », HeteroCycles, vol. 77, no 2, , p. 1219–1234 (DOI 10.3987/COM-08-S(F)103, lire en ligne, consulté le )