Hydroxyprogestérone caproate
Le caproate d'hydroxyprogestérone (OHPC), vendu sous les noms de marque Proluton et Makena entre autres, est un médicament progestatif utilisé pour prévenir l'accouchement prématuré chez les femmes enceintes ayant des antécédents de la maladie et pour traiter les troubles gynécologiques[1] - [2] - [3] - [4] - [5]. Il a également été formulé en association avec des œstrogènes pour diverses indications (noms de marque Gravibinon et Primosiston) et sous forme de contraceptif injectable de longue durée (nom de marque Chinese Injectable No. 1 )[6]. Il n'est pas utilisé par voie orale et est plutôt administré par injection dans le muscle ou la graisse, généralement une fois par semaine à une fois par mois selon l'indication[7].
| Hydroxyprogestérone caproate | |
| |
| Données pharmacocinétiques | |
|---|---|
| Excrétion | |
| Identification | |
| No CAS | |
| No ECHA | 100.010.127 |
| DrugBank | 06789 |
L'OHPC est généralement bien toléré et produit peu d'effets secondaires[1]. Les réactions au site d'injection telles que la douleur et l'enflure sont l'effet secondaire le plus courant de l'OHPC. Le médicament peut augmenter le risque de diabète gestationnel lorsqu'il est utilisé chez la femme enceinte[8]. OHPC est un progestatif, ou un progestatif synthétique, et est donc un agoniste du récepteur de la progestérone, la cible biologique des progestatifs comme la progestérone. Il a une certaine activité antiminéralocorticoïde et aucune autre activité hormonale importante[9] - [10] - [11] - [12] - [13]. Le médicament présente un certain nombre de différences par rapport à la progestérone naturelle[14].
L'OHPC a été découvert en 1953 et a été introduit à des fins médicales en 1954 ou 1955[15]. Il a été commercialisé aux États-Unis sous le nom de marque Delalutin et dans toute l'Europe sous le nom de marque Proluton[16]. Le médicament a été arrêté aux États-Unis en 1999[17]. Cependant, l'OHPC a ensuite été réintroduit aux États-Unis sous le nom de marque Makena pour le traitement des naissances prématurées en 2011[18]. En raison d'un prix considérablement augmenté, une controverse sur les prix s'est produite dans ce pays. L'OHPC était auparavant disponible à bas prix dans les pharmacies de préparation aux États-Unis, mais cela a été interdit en 2016[19] - [20] - [21].
Utilisations médicales
Naissance prématurée
L'utilisation de l'OHPC pendant la grossesse pour prévenir l'accouchement prématuré chez les femmes ayant des antécédents d'accouchements prématurés entre 20 semaines et 36 semaines et 6 jours est soutenue par les lignes directrices de la Society of Maternal Fetal Medicine Clinic publiées en en tant que preuves de niveau I et III, Recommandation de niveau A.[22] Les preuves de niveau I font référence à un essai contrôlé randomisé correctement alimenté, et les preuves de niveau III sont étayées par des opinions d'experts, tandis qu'une recommandation de niveau A confère que la recommandation est faite sur la base de preuves scientifiques solides et cohérentes. OHPC 250 mg IM hebdomadaire de préférence est recommandé à partir de 16-20 semaines jusqu'à 36 semaines. Chez ces femmes, si la longueur cervicale échographique transvaginale se réduit à <25 mm à <24 semaines, un cerclage cervical peut être proposé. Dans l'étude de 2013, la recommandation est basée sur[23] il y avait également une diminution significative de la morbidité néonatale, y compris des taux plus faibles d'entérocolite nécrosante (0 dans le groupe de traitement vs 4 dans le contrôle), une hémorragie intraventriculaire (4 dans le groupe de traitement contre 8 dans le contrôle pour un risque relatif de 0,25), et le besoin en oxygène supplémentaire (14% dans le groupe de traitement vs 24% dans le placebo pour un risque relatif de 0,42). De plus, cette étude contenait 463 femmes, dont 310 ont reçu une injection. Parmi ces femmes, 9 avaient des nourrissons avec des malformations congénitales (2%), mais il n'y avait aucun schéma cohérent et aucun n'impliquait les organes internes.
L'OHPC est actuellement (en ) de catégorie de grossesse B, ce qui signifie qu'il n'y a aucune preuve de risque fœtal avec l'utilisation de ce médicament pendant la grossesse. Bien que ce soit maintenant la recommandation, cela n'a pas toujours été le cas. Un examen par Marc Keirse de l'Université Flinders a conclu que les informations sur les dommages potentiels faisaient défaut[24]. Trois études cliniques sur des grossesses uniques de 250 mg / semaine d'OHPC intramusculaire ont tous montré une tendance à une augmentation des fausses couches en raison d'une fausse couche par rapport au placebo[25] - [26] - [23]. L'un d'eux, une grande étude des National Institutes of Health (NIH) en 2003, a examiné l'effet des injections d'OHPC chez les femmes à risque de naissance prématurée répétée et a constaté que le groupe traité avait connu une naissance prématurée dans 37% des cas contre 55% chez les témoins. Une étude de suivi de la progéniture n'a montré aucune preuve que l'OHPC ait affecté les enfants au cours des premières années de vie[27]. Sur la base de ces données du NIH, l'OHPC a été approuvé par la Food and Drug Administration (FDA) en 2011 comme médicament destiné à réduire le risque de naissance prématurée chez certaines femmes à risque. (vi )
La FDA a exprimé sa préoccupation concernant une fausse couche lors de la réunion du comité consultatif de 2006; le comité a voté à l'unanimité qu'une étude plus approfondie était nécessaire pour évaluer l'association potentielle de l'OHPC avec un risque accru de fausse couche au deuxième trimestre et de mortinaissance[28]. Une étude de toxicologie chez des singes rhésus a entraîné la mort de tous les fœtus rhésus exposés à 1 et 10 fois l'équivalent de dose humaine d'OHPC[29]. As of 2008 , OHPC était un progestatif de catégorie D selon la FDA (c'est-à-dire qu'il existe des preuves de préjudice fœtal). Il y a des spéculations que l'huile de ricin dans la formulation de l'OHPC pourrait ne pas être bénéfique pour la grossesse[30] - [31]. Il convient de noter que l'étude NEJM susmentionnée de Meirs et al. compare l'effet de l'OHPC (avec le composant d'huile de ricin) à l'injection d'huile de ricin comme placebo.
Une étude publiée en février 2016 dans The Lancet a déclaré ce qui suit, entre autres résultats[32]:
Le critique de la revue Richard Lehman, chercheur principal au Département des soins de santé primaires de l'Université d'Oxford, a fait le commentaire notable suivant sur l'étude OPPTIMUM: «C'est tout. Cette histoire est terminée, et personne n'a besoin jamais utiliser de nouveau la progestérone vaginale pour prévenir l'accouchement prématuré «[33].
Une revue Cochrane sur les progestatifs pour prévenir les naissances prématurées a conclu qu'il y avait peu de preuves que la progestérone vaginale ou intramusculaire aidait à réduire le risque d'accouchement prématuré chez les femmes ayant une grossesse multiple[34].
Troubles gynécologiques
L'OHPC est utilisé dans le traitement de la menace de fausse couche, des troubles gynécologiques tels que la dysménorrhée, le syndrome prémenstruel, la maladie fibrokystique du sein, l'adénose et les douleurs mammaires[3]. De plus, l'OHPC est utilisé dans le traitement du cancer de l'endomètre et s'est avéré significativement efficace pour prolonger la vie des femmes préménopausées et postménopausées atteintes de la maladie[35]. Le médicament a été largement utilisé dans les années 1950 aux années 1970 pour de telles indications, mais plus récemment, l'OHPC a reçu le plus d'attention dans la prévention des naissances prématurées.
Contrôle des naissances
L'OHPC est disponible en association avec le valérate d'estradiol comme contraceptif injectable combiné une fois par mois dans quelques pays[36] - [37].
Autres utilisations
L'OHPC a été utilisé dans le cadre de l'hormonothérapie ménopausique chez la femme[38] - [39].
L'OHPC a été utilisé pour traiter l'hyperplasie bénigne de la prostate chez les hommes, bien que les preuves d'efficacité soient marginales et incertaines[40]. Il a également été utilisé pour traiter le cancer de la prostate, à une dose de 1 500 mg deux fois par semaine[41] - [42] - [43] - [44]. Le mécanisme d'action de l'OHPC dans ces utilisations est la suppression de la production d'androgènes testiculaires via la suppression de la sécrétion d'hormone lutéinisante, qui sont le résultat de l'activité progestative et antigonadotrope de l'OHPC. Cependant, des symptômes d'hypogonadisme peuvent se développer lorsque l'OHPC est utilisé pour cette indication, les deux tiers des hommes souffriraient d'impuissance[45].
L'OHPC a été utilisé comme élément de l'hormonothérapie féminisante pour les femmes transgenres[46] - [47] - [48] - [49] - [50]. En raison de la micronisation, les progestatifs bio-identiques sont plus couramment utilisés.
Formulaires disponibles
_packs.jpg.webp)
OHPC est disponible seul sous forme d'ampoules et de flacons de 125 et 250 mg / mL de solutions d'huile pour injection intramusculaire (noms de marque Proluton, Makena)[51] - [52]. Il est également disponible seul sous la forme d'un 250 auto-injecteur mg / mL à utiliser par injection sous-cutanée (marque Makena)[5].
L'OHPC est ou était disponible en association avec le valérate d'estradiol sous forme d'ampoules et de flacons de 250 mg / mL OHPC et 5 mg / mL de solutions d'huile de valérate d'estradiol pour injection intramusculaire (noms de marque Gravibinon, Chinese Injectable No. 1)[53] - [54] - [55] - [56]. Le médicament est ou était disponible en association avec le benzoate d'estradiol sous forme d'ampoules de 125 à 250 mg OHPC et 10 mg de benzoate d'estradiol dans une solution d'huile pour injection intramusculaire (nom de marque Primosiston) également[57] - [58] - [59] - [60] - [61]. :1045 En outre, l'OHPC a été commercialisé en association avec le dipropionate d'estradiol sous forme de 50 mg / mL OHPC et 1 mg / mL de dipropionate d'estradiol (nom de marque EP Hormone Depot) au Japon[62] - [63].
Contre-indications
Les contre - indications de l'OHPC comprennent une thrombose ou une maladie thromboembolique antérieure ou actuelle, un cancer du sein connu ou suspecté, des antécédents passés ou présents d'autres cancers hormonosensibles, des saignements vaginaux anormaux non diagnostiqués sans rapport avec la grossesse, une jaunisse cholestatique de la grossesse, des tumeurs hépatiques ou une maladie hépatique active, et hypertension incontrôlée[5]. Quelques contre-indications relatives existent également pour l'OHPC.
Effets secondaires
L'OHPC est généralement bien toléré et produit relativement peu d'effets secondaires[1]. Les réactions au site d'injection telles que la douleur, la douleur, l'enflure, les démangeaisons, les ecchymoses et les bosses sont les effets secondaires les plus courants de l'OHPC. Cependant, contrairement aux fortes doses de progestérone, qui produisent de telles réactions modérées à sévères, l'OHPC est relativement exempt de réactions au site d'injection[64]. Les effets secondaires de l'OHPC qui surviennent chez plus ou égal à 2% des utilisateurs comprennent la douleur au site d'injection (34,8%), le gonflement au site d'injection (17,1%), l'urticaire (12,3%), le prurit (7,7%), le prurit au site d'injection (5,8 %), nausées (5,8%), nodules au site d'injection (4,5%) et diarrhée (2,3%)[5]. Taux numériquement augmenté par rapport aux témoins de fausse couche (2,4% contre 0%), de mortinaissance (2,0% contre 1,3%), d'admission pour travail prématuré (16,0% contre 13,8%), de prééclampsie ou d'hypertension gestationnelle (8,8% contre 4,6 %), un diabète gestationnel (5,6% vs 4,6%)[8], et des oligohydramnios (3,6% vs 1,3%) ont été observés avec l'OHPC dans des essais cliniques dans lesquels il a été administré à des femmes enceintes pour prévenir l'accouchement prématuré.
Surdosage
Il n'y a pas de rapport sur le surdosage d'OHPC[5]. En cas de surdosage, le traitement doit être adapté en fonction des symptômes. L'OHPC a été étudié chez l'homme avec des doses élevées de 2 000 mg à 5 000 mg par semaines par injection intramusculaire, aucun problème de sécurité n'a été observé[13] - [65] - [66].
Les interactions
OHPC n'est pas susceptible d'affecter la plupart des cytochromes P450 enzymes à des concentrations thérapeutiques[5]. Aucune étude d'interaction médicamenteuse n'a été réalisée avec l'OHPC.
Pharmacologie
Pharmacodynamique
L'OHPC a une activité progestative, une certaine activité antiminéralocorticoïde et aucune autre activité hormonale importante[9] - [2] - [10] - [11] - [65].
Activité progestative
L'OHPC, également connu sous le nom de caproate de 17α-hydroxyprogestérone, est plus proche de la progestérone en termes de structure et de pharmacologie que la plupart des autres progestatifs, et est essentiellement un progestatif pur - c'est-à-dire un agoniste sélectif du récepteur de la progestérone (PR) avec peu ou pas d'autre activité hormonale[12] - [13]. Cependant, l'OHPC a amélioré la pharmacocinétique par rapport à la progestérone, à savoir une durée beaucoup plus longue avec une injection intramusculaire dans une solution d'huile[3] - [67] - [58] - [68].
Administré par injection intramusculaire, la dose de transformation endométriale d'OHPC par cycle est de 250 à 500 mg, et la dose de substitution hebdomadaire d'OHPC est de 250 mg, tandis que la posologie efficace d'OHPC dans le test de retard menstruel (Greenblatt) est de 25 mg par semaine[58] - [68] - [69]. Une dose efficace d'OHPC inhibant l'ovulation est de 500 mg une fois par mois par injection intramusculaire[55] - [70] - [71]. Cependant, la dose d'OHPC utilisée dans les contraceptifs injectables combinés une fois par mois est de 250 mg, et cette combinaison est efficace pour l'inhibition de l'ovulation de la même manière. À titre de comparaison, la dose d'acétate de médroxyprogestérone (MPA; acétate de 6α-méthyl-17α-hydroxyprogestérone), un analogue proche de l'OHPC, utilisé par injection intramusculaire en suspension aqueuse microcristalline dans des contraceptifs injectables combinés une fois par mois, est de 25 mg. Il a également été dit que, administrés par injection intramusculaire, 250 mg d'OHPC en solution d'huile est équivalent en puissance progestative à 50 mg d'acétate de médroxyprogestérone en suspension aqueuse microcristalline[72]. Bien que la demi-vie d'élimination de l'OHPC intramusculaire en solution huileuse chez les femmes non enceintes soit d'environ 8 jours[2], la demi-vie d'élimination de l'acétate de médroxyprogestérone intramusculaire en suspension aqueuse microcristalline chez la femme est d'environ 50 jours[73]. L'OHPC est également dans une certaine mesure moins puissant que l'ester hydroxyprogestérone acétate (OHPA; acétate de 17α-hydroxyprogestérone)[74].
La 17α-hydroxyprogestérone (OHP) a une faible activité progestative, mais l'estérification de C17α entraîne une activité progestative plus élevée[61]. Parmi une variété d'esters différents, l'ester de caproate (hexanoate) s'est avéré avoir la plus forte activité progestative, et cela a servi de base au développement de l'OHPC, ainsi que d'autres esters progestatifs de caproate tels que le caproate de gestonorone. L'OHPC est un progestatif beaucoup plus puissant que la 17α-hydroxyprogestérone, mais n'a pas une affinité pour le PR aussi élevée que la progestérone[74]. L'OHPC a environ 26% et 30% de l'affinité de la progestérone pour le PR-A et le PR-B humains, respectivement[1]. Le médicament n'était pas plus efficace que la progestérone pour activer ces récepteurs et susciter l'expression génique associée in vitro.
Effets antigonadotropes
En raison de l'activation du PR, l'OHPC a des effets antigonadotropes ou produit une suppression de l'axe hypothalamo-hypophyso-gonadique[75] - [76], et peut supprimer de manière significative la sécrétion de gonadotrophines et la production d'hormones sexuelles gonadiques à des doses suffisamment élevées[44]. Une étude a révélé que l'OHPC par injection intramusculaire à une dose de 200 mg deux fois par semaine pendant les deux premières semaines, puis 200 mg une fois par semaine pendant 12 semaines n'ont pas eu d'influence significative sur l'excrétion urinaire des œstrogènes, de l'hormone lutéinisante ou de l'hormone folliculo-stimulante chez les hommes atteints d'hyperplasie bénigne de la prostate[77]. Dans une autre étude qui a utilisé une dose non spécifiée d'OHPC intramusculaire, la sécrétion de testostérone a été évaluée chez un seul homme et a diminué de 4,2 mg / jour à 2,0 mg / jour (ou d'environ 52%) par 6 semaines de traitement, alors que la sécrétion d'hormone lutéinisante est restée inchangée chez l'homme[12]. Une autre étude a révélé que 3000 mg / semaine OHPC par injection intramusculaire a supprimé les niveaux de testostérone de 640 ng / dL à 320–370 ng / dL (de 42 à 50%) chez un seul homme atteint d'un cancer de la prostate, ce qui était similaire à la suppression de la testostérone avec l'acétate de cyprotérone ou l'acétate de chlormadinone[78]. Le caproate de gestonorone, un progestatif étroitement apparenté à l'OHPC avec une puissance d'environ 5 à 10 fois plus élevée chez l'homme[79], supprime les taux de testostérone de 75% à une dose de 400 mg / semaine chez les hommes atteints d'un cancer de la prostate[80] - [81]. À titre de comparaison, l'orchidectomie a diminué les niveaux de testostérone de 91%. En général, les progestatifs sont capables de supprimer au maximum les niveaux de testostérone d'environ 70 à 80%[82] - [83] - [84]. Les effets antigonadotropes de l'OHPC et donc sa suppression de la testostérone sont à la base de l'utilisation d'OHPC dans le traitement de l'hyperplasie bénigne de la prostate et du cancer de la prostate chez l'homme[40] - [41] - [43]. La suppression des taux d'hormone lutéinisante par l'OHPC a également été observée chez les femmes[85] - [86].
Activité glucocorticoïde
On dit que l'OHPC n'a aucune activité glucocorticoïde[13]. En accord, l'OHPC s'est avéré ne pas modifier les niveaux de cortisol chez l'homme, même avec des doses très élevées par injection intramusculaire. Ceci est pertinent car les médicaments ayant une activité glucocorticoïde significative suppriment les niveaux de cortisol en raison d'une augmentation de la rétroaction négative sur l'axe hypothalamo-hypophyso-surrénalien[51] - [87] - [88]. L'OHPC a été étudié chez l'homme à des doses aussi élevées que 5 000 mg par semaine par injection intramusculaire, avec sécurité et sans effets glucocorticoïdes observés[66]. Le médicament interagit cependant avec le récepteur des glucocorticoïdes ; il a environ 4% de l'affinité de la dexaméthasone pour le récepteur glucocorticoïde du lapin[1] - [74]. Mais il agit comme un agoniste partiel du récepteur et n'a pas une plus grande efficacité que la progestérone pour activer le récepteur et susciter l'expression génique associée in vitro[89].
D'autres activités
En tant que progestatif pur, l'OHPC n'a aucune activité androgène, antiandrogénique, œstrogénique ou glucocorticoïde[12] - [13] - [90]. L'absence d'activité androgénique et antiandrogénique avec l'OHPC contraste avec la plupart des autres progestatifs dérivés de la 17α-hydroxyprogestérone[67]. En raison de son manque de propriétés androgènes, comme la progestérone, l'OHPC n'a aucun effet tératogène sur le fœtus, ce qui le rend sûr pour une utilisation pendant la grossesse. Bien que l'OHPC ait été décrit comme un progestatif pur, il est prouvé qu'il possède une certaine activité antiminéralocorticoïde, similaire à la progestérone et à la 17α-hydroxyprogestérone[10] - [91] - [11]. Cela comprend les effets diurétiques cliniquement importants et l'inversion de la rétention hydrique et de l'œdème induits par les œstrogènes. Contrairement à la progestérone, l'OHPC et ses métabolites ne devraient pas interagir avec des récepteurs non génomiques tels que les récepteurs membranaires de la progestérone ou le récepteur GABA A.[14] En accord, l'OHPC n'est pas censé posséder les activités neurostéroïdes de la progestérone ou ses effets sédatifs associés.
En ce qui concerne les enzymes du cytochrome P450, l'OHPC n'a aucun effet sur le CYP1A, le CYP2D6, le CYP2C9 ou le CYP3A4, mais est un modeste inducteur du CYP2C19[3].
Différences avec la progestérone
Il existe des différences pharmacodynamiques entre la progestérone et l'OHPC, qui peuvent avoir des implications pour l'utilisation obstétricale[8] - [14]. Ceux-ci comprennent:
- Diminution de l'activité myométriale avec la progestérone in vitro mais aucun effet ou augmentation de l'activité myométriale avec l'OHPC[92]
- Prévention de la maturation cervicale avec la progestérone mais effet inconnu avec l'OHPC
- Un taux non significativement augmenté de mortinaissance et de fausses couches avec OHPC (dans une étude)
- Une incidence peut-être augmentée de diabète gestationnel avec l'OHPC (augmentée dans deux études, aucune différence dans une étude) mais aucun effet de ce type avec la progestérone
- Un risque significativement accru d'effets indésirables périnatals tels que la perte fœtale et l'accouchement prématuré lors de plusieurs gestations avec OHPC (dans deux études)
Des différences dans le métabolisme de la progestérone et de l'OHPC et des différences dans la formation et les activités des métabolites peuvent être responsables ou impliquées dans ces différences biologiques et pharmacologiques observées[14]. La progestérone est métabolisée par les 5α- et 5β-réductases, les 3α- et 3β-hydroxystéroïdes déshydrogénases et les 20α- et 20β-hydroxystéroïdes déshydrogénases dans divers tissus[93]. Dans les tissus cibles, en particulier le col de l'utérus et le myomètre, ces enzymes régulent les concentrations locales de progestérone et peuvent activer ou inactiver la signalisation de la progestérone. De plus, ces enzymes catalysent la formation de métabolites de la progestérone tels que la 5β-dihydroprogestérone et l'alloprégnanolone, qui signalent via leurs propres récepteurs non génomiques tels que les récepteurs membranaires de la progestérone et le récepteur GABA A et ont leurs propres effets importants pendant la grossesse[92] - [94] - [95]. À titre d'exemple, la 5β-dihydroprogestérone s'est avérée jouer un rôle important dans la suppression de l'activité myométriale tandis que l'allopregnanolone a de puissants effets sédatifs et anesthésiques chez la mère et en particulier le fœtus et est impliquée dans le développement du système nerveux fœtal[96] - [97]. Contrairement à la progestérone, l'OHPC n'est pas métabolisé par les enzymes traditionnelles de transformation des stéroïdes et est à la place métabolisé exclusivement par oxydation au niveau de la chaîne latérale du caproate par les enzymes du cytochrome P450. En tant que tel, on ne pense pas qu'il ait les mêmes schémas d'activation et d'inactivation spécifiques aux tissus que la progestérone ni les mêmes actions non génomiques que la progestérone et ses métabolites possèdent.
D'autres recherches cliniques devraient fournir des données supplémentaires pour aider à clarifier la question de la sécurité avec l'OHPC[8]. Dans tous les cas, il a été recommandé par l'American College of Obstetricians and Gynecologists que les femmes enceintes traitées avec l'OHPC reçoivent des conseils sur ses risques et ses avantages.
Pharmacocinétique
| Paramètre | Singleton | Double |
|---|---|---|
| C max (ng / ml) | 22,6 (15,8–27,4) | 17,3 (12–27) |
| C moyenne (0 – t) (ng / mL) | 16,8 (12,8 à 22,7) | 12,3 (8,4 à 18,7) |
| C creux (ng / mL) | 14,1 (10–18,1) | 11,2 (4,8–16,3) |
| AUC0–t (ng / mL / jour) | 117,3 (89,9–159,1) | 86,1 (59-131) |
| t1/2 (jours) | 16,2 (10,6–21,0) | 10 (6–16) |
| T max (jours) | 1,0 (1–3) | 1,2 (1–2) |
| Vd/F (× 10 3 ) (L) | 56 (25,2–69,6) | 16,9 (9,1–24,5) |
| Cl/F (× 10 3 ) (L) | 2,1 (1,5–2,7) | 1,2 (0,9-1,7) |
| Notes de bas de page: a = OHPC 250 mg une fois par semaine par injection intramusculaire. Sources:[3] - [98] - [99] | ||
Absorption
Chez l'animal, la biodisponibilité de l'OHPC par injection intramusculaire est proche de 100%, mais sa biodisponibilité orale est très faible à moins de 3%[7]. Chez les femmes, 70 mg / jour d'OHPC oral a une puissance endométriale similaire à 70 mg / jour d'OHPA oral et 2,5 mg / jour d'acétate de médroxyprogestérone par voie orale, indiquant que l'OHPC et l'OHPA par voie orale ont une puissance presque 30 fois inférieure à celle de l'acétate de médroxyprogestérone par voie orale[100]. Les études sur les changements endométriaux progestatifs avec OHPC oral chez les femmes sont cependant mitigées, avec une constatation d'effets faibles avec 100 mg / jour alors qu'un autre a constaté que des doses de 250 à 1 000 mg n'a produit aucun effet[101] - [102]. En raison de sa faible puissance orale, l'OHPC n'a pas été utilisé par voie orale et a plutôt été administré par injection intramusculaire. Cependant, une nouvelle formulation orale d'OHPC (nom de code de développement LPCN-1107) est en cours de développement et s'est avérée efficace, bien qu'elle ait nécessité une administration deux fois par jour dans une étude clinique[103] - [104] - [105].
Un effet retard se produit lorsque l'OHPC est injecté par voie intramusculaire ou sous - cutanée, de sorte que le médicament a une durée d'action prolongée[106] - [3]. Après une seule injection intramusculaire de 1 000 mg OHPC chez cinq femmes atteintes d'un cancer de l'endomètre, les taux maximaux d'OHPC étaient de 27,8 ± 5,3 ng / mL et le délai avant les concentrations maximales était de 4,6 ± 1,7 (3-7) jours[107]. Suivis 13 semaines d'administration continue de 1 000 mg OHPC par semaine, les niveaux minimaux d'OHPC étaient de 60,0 ± 14 ng / mL. Les paramètres pharmacocinétiques de 250 mg OHPC une fois par semaine par injection intramusculaire ont également été étudiés chez les femmes enceintes ayant une gestation simple et multiple (jumeaux et triplés)[98] - [99]. Les niveaux à l'état d'équilibre du médicament sont atteints en 4 à 12 semaines d’administration chez la femme enceinte[1]. La durée de l'effet biologique clinique de l'OHPC par injection intramusculaire a également été étudiée chez la femme[108]. Une seule injection intramusculaire de 65 à 500 mg OHPC dans une solution d'huile s'est avéré avoir une durée d'action de 5 à 21 jours en termes d'effet dans l'utérus et sur la température corporelle chez la femme.
L'OHPC s'est avéré posséder des propriétés pharmacocinétiques similaires, y compris des niveaux de pic, le temps nécessaire pour atteindre les niveaux de pic, les niveaux de l'aire sous la courbe (c'est-à-dire l'exposition totale) et la demi-vie d'élimination, avec administration par injection intramusculaire ou auto- injection sous - cutanée[106]. Cependant, il y avait une incidence plus élevée de douleur au site d'injection avec l'auto-injection sous-cutanée qu'avec l'injection intramusculaire (37,3% vs 8,2%).
Distribution
L'OHPC est fortement lié aux protéines plasmatiques, dont l'albumine[1]. Contrairement à la progestérone et à la 17α-hydroxyprogestérone, l'OHPC a une très faible affinité pour la globuline se liant aux corticostéroïdes (moins de 0,01% de celle du cortisol )[109]. La progestérone et la 17α-hydroxyprogestérone ont une faible affinité pour la globuline se liant aux hormones sexuelles, et pour cette raison, seule une très petite fraction d'entre elles (moins de 0,5%) est liée à cette protéine dans la circulation[110].
Métabolisme
OHPC semble être métabolisé principalement par le cytochrome P450 enzymes CYP3A4 et CYP3A5[1]. Il peut également être métabolisé par le CYP3A7 dans le foie fœtal et le placenta. Contrairement à la progestérone, l'OHPC n'est pas métabolisé par les enzymes traditionnelles de transformation des stéroïdes et ne forme pas de métabolites similaires[14]. Le métabolisme de l'OHPC se fait par réduction, hydroxylation et conjugaison, y compris la glucuronidation, la sulfatation et l'acétylation. L'ester caproate de l'OHPC n'est pas clivé au cours du métabolisme, de sorte que la 17α-hydroxyprogestérone n'est pas formée à partir de l'OHPC[74]. En tant que tel, l'OHPC n'est pas un promédicament de la 17α-hydroxyprogestérone, ni de la progestérone.
L'OHPC a une demi-vie d'élimination de 7,8 jours lorsqu'il est administré par injection intramusculaire dans une formulation à base d'huile à des femmes non enceintes[2]. Sa durée totale serait de 10 à 14 jours, ce qui est beaucoup plus long que la durée de la progestérone administrée par voie intramusculaire dans une formulation d'huile (2 à 3 jours)[111]. Chez la femme enceinte, la demi-vie d'élimination de l'OHPC semble être plus longue, environ 16 ou 17 jours[1] - [3]. Cependant, chez les femmes enceintes de jumeaux plutôt que d'un singulet, la demi-vie d'élimination de l'OHPC s'est avérée plus courte, à 10 jours. L'OHPC a été détecté chez des femmes enceintes jusqu'à 44 jours après la dernière dose.
Chimie
OHPC, également connu sous le 17α-hydroxyprogestérone caproate ou comme 17α-hydroxyprégn-4-ène-3,20-dione 17α-hexanoate, est un synthétique pregnane stéroïde et un dérivé de la progestérone[16] - [113]. Il s'agit spécifiquement d'un dérivé de la 17α-hydroxyprogestérone avec un ester hexanoate (caproate) en position C17α. Analogues de OHPC comprennent d' autres dérivés 17α-hydroxyprogestérone, tels que algestone acétophénide (dihydroxyprogestérone acétophénide), l'acétate de chlormadinone , la cyprotérone acétate, hydroxyprogestérone acétate, hydroxyprogestérone heptanoate, acétate de médroxyprogestérone et de l'acétate de mégestrol, ainsi que le caproate esters chlormadinone caproate, gestonorone caproate (norhydroxyprogesterone caproate), le caproate de médroxyprogestérone, le caproate de mégestrol et le caproate de méthenmadinone.
Synthèse
Des synthèses chimiques d'OHPC ont été décrites[114] - [115] - [116].:6
Histoire
Avec l'acétate d'hydroxyprogestérone, l'OHPC a été développé par Karl Junkmann de Schering AG en 1953 et a été rapporté pour la première fois par lui dans la littérature médicale en 1954[117] - [118] - [119] - [120] - [121]. Il aurait été commercialisé pour la première fois au Japon en 1954 ou 1955[15], puis introduit sous le nom de delalutin aux États-Unis en 1956[3] - [122]. En raison de sa durée beaucoup plus longue que la progestérone parentérale, l'OHPC avait largement remplacé la progestérone dans la pratique clinique en 1975[123]. Après des décennies d'utilisation, Squibb, le fabricant, a volontairement retiré le produit Delalutin aux États-Unis en 1999[17]. Un regain d'intérêt pour l'OHPC aux États-Unis a été suscité par une vaste étude parrainée par les NIH en 2003 qui a révélé que l'OHPC réduisait le risque de naissance prématurée chez certaines femmes enceintes à risque[23]. Les données de suivi ne montrant aucune preuve d'effets nocifs sur la progéniture, la FDA a approuvé le médicament, tel que sponsorisé par KV Pharmaceutical sous le nom de Makena, en tant que médicament orphelin en pour réduire le risque de naissance prématurée chez les femmes avant 37 semaines de gestation. avec un seul fœtus ayant eu au moins une naissance prématurée[18] - [124].
Société et culture
Noms génériques
Le caproate d'hydroxyprogestérone est le nom générique de l'OHPC et de ses INN, USAN, BANM et JAN, tandis que l'hexanoate d'hydroxyprogestérone était son ancien BANM[16] - [37] - [113].
L'OHPC est souvent mal étiqueté et confondu avec la progestérone et la 17α-hydroxyprogestérone[125]. Il ne doit pas non plus être confondu avec l'acétate d'hydroxyprogestérone, l'heptanoate d'hydroxyprogestérone ou l'acétate de médroxyprogestérone[113].
Les noms de marques
OHPC est commercialisé dans le monde entier sous diverses marques, notamment Proluton, Proluton Depot et Makena ( US ), entre autres[16] - [37] - [113]. Il était également autrefois commercialisé sous des marques telles que Delalutin, Prodrox et Hylutin, entre autres, mais ces formulations ont depuis été abandonnées. Il a été commercialisé sous les noms de marque Gravibinon et Injectable No. 1 (ou Chinese Injectable No. 1) en combinaison avec le valérate d'estradiol[53] - [54] - [55] - [56] et sous le nom de marque Primosiston en combinaison avec le benzoate d'estradiol[57] - [58] - [59] - [60] - [61].
Disponibilité
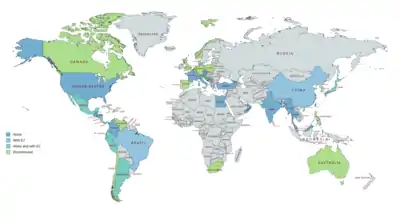
OHPC est commercialisé aux États-Unis et dans toute l'Europe, l'Asie et l'Amérique centrale et du Sud[16] - [37] - [126]. Il n'est notamment pas disponible au Canada, au Royaume-Uni, en Nouvelle-Zélande ou en Afrique du Sud, et seules les formulations vétérinaires sont disponibles en Australie. L'OHPC est également commercialisé en association avec le valérate d'estradiol comme contraceptif injectable combiné dans un certain nombre de pays, notamment en Amérique du Sud, au Mexique, au Japon et en Chine. Il a également été commercialisé sous forme de préparation injectable en association avec le benzoate d'estradiol dans certains pays[57] - [58] - [59] - [60] - [61].
Controverse sur les prix
Avec la désignation de l'OHPC comme médicament orphelin par la FDA et l'approbation de Makena en 2011, le prix de l'OHPC aux États-Unis allait passer de US$15 US$1,500 pour une dose unique, ou d'environ US$300 à entre les US$25,000 - US$25,000 et US$30,000 pour un seul mois typique de traitement. Il s'agissait d'une augmentation du coût d'environ 100 fois, avec «un avantage clinique supplémentaire minime», et c'était une stratégie de prix fortement critiquée[18]. La FDA a par la suite annoncé que les pharmacies de préparation pouvaient continuer à vendre l'OHPC à leur coût habituel d'environ US$10 US$20 par dose sans crainte de représailles légales[19]. KV Pharmaceutical a également choisi de réduire son prix de Makena à US$690 dose[127]. L'OHPC est resté disponible à bas prix auprès des pharmacies de préparation jusqu'à la fin de 2016, après quoi la FDA a publié de nouveaux documents d'orientation interdisant aux pharmacies de préparation de vendre des produits qui sont «essentiellement des copies» de produits pharmaceutiques disponibles dans le commerce[20] - [21].
Rechercher
Thérapie cyclique avec 150 mg OHPC par injection intramusculaire s'est avéré efficace dans le traitement de 76 femmes souffrant d'acné persistante et réfractaire au traitement dans une étude préliminaire, 84% ayant répondu au traitement et une amélioration «bonne à excellente» des symptômes[111] - [128].
L'OHPC a été étudié par Schering pour être utilisé comme contraceptif injectable progestatif seul à une dose de 250 à 500 mg une fois par mois par injection intramusculaire mais a produit un mauvais contrôle du cycle à ces doses et n'a jamais été commercialisé[129] - [130].
L'OHPC en lui-même s'est avéré peu ou pas efficace dans le traitement du cancer du sein chez la femme[61] - [131] - [132] - [133]. Inversement, l'association de valérate d'estradiol et d'OHPC s'est avérée efficace dans le traitement du cancer du sein chez la femme[91] - [134]. Des recherches initiales basées sur des données cliniques limitées ont rapporté que le taux de réponse au cancer du sein avec une combinaison de valérate d'estradiol et d'OHPC semblait être plus élevé qu'avec un œstrogène seul (35% contre 50%). Cependant, des recherches ultérieures utilisant le caproate de gestonorone progestatif, mais plus puissant, ont révélé que la combinaison de valérate d'estradiol et de caproate de gestonorone avait une efficacité qui n'était pas significativement différente de celle d'un œstrogène seul dans le traitement du cancer du sein chez la femme[135].
Une nouvelle formulation orale d'OHPC (nom de code développemental LPCN-1107) est en cours de développement pour la prévention du travail prématuré[103] - [104]. Depuis , il est en essais cliniques de phase II ou de phase III pour cette indication.
Articles connexes
- Valérate d'estradiol / caproate d'hydroxyprogestérone
- Benzoate d'estradiol / caproate d'hydroxyprogestérone
- Dipropionate d'estradiol / caproate d'hydroxyprogestérone
Notes et références
- « 17 α-Hydroxyprogesterone caproate (Makena™): in the prevention of preterm birth », Paediatric Drugs, vol. 13, no 5, , p. 337–45 (PMID 21888448, DOI 10.2165/11208140-000000000-00000)
- « 17 α-hydroxyprogesterone caproate (Makena®): a guide to its use in the prevention of preterm birth », Clinical Drug Investigation, vol. 33, no 3, , p. 223–7 (PMID 23413110, DOI 10.1007/s40261-013-0060-6)
- « Prevention of preterm delivery with 17-hydroxyprogesterone caproate: pharmacologic considerations », Seminars in Perinatology, vol. 38, no 8, , p. 516–22 (PMID 25256193, PMCID 4253874, DOI 10.1053/j.semperi.2014.08.013)
- « 17-alpha hydroxyprogesterone caproate for preterm birth prevention: Where have we been, how did we get here, and where are we going? », Seminars in Perinatology, vol. 41, no 8, , p. 461–467 (PMID 28947068, DOI 10.1053/j.semperi.2017.08.004)
- https://www.accessdata.fda.gov/drugsatfda_docs/label/2018/021945s012lbl.pdf
- « A review of "once-a-month" combined injectable contraceptives », Journal of Obstetrics and Gynaecology, vol. 4 Suppl 1, , S1-34 (PMID 12290848, DOI 10.3109/01443619409027641)
- « Route of administration and formulation dependent pharmacokinetics of 17-hydroxyprogesterone caproate in rats », Xenobiotica; the Fate of Foreign Compounds in Biological Systems, vol. 46, no 2, , p. 169–74 (PMID 26153441, PMCID 4809632, DOI 10.3109/00498254.2015.1057547)
- « Progesterone is not the same as 17α-hydroxyprogesterone caproate: implications for obstetrical practice », American Journal of Obstetrics and Gynecology, vol. 208, no 6, , p. 421–6 (PMID 23643669, PMCID 4120746, DOI 10.1016/j.ajog.2013.04.027)
- Ovarian Function and its Disorders: Diagnosis and Therapy, Springer Science & Business Media, , 95– (ISBN 978-94-009-8195-9, lire en ligne)
- Ralph I. Dorfman, Steroidal Activity in Experimental Animals and Man, Elsevier Science, , 398– (ISBN 978-1-4832-7299-3, lire en ligne) :
« Intramuscular administration of 17α-hydroxyprogesterone caproate produced signs and symptoms of adrenal insufficiency in Addisonians maintained on cortisol and 9α-fluorocortisol (Melby, 1961) and thereby showed properties similar to progesterone and 17α-hydroxyprogesterone. However, further tests will be required to eludicate its pharmacodynamics properties. Contrastingly, there was no evidence for salt dissipation with the test of a smaller dose of the steroid to normal subjects (Landau et al., 1958). »
- « Progesterone therapy in pre-eclamptic toxaemia », Acta Obstetricia et Gynecologica Scandinavica, vol. 54, no 3, , p. 195–202 (PMID 1163210, DOI 10.3109/00016347509157760) :
« Melby (14) found that when progesterone was administered to patients suffering from the syndrome of idiopathic oedema, they experienced a diuresis, with a high excretion of sodium and water within 24 hours after a single injection of 500 mg of 17-α-hydroxyprogesterone caproate. »
- « Treatment of benign prostatic hypertrophy with hydroxyprogesterone caproate: effect on clinical symptoms, morphology, and endocrine function », JAMA, vol. 193, no 2, , p. 121–8 (PMID 14304354, DOI 10.1001/jama.1965.03090020035009)
- « 17 hydroxyprogesterone for the prevention of preterm delivery », Obstetrics and Gynecology, vol. 105, no 5 Pt 1, , p. 1128–35 (PMID 15863556, DOI 10.1097/01.AOG.0000160432.95395.8f)
- « Regulation of progesterone signaling during pregnancy: implications for the use of progestins for the prevention of preterm birth », The Journal of Steroid Biochemistry and Molecular Biology, vol. 139, , p. 173–81 (PMID 23410596, DOI 10.1016/j.jsbmb.2013.01.015)
- International Agency for Research on Cancer, Sex Hormones (II)., International Agency for Research on Cancer, (ISBN 978-92-832-1221-8, lire en ligne), p. 401 :
« 17α-Hydroxyprogesterone caproate was first marketed commercially in Japan in 1954-1955. »
- Index Nominum 2000: International Drug Directory, Taylor & Francis, , 532– (ISBN 978-3-88763-075-1, lire en ligne)
- (en) « The Orphan Drug Act: How the FDA Unlawfully Usurped Market Exclusivity », Northwestern Journal of Technology and Intellectual Property, Heinonline, vol. 11, no 6, , p. 91, 93 (lire en ligne)
- « Unintended consequences--the cost of preventing preterm births after FDA approval of a branded version of 17OHP », The New England Journal of Medicine, vol. 364, no 18, , p. 1689–91 (PMID 21410391, DOI 10.1056/NEJMp1102796)
- « Macleans.ca - Canada's national current affairs and news magazine since 1905 » [archive du ] (consulté le )
- (en) Research, « Compounded Drug Products That Are Essentially Copies of a Commercially Available Drug Product Under Section 503A of the Federal Food, Drug, and Cosmetic Act Guidance for Industry », U.S. Food and Drug Administration, (consulté le )
- « FDA to Restrict Compounders from Making Copies of Commercially Available Drugs », RAPS.com, (consulté le )
- SMFM Clinical Guideline: Progesterone and preterm birth prevention: translating clinical trials data into clinical practice, AJOG May 2012
- « Prevention of recurrent preterm delivery by 17 alpha-hydroxyprogesterone caproate », The New England Journal of Medicine, vol. 348, no 24, , p. 2379–85 (PMID 12802023, DOI 10.1056/NEJMoa035140)
- « Progesterone and preterm: seventy years of "déjà vu" or "still to be seen"? », Birth, vol. 31, no 3, , p. 230–5 (PMID 15330887, DOI 10.1111/j.0730-7659.2004.00315.x)
- « Efficacy of 17alpha-hydroxyprogesterone caproate in the prevention of premature labor », The New England Journal of Medicine, vol. 293, no 14, , p. 675–80 (PMID 1099445, DOI 10.1056/nejm197510022931401)
- « Prevention of premature labor by 17 alpha-hydroxyprogesterone caproate », American Journal of Obstetrics and Gynecology, vol. 151, no 5, , p. 574–7 (PMID 3976757, DOI 10.1016/0002-9378(85)90141-3)
- « Follow-up of children exposed in utero to 17 alpha-hydroxyprogesterone caproate compared with placebo », Obstetrics and Gynecology, vol. 110, no 4, , p. 865–72 (PMID 17906021, DOI 10.1097/01.AOG.0000281348.51499.bc)
- Advisory Committees: CDER 2006 Meeting Documents
- « Embryotoxicity of sex steroidal hormones in nonhuman primates: II. Hydroxyprogesterone caproate, estradiol valerate », Teratology, vol. 35, no 1, , p. 129–36 (PMID 3563931, DOI 10.1002/tera.1420350116)
- Duke University Medical Center, New England Journal of Medicine, correspondence, vol 349.
- « The effect of 17 alpha-hydroxyprogesterone caproate on pregnancy outcome in an active-duty military population », American Journal of Obstetrics and Gynecology, vol. 146, no 2, , p. 187–90 (PMID 6682631, DOI 10.1016/0002-9378(83)91051-7)
- (en) « Vaginal progesterone prophylaxis for preterm birth (the OPPTIMUM study): a multicentre, randomised, double-blind trial », Lancet, vol. 387, no 10033, , p. 2106–2116 (PMID 26921136, PMCID 5406617, DOI 10.1016/S0140-6736(16)00350-0)
- « BMJ Blogs: The BMJ » Blog Archive » Richard Lehman's journal review—23 May 2016 », blogs.bmj.com, (consulté le )
- Dodd, Grivell, OBrien et Dowswell, « Prenatal administration of progestogens for preventing spontaneous preterm birth in women with a multiple pregnancy. », The Cochrane Database of Systematic Reviews, vol. 2019, no 11, (PMID 31745984, PMCID 6864412, DOI 10.1002/14651858.CD012024.pub3)
- « Hydroxyprogesterone caproate therapy in advanced endometrial cancer », Cancer, vol. 27, no 3, , p. 485–502 (PMID 5549492, DOI 10.1002/1097-0142(197103)27:3<485::AID-CNCR2820270302>3.0.CO;2-1)
- (en) J. R. Newton, Catherine D'arcangues et P. E. Hall, « A review of ‘once-a-month's combined injectable contraceptives », Journal of Obstetrics and Gynaecology, vol. 14, no sup1, , s1–s34 (PMID 12290848, DOI 10.3109/01443619409027641, lire en ligne, consulté le )
- « Hydroxyprogesterone »
- Donna Shoupe et Daniel R. Mishell, Menopause: Physiology and Pharmacology, Year Book Medical, , 335–351 p. (ISBN 9780815159148, lire en ligne), « Therapeutic Regimens »
- Agostini, Casini, Costabile et Paragona, « Efficacy and safety of 17α-hydroxyprogesterone caproate in hormone replacement therapy », Gynecological Endocrinology, vol. 21, no 5, , p. 265–267 (ISSN 0951-3590, PMID 16373245, DOI 10.1080/09513590500368650)
- Benign Prostatic Hypertrophy, Springer Science & Business Media, , 266– (ISBN 978-1-4612-5476-8, lire en ligne)
- Richard J. Ablin et Malcolm D. Mason, Metastasis of Prostate Cancer, Springer Science & Business Media, , 286– (ISBN 978-1-4020-5847-9, lire en ligne)
- Cancer of the Prostate and Kidney, Springer Science & Business Media, , 309, 339 (ISBN 978-1-4684-4349-3, lire en ligne)
- Prostatic Carcinoma: Biology and Diagnosis, Springer Science & Business Media, , 128– (ISBN 978-94-009-8887-3, lire en ligne)
- The Treatment of Prostatic Hypertrophy and Neoplasia, Springer Science & Business Media, , 39,132 (ISBN 978-94-015-7190-6, lire en ligne) :
« Geller has also demonstrated significant decreases in plasma or urine testosterone glucuronide levels following the administration of three other anti-androgens. These include Delalutin [hydroxyprogesterone caproate], chlormadinone acetate, and PH-218. It would appear that decreased androgen production is a property shared by all anti-androgens to date. »
- Jeffrey K. Aronson, Meyler's Side Effects of Endocrine and Metabolic Drugs, Elsevier, , 289– (ISBN 978-0-08-093292-7, lire en ligne)
- Gianna E. Israel, Donald E. Tarver et Joy Diane Shaffer, Transgender Care: Recommended Guidelines, Practical Information, and Personal Accounts, Temple University Press, , 58– (ISBN 978-1-56639-852-7, lire en ligne)
- Richard Ekins et Dave King, The Transgender Phenomenon, SAGE Publications, , 48– (ISBN 978-1-84787-726-0, lire en ligne)
- Richard K. Adler, Sandy Hirsch et Michelle Mordaunt, Voice and Communication Therapy for The Transgender/Transsexual Client: A Comprehensive Clinical Guide, Plural Publishing, , 486– (ISBN 978-1-59756-631-5, lire en ligne)
- « Status of sex reassignment surgery for gender identity disorder in Japan », International Journal of Urology, vol. 19, no 5, , p. 402–14 (PMID 22372595, DOI 10.1111/j.1442-2042.2012.02975.x)
- « Altered arterial stiffness in male-to-female transsexuals undergoing hormonal treatment », The Journal of Obstetrics and Gynaecology Research, vol. 38, no 6, , p. 932–40 (PMID 22487218, DOI 10.1111/j.1447-0756.2011.01815.x, lire en ligne)
- Kenneth L. Becker, Principles and Practice of Endocrinology and Metabolism, Lippincott Williams & Wilkins, , 757–759, 2168 (ISBN 978-0-7817-1750-2, lire en ligne)
- Sandeep Nema et John D. Ludwig, Pharmaceutical Dosage Forms - Parenteral Medications, Third Edition: Volume 1: Formulation and Packaging, CRC Press, , 161– (ISBN 978-1-4200-8644-7, lire en ligne)
- Niels F Muller et Rudolf P Dessing, European Drug Index: European Drug Registrations, CRC Press, , 561– (ISBN 978-3-7692-2114-5, lire en ligne)
- « Pharmacokinetics of once-a-month injectable contraceptives », Contraception, vol. 49, no 4, , p. 347–59 (PMID 8013219, DOI 10.1016/0010-7824(94)90032-9)
- « Pharmacodynamic effects of once-a-month combined injectable contraceptives », Contraception, vol. 49, no 4, , p. 361–85 (PMID 8013220, DOI 10.1016/0010-7824(94)90033-7)
- « Increasing use of long-acting reversible contraception: safe, reliable, and cost-effective birth control », World J Pharm Pharm Sci, vol. 3, no 10, , p. 364–392 (ISSN 2278-4357, lire en ligne [archive du ], consulté le )
- Freimut A. Leidenberger, Klinische Endokrinologie für Frauenärzte, Springer-Verlag, , 533– (ISBN 978-3-662-08110-5, lire en ligne)
- Karl Knörr, Fritz K. Beller et Christian Lauritzen, Lehrbuch der Gynäkologie, Springer-Verlag, , 214, 255 (ISBN 978-3-662-00942-0, lire en ligne)
- Heinrich Kahr, Konservative Therapie der Frauenkrankheiten: Anzeigen, Grenzen und Methoden Einschliesslich der Rezeptur, Springer-Verlag, , 22– (ISBN 978-3-7091-5694-0, lire en ligne)
- Hagers Handbuch der Pharmazeutischen Praxis: Für Apotheker, Arzneimittelhersteller, Drogisten, Ärzte und Medizinalbeamte, Springer-Verlag, , 1163– (ISBN 978-3-642-49759-9, lire en ligne)
- Joachim Ufer, Die Gestagene, Springer-Verlag, , 1026–1124 p. (ISBN 978-3-642-99941-3, DOI 10.1007/978-3-642-99941-3_7, lire en ligne), « Die therapeutische Anwendung der Gestagene beim Menschen » :
« Depotinjektionen [...] 2. Einmalige Injektion von 125mg oder 250mg 17α-Hydroxyprogesteroncapronat als Depotgestagen und 10 mg Oestradiolbenzoat in öliger Lösung (Primosiston) [47, 81, 110, 563, 523, 571, 718, 721, 732, 733, 864, 872, 933, 973, 400]. »
- https://www.drugs.com/international/ep-hormone.html
- « Influence of hormones on proliferation of ER-positive cells and ER-negative cells of human breast cancer (MCF-7) », Oncology, vol. 47, no 1, , p. 19–24 (PMID 2137212, DOI 10.1159/000226779) :
« After the transplantation, each mouse received an intramuscular injection of 0.1 ml EP Hormone Depot consisting of 1 mg/ml 17-β-estradiol dipropionate and 50 mg/ml hydroxyprogesterone caproate every week. »
- « Fertility promoting and inhibiting effects of new steroid hormonal substances », J Am Med Assoc, vol. 169, no 16, , p. 1843–54 (PMID 13640942, DOI 10.1001/jama.1959.03000330015003)
- « What agent should be used to prevent recurrent preterm birth: 17-P or natural progesterone? », Obstetrics and Gynecology Clinics of North America, vol. 38, no 2, , p. 235–46, ix–x (PMID 21575799, DOI 10.1016/j.ogc.2011.02.014)
- Varga A, Henriksen E. Clinical and Histopathologic Evaluation of the Effect of 17-alpha-Hydroxyprogesterone-17-n-caproate on Endometrial Carcinoma. Obstetrics & Gynecology. December 1961. Volume 18. Issue 6. pp. 658-672.
- (en) « Pharmacology of estrogens and progestogens: influence of different routes of administration », Climacteric, vol. 8 Suppl 1, , p. 3–63 (PMID 16112947, DOI 10.1080/13697130500148875, lire en ligne)
- Karl Knörr, Henriette Knörr-Gärtner, Fritz K. Beller et Christian Lauritzen, Geburtshilfe und Gynäkologie: Physiologie und Pathologie der Reproduktion, Springer-Verlag, , 583– (ISBN 978-3-642-95583-9, lire en ligne)
- « Clinical use of oestrogens and progestogens », Maturitas, vol. 12, no 3, , p. 199–214 (PMID 2215269, DOI 10.1016/0378-5122(90)90004-P)
- Toppozada MK, « Existing once-a-month combined injectable contraceptives », Contraception, vol. 49, no 4, , p. 293–301 (PMID 8013216, DOI 10.1016/0010-7824(94)90029-9)
- « Conception control by long-acting progestogens: preliminary report », Obstetrics and Gynecology, vol. 21, , p. 666–8 (PMID 13992789, DOI 10.1097/00006250-196306000-00003, lire en ligne)
- « The use of progestational agents in obstetrics and gynecology », Clinical Obstetrics and Gynecology, vol. 3, no 4, , p. 1047–67 (PMID 13756432, DOI 10.1097/00003081-196003040-00019) :
« 50 mg of [medroxyprogesterone acetate], intramuscularly, is equivalent to 250 mg [hydroxyprogesterone caproate] »
- « Depo_Provera », FDA, (consulté le )
- « Comparison of progesterone and glucocorticoid receptor binding and stimulation of gene expression by progesterone, 17-alpha hydroxyprogesterone caproate, and related progestins », American Journal of Obstetrics and Gynecology, vol. 197, no 6, , p. 599.e1–7 (PMID 18060946, PMCID 2278032, DOI 10.1016/j.ajog.2007.05.024)
- (zh) « [Changes in reproductive hormones levels in the treatment of endometrial precancerous lesion with hydroxyprogesterone caproate] », Zhonghua Fu Chan Ke Za Zhi, vol. 29, no 4, , p. 205–6, 251 (PMID 8082440) :
« In this paper, 14 cases of precancerous lesion of endometrium were treated with hydroxyprogesterone caproate and a series of hormone determination was analysed before and after treatment. Results showed that LH and LH/FSH were dramatically decreased. (LH P < 0.05, LH/FSH P < 0.01). »
- Benign Prostatic Hypertrophy, Springer Science & Business Media, , 266– (ISBN 978-1-4612-5476-8, lire en ligne) :
« Since the initial report by Geller and associates28 on the use of hydroxyprogesterone caproate in the treatment of BPH, a variety of progestins have been studied in the medical management of this disease: hydroxyprogesterone caproate, chlormadinone acetate,27 and medrogestone (6-methyl-6-dehydro-17-methylprogesterone).50 These drugs should have a beneficial effect in BPH as they inhibit testicular function by suppressing serum LH and have no intrinsic estrogenic or androgenic activity. »
- « Treatment of benign prostatic hyperplasia with hydroxyprogesterone-caproate: placebo-controlled study », Urology, vol. 9, no 2, , p. 144–8 (PMID 65818, DOI 10.1016/0090-4295(77)90184-4)
- « Effect of progestational agents on carcinoma of the prostate », Cancer Chemother Rep, vol. 51, no 1, , p. 41–6 (PMID 6039663)
- « Progesterone treatment for local recurrence and metastases in carcinoma corporis uteri », Acta Radiologica, vol. 10, no 2, , p. 187–92 (PMID 5556820, DOI 10.3109/02841867109129755) :
« The preparations used were Proluton Depot (17a-hydroxy-progesterone caproate) and in 3 patients SH 5132 (17a-hydroxy-19-norprogesterone caproate); 100 mg of the latter corresponds to 1000 mg of Proluton Depot. »
- « On gestagen treatment of advanced prostatic carcinoma », Scandinavian Journal of Urology and Nephrology, vol. 12, no 2, , p. 119–21 (PMID 694436, DOI 10.3109/00365597809179977)
- « Effects of norgestrel and ethinyloestradiol ingestion on serum levels of sex hormones and gonadotrophins in men », Clinical Endocrinology, vol. 11, no 5, , p. 497–504 (PMID 519881, DOI 10.1111/j.1365-2265.1979.tb03102.x) :
« Another synthetic gestogen, 17-hydroxy-19-norprogesterone caproate (Depostat-Schering), 400 mg by i.m. weekly injections suppressed T levels to 25% of pretreatment values (Sander er al., 1978). »
- Alan J. Wein, Louis R. Kavoussi, Andrew C. Novick, Alan W. Partin et Peters, Campbell-Walsh Urology: Expert Consult Premium Edition: Enhanced Online Features and Print, 4-Volume Set, Elsevier Health Sciences, , 2938– (ISBN 978-1-4160-6911-9, lire en ligne)
- « Effect of flutamide or cyproterone acetate on pituitary and testicular hormones in normal men », The Journal of Clinical Endocrinology and Metabolism, vol. 59, no 5, , p. 963–9 (PMID 6237116, DOI 10.1210/jcem-59-5-963)
- « Treatment of advanced prostatic cancer with parenteral cyproterone acetate: a phase III randomised trial », British Journal of Urology, vol. 52, no 3, , p. 208–15 (PMID 7000222, DOI 10.1111/j.1464-410x.1980.tb02961.x)
- « An endocrine basis for endometrial carcinoma », American Journal of Obstetrics and Gynecology, vol. 77, no 2, , p. 233–42 (PMID 13617315, DOI 10.1016/0002-9378(59)90223-6)
- « Short-term progestogen treatment of endometrial carcinoma. Histological, histochemical and hormonal studies », Acta Obstetricia et Gynecologica Scandinavica, vol. 51, no 1, , p. 55–62 (PMID 4261828, DOI 10.3109/00016347209154968)
- Eliza B. Geer, The Hypothalamic-Pituitary-Adrenal Axis in Health and Disease: Cushing's Syndrome and Beyond, Springer, , 28– (ISBN 978-3-319-45950-9, lire en ligne)
- Diane S. Aschenbrenner et Samantha J. Venable, Drug Therapy in Nursing, Lippincott Williams & Wilkins, , 674– (ISBN 978-0-7817-6587-9, lire en ligne)
- « Discovery of selective glucocorticoid receptor modulators by multiplexed reporter screening », Proceedings of the National Academy of Sciences of the United States of America, vol. 106, no 12, , p. 4929–34 (PMID 19255438, PMCID 2660744, DOI 10.1073/pnas.0812308106, Bibcode 2009PNAS..106.4929G)
- « Progestins can mimic, inhibit and potentiate the actions of androgens », Pharmacology & Therapeutics, vol. 23, no 3, , p. 443–59 (PMID 6371845, DOI 10.1016/0163-7258(83)90023-2)
- Crowley et Macdonald, « Delalutin and estrogens for the treatment of advanced mammary carcinoma in the postmenopausal woman », Cancer, vol. 18, no 4, , p. 436–446 (ISSN 0008-543X, PMID 14278040, DOI 10.1002/1097-0142(196504)18:4<436::AID-CNCR2820180407>3.0.CO;2-D)
- « The effect of progesterone on myometrial contractility, potassium channels, and tocolytic efficacy », Reproductive Sciences, vol. 16, no 11, , p. 1052–61 (PMID 19602723, DOI 10.1177/1933719109340926)
- Perry T. Cupps, Reproduction in Domestic Animals, Elsevier, , 101– (ISBN 978-0-08-057109-6, lire en ligne)
- « Non-genomic progesterone actions in female reproduction », Human Reproduction Update, vol. 15, no 1, , p. 119–38 (PMID 18936037, DOI 10.1093/humupd/dmn044)
- « Revisiting the roles of progesterone and allopregnanolone in the nervous system: resurgence of the progesterone receptors », Progress in Neurobiology, vol. 113, , p. 6–39 (PMID 24172649, DOI 10.1016/j.pneurobio.2013.09.004)
- « The importance of 'awareness' for understanding fetal pain », Brain Research. Brain Research Reviews, vol. 49, no 3, , p. 455–71 (PMID 16269314, DOI 10.1016/j.brainresrev.2005.01.006)
- « The emergence of human consciousness: from fetal to neonatal life », Pediatric Research, vol. 65, no 3, , p. 255–60 (PMID 19092726, DOI 10.1203/PDR.0b013e3181973b0d, lire en ligne) :
« [...] the fetus is sedated by the low oxygen tension of the fetal blood and the neurosteroid anesthetics pregnanolone and the sleep-inducing prostaglandin D2 provided by the placenta (36). »
- « Pharmacology and placental transport of 17-hydroxyprogesterone caproate in singleton gestation », American Journal of Obstetrics and Gynecology, vol. 207, no 5, , p. 398.e1–8 (PMID 22967833, PMCID 3586341, DOI 10.1016/j.ajog.2012.08.015)
- « Pharmacokinetics of 17-hydroxyprogesterone caproate in multifetal gestation », American Journal of Obstetrics and Gynecology, vol. 205, no 1, , p. 40.e1–8 (PMID 21620357, PMCID 3165062, DOI 10.1016/j.ajog.2011.03.028)
- Pharmacology of the Endocrine System and Related Drugs: Progesterone, Progestational Drugs and Antifertility Agents, vol. II, Pergamon Press, , 245–273 p. (ISBN 978-0080168128, OCLC 278011135), « Orally Active Progestational Compounds. Human Studies: Effects on the Utero-Vaginal Tract »
- « Observations of the role of progestational agents in human gynecologic disorders and pregnancy complications », Ann. N. Y. Acad. Sci., vol. 71, no 5, , p. 727–52 (PMID 13583829, DOI 10.1111/j.1749-6632.1958.tb46803.x, Bibcode 1958NYASA..71..727B)
- (de) « Die perorale wirksamkeit synthetischer gestagene », Zentralbl Gynakol, vol. 79, no 14, , p. 529–39 (PMID 13443471)
- « Hydroxyprogesterone caproate oral - Lipocine - AdisInsight »
- « 770: Pharmacokinetics and tolerability of oral 17-hydroxyprogesterone caproate (HPC) relative to intramuscular (IM) HPC. », American Journal of Obstetrics & Gynecology, vol. 212, no 1, , S374 (DOI 10.1016/j.ajog.2014.10.976)
- « Pharmacokinetics of Hydroxyprogesterone Caproate and its Primary Metabolites during Pregnancy », AJP Reports, vol. 8, no 2, , e106–e112 (PMID 29765789, PMCID 5951785, DOI 10.1055/s-0038-1639331)
- « Comparative Bioavailability of Hydroxyprogesterone Caproate Administered via Intramuscular Injection or Subcutaneous Autoinjector in Healthy Postmenopausal Women: A Randomized, Parallel Group, Open-label Study », Clinical Therapeutics, vol. 39, no 12, , p. 2345–2354 (PMID 29191450, DOI 10.1016/j.clinthera.2017.10.020)
- https://www.accessdata.fda.gov/drugsatfda_docs/label/2011/021945s000lbl.pdf
- Pharmacology of the Endocrine System and Related Drugs: Progesterone, Progestational Drugs and Antifertility Agents, vol. II, Pergamon Press, , 13–24 p. (ISBN 978-0080168128, OCLC 278011135), « Effects, Duration of Action and Metabolism in Man »
- « Steroid-protein interactions. Human corticosteroid binding globulin: some physicochemical properties and binding specificity », Biochemistry, vol. 20, no 21, , p. 6211–8 (PMID 7306509, DOI 10.1021/bi00524a047)
- « Transport of steroid hormones: binding of 21 endogenous steroids to both testosterone-binding globulin and corticosteroid-binding globulin in human plasma », The Journal of Clinical Endocrinology and Metabolism, vol. 53, no 1, , p. 58–68 (PMID 7195404, DOI 10.1210/jcem-53-1-58)
- « Treatment of persistent acne in women with 17 alpha hydroxyprogesterone caproate (delalutin); a preliminary report », The Journal of Investigative Dermatology, vol. 31, no 5, , p. 247–50 (PMID 13598928, DOI 10.1038/jid.1958.114)
- Santhosh, C. R. (2006). Pharmacokinetics of 17α-Hydroxy Progesterone Caproate in Cattle, Buffalo, Sheep and Goat (Doctoral dissertation, Karnataka Veterinary, Animal and Fisheries Sciences University, Bidar). http://krishikosh.egranth.ac.in/handle/1/68575
- The Dictionary of Drugs: Chemical Data: Chemical Data, Structures and Bibliographies, Springer, , 664– (ISBN 978-1-4757-2085-3, lire en ligne)
- Jürgen Engel, Axel Kleemann, Bernhard Kutscher et Dietmar Reichert, Pharmaceutical Substances, 5th Edition, 2009: Syntheses, Patents and Applications of the most relevant APIs, Thieme, , 677–679 p. (ISBN 978-3-13-179275-4, lire en ligne)
- William Andrew Publishing, Pharmaceutical Manufacturing Encyclopedia, Elsevier, , 1865–1866 p. (ISBN 978-0-8155-1856-3, lire en ligne)
- Karl Junkmann, Hedwig Langecker et Leonore Damrosch, Die Gestagene, Springer-Verlag, , 1–44 p. (ISBN 978-3-642-99941-3, DOI 10.1007/978-3-642-99941-3_1, lire en ligne), « Chemie der Gestagene » :
« 3. Hydroxyprogesteron-caproat. C27H4004, Mol.-Gew.: 428,62; chemische Bezeichnung Δ4-Pregnen-17α-ol-3,20-dion-17α-capronat, Trivialnamen: Hydroxyprogesteroncapronat, 17α-Hydroxyprogesteron-17α-capronat. Synthese: [88]. Darstellung: [88]. Eigenschaften: weißes kristallines Pulver (aus Isopropyläther) oder Methanol, F.: 119-122⁰, [α]D: +60⁰ (Chlf.) UV-Absorption: λmax.: 240 mμ, ε = 17000. Dipolmoment: [μ = 2,21 (Benzol). Leicht löslich in Äthanol, Äther, Essigester, Benzol, Chloroform, löslich in: Petroläther, unlöslich in Wasser. Bei 20⁰ lösen 100 ml Sesamöl ca. 4,0 g, Ricinusöl ca. 2,5 g, Ricinusöl: Benzylbenzoat (4: 6) ca. 26,5 g, Benzylbenzoat ca. 36,0 g. [...] Abb. 3. IR-Spektrum [126] und Formel des Hydroxyprogesteron-caproat. »
- Junkmann, « Über protrahiert wirksame Gestagene », Naunyn-Schmiedebergs Archiv für Experimentelle Pathologie und Pharmakologie, vol. 223, no 3, (DOI 10.1007/BF00246995)
- « Comparative activity of progestational agents on the human endometrium and vaginal epithelium of surgical castrates », Annals of the New York Academy of Sciences, vol. 71, no 5, , p. 599–616 (PMID 13583817, DOI 10.1111/j.1749-6632.1958.tb46791.x, Bibcode 1958NYASA..71..599W) :
« In the group of new parenteral progestational agents, three substances developed by Karl Junkmann1,2 are the most outstanding and interesting: 17a-hydroxyprogesterone caproate and 17a-hydroxyprogesterone acetate, introduced in 1953, and the most potent of all new parenteral progestational agents, 17-ethynyl-19-nortestosterone enanthate, introduced in 1956. »
- ACRH, U.S. Dept. of Energy, (lire en ligne), p. 71 :
« [The] minimal activity [of 17(a)-hydroxyprogesterone] is magnified to an unexpected degree by the esterification of this steroid with caproic acid to produce 17(a)-hydroxyprogesterone-17-n-caproate, first reported by Karl Junkmann in 1954.6,7 »
- Ralph Isadore Dorfman, Methods in Hormone Research, Academic Press, (lire en ligne), p. 86 :
« Junkmann (1954) reported that the acetate, butyrate, and caproate forms had both increased and prolonged activity, [...] »
- Norman Applezweig, Steroid Drugs, Blakiston Division, McGraw-Hill, , 101–102 p. (lire en ligne) :
« Junkmann of Schering, AG., however, was able to show that long chain esters of 17a-hydroxyprogesterones such as the 17a-caproate produced powerful long-acting progestational effect. This compound is marketed in the United States as Delalutin by Squibb, and has been heavily used for the treatment of habitual abortion. »
- New and Nonofficial Drugs, Lippincott, (lire en ligne), p. 662 :
« Supplied by.—E. R. Squibb & Sons (Delalutin). Year of introduction: 1956. »
- Pharmacology of hormones, Thieme, (ISBN 978-3-13-518901-7, lire en ligne), p. 105 :
« Progesterone itself is now almost never used for the management of any imminent threat to pregnancy. For oral therapy, it is in any event unsuitable and for injections, it has now been replaced by the long-acting esters of 17α-hydroxyprogesterone. The caproate (Proluton, Delalutin), a long-acting ester, is available in [...] Progesterone is rarely used therapeutically. It has largely been superseded by a long-acting ester of 17α-hydroxyprogesterone, for parenteral therapy. »
- FDA press release regarding Makena approval
- « Medication safety is still an issue in obstetrics 50 years after the Kefauver-Harris amendments: the case of progestogens », Ultrasound in Obstetrics & Gynecology, vol. 42, no 3, , p. 247–53 (PMID 23495199, DOI 10.1002/uog.12456)
- Martindale: The Complete Drug Reference, London, Pharmaceutical Press, , 2110–2111 p. (ISBN 978-0-85369-840-1), « Sex hormones and their modulators »
- (en) « Price of preterm birth medicine cut », Associated Press, (lire en ligne, consulté le )
- Antibiotic Medicine and Clinical Therapy, (lire en ligne), p. 249
- Mokhtar K. Toppozada, Long-Acting Contraception, , 93–103 p. (OCLC 35018604, lire en ligne), « Monthly Injectable Contraceptives »
- « The clinical use of monthly injectable contraceptive preparations », Obstetrical & Gynecological Survey, vol. 32, no 6, , p. 335–47 (PMID 865726, DOI 10.1097/00006254-197706000-00001)
- Thomas L. Dao, Antineoplastic and Immunosuppressive Agents, , 170–192 p. (ISBN 978-3-642-65806-8, DOI 10.1007/978-3-642-65806-8_11), « Pharmacology and Clinical Utility of Hormones in Hormone Related Neoplasms »
- Crowley et Macdonald, « Clinical trial of Delalutin in the treatment of advanced mammary carcinoma in postmenopausal women », Cancer, vol. 15, no 6, , p. 1218–1220 (ISSN 0008-543X, PMID 14024037, DOI 10.1002/1097-0142(196211/12)15:6<1218::AID-CNCR2820150619>3.0.CO;2-Y)
- « Objective remission of metastatic breast carcinoma in a male who received 17-alpha hydroxy progesterone caproate (Delalutin) », Cancer Chemotherapy Reports, vol. 14, , p. 77–81 (ISSN 0069-0112, PMID 13897631)
- Crowley et MacDonald, « Delalutin und Östrogene als Behandlung des vorgeschrittenen Mammakarzinoms bei Frauen nach der Menopause », Gynäkologisch-geburtshilfliche Rundschau, vol. 3, no 4, , p. 271–272 (ISSN 1018-8843, DOI 10.1159/000266855)
- (de) « Zur additiven Therapie des metastasierenden Mamma-Karzinoms unter Berücksichtigung des Postmenopausalaltes (Ergebnisse einer randomisierten Studie) », Strahlentherapie, vol. 152, no 3, , p. 235–47 (ISSN 0039-2073, PMID 968923)