Hexafluorophosphate
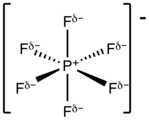
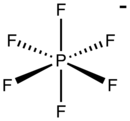
Les hexafluorophosphates sont des composés chimiques contenant l'anion de formule PF6−, base conjuguée de l'acide hexafluorophosphorique HPF6. L'anion hexafluorophosphate PF6− présente une géométrie octaédrique et est isoélectronique avec l'hexafluorure de soufre SF6 et le dianion hexafluorosilicate SiF62−, ainsi qu'avec l'anion fluoroantimoniate SbF6−. L'atome de phosphore y est présent à l'état d'oxydation +5.
| Hexafluorophosphate | |
  |
|
| Structure et représentation tridimensionnelle de l'anion hexafluorophosphate | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.111.656 |
| No CE | 605-543-2 |
| PubChem | 9886 |
| ChEBI | 30201 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | PF6− |
| Masse molaire[1] | 144,964 181 ± 5,0E−6 g/mol F 78,63 %, P 21,37 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
L'anion hexafluorophosphate est faiblement nucléophile, étant également faiblement coordinant. Il est susceptible de se décomposer en libérant du fluorure d'hydrogène dans les liquides ioniques[2], mais est généralement très stable en solution. L'hydrolyse est très lente, même dans les acides concentrés chauffés[3] et encore plus lente en milieu basique[4]. Il est un peu plus stable à l'oxydation anodique que l'anion tétrafluoroborate BF4− et l'anion perchlorate ClO4−[5]. La solubilité des hexafluorophosphates suit celle des perchlorates. Par exemple, l'hexafluorophosphate de potassium KPF6 et l'hexafluorophosphate de tétraméthylammonium NMe4PF6 sont faiblement solubles dans l'eau tandis que l'hexafluorophosphate de sodium NaPF6, l'hexafluorophosphate d'ammonium NH4PF6 et les hexafluorophosphates de métaux alcalino-terreux sont très solubles dans l'eau[6].
Les hexafluorophosphates de métaux alcalins comme le sodium et le potassium ainsi que l'hexafluorophosphate d'ammonium peuvent être préparés en faisant réagir les chlorures ou les fluorures correspondants avec l'acide fluorhydrique HF et le pentachlorure de phosphore[7] PCl5 :
La réaction des fluorures, par exemple du fluorure de potassium KF et du fluorure de césium CsF, avec le trifluorure de phosphore (en) PF3, donne également l'hexafluorophosphate correspondant[7] :
Il est également possible de faire réagir de l'hexachlorophosphazène (NPCl2)3 avec du fluorure d'hydrogène HF pour obtenir de l'hexafluorophosphate d'ammonium[7] NH4PF6 :
Les hexafluorophosphates de nitrosonium NOPF6 et de nitronium NO2PF6 peuvent être préparés en faisant réagir du pentabromure de phosphore PBr5 et du trifluorure de brome BrF3 avec respectivement du chlorure de nitrosyle NOCl et du dioxyde d'azote NO2.
La réaction de l'hexafluorophosphate d'argent AgPF6 avec des halogénures permet également de produire des hexafluorophosphates. Les halogénures d'argent forment des précipités qui permettent à la réaction de se poursuivre. Dans la mesure où les sels d'hexafluorophosphate sont souvent insolubles dans l'eau mais solubles dans les solvants organiques polaires, l'addition d'hexafluorophosphate d'ammonium à des solutions aqueuses de nombreux sels inorganiques donne des précipités solides de sels d'hexafluorophosphate. C'est par exemple le cas de la synthèse de sels de rhodocénium[8] :
Articles connexes
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Paul J. Dyson, Tilmann J. Geldbach, Metal Catalysed Reactions in Ionic Liquids, Springer Science & Business Media, 2006, p. 27. (ISBN 978-1-4020-3915-7)
- (en) Allen E. Gebala et Mark M. Jones, « The acid catalyzed hydrolysis of hexafluorophosphate », Journal of Inorganic and Nuclear Chemistry, vol. 31, no 3, , p. 771-776 (DOI 10.1016/0022-1902(69)80024-2, lire en ligne)
- (en) In Sung Chun, Sung Jin Moon, Young Mee Na, Young-A. Lee, Kyung Ho Yoo et Ok-Sang Jung, « Selective and sensitive recognition of hexafluorophosphate via an unusual equilibrium between a cationic square host and a PF6− guest », Inorganic Chemistry Communications, vol. 10, no 9, , p. 967-970 (DOI 10.1016/j.inoche.2007.05.008, lire en ligne)
- (en) Ole Hammerich et Bernd Speiser, Organic Electrochemistry, 5e édition, CRC Press, 2015, p. 326. (ISBN 978-1-4200-8402-3)
- (en) Arthur D. F. Toy, The Chemistry of Phosphorus, Pergamon Texts in Inorganic Chemistry, Elsevier, 1973, p. 537. (ISBN 978-1-4831-4741-3)
- (en) J. H. Simons, Fluorine Chemistry, Elsevier, 2012, p. 56. (ISBN 0-323-14724-0)
- (en) David R. Baghurst, D. Michael, P. Mingos et Michael J. Watson, « Application of microwave dielectric loss heating effects for the rapid and convenient synthesis of organometallic compounds », Journal of Organometallic Chemistry, vol. 368, no 3, , C43-C45 (DOI 10.1016/0022-328X(89)85418-X, lire en ligne)