Acide hexafluorophosphorique
L'acide hexafluorophosphorique est un composé chimique de formule HPF6. Comme de nombreux acides forts, il n'est stable qu'en solution jusqu'à environ 75 %, qu'on trouve typiquement de 50 % à 60 % dans le commerce. Dans l'eau, on le trouve sous forme de cations hydronium H3O+ et d'anions hexafluorophosphate PF6−. Ces derniers sont des anions non coordinants. Les solutions aqueuses d'acide hexafluorophosphorique contiennent également des composés dérivés par hydrolyse des liaisons P–F, comme l'acide difluorophosphorique HPO2F2, l'acide fluorophosphorique H2PO3F, l'acide phosphorique H3PO4 et leur base conjuguée[3].
| Acide hexafluorophosphorique | |
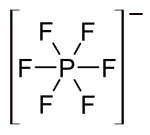 |
|
| Structure de l'acide hexafluorophosphorique | |
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.037.263 |
| No CE | 241-006-5 |
| PubChem | 16211447 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore miscible avec l'eau[1] |
| Propriétés chimiques | |
| Formule | HF6P |
| Masse molaire[2] | 145,972 12 ± 8,0E−5 g/mol H 0,69 %, F 78,09 %, P 21,22 %, |
| Précautions | |
| SGH[1] | |
  Danger |
|
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
L'acide hexafluorophosphorique se décompose par chauffage en libérant du fluorure d'hydrogène HF. Il peut former un clathrate hexahydraté dans lequel les anions PF6− sont à l'intérieur d'une cage formée de molécules d'eau et de protons. La spectroscopie RMN montre que cette structure contient une proportion significative de d'acide fluorhydrique HF[3].
On peut obtenir de l'acide hexafluorophosphorique anhydre par réaction du fluorure d'hydrogène HF sur le pentafluorure de phosphore PF5[4] dans l'éther diéthylique (CH3CH2)2O.
Une autre voie de synthèse fait intervenir le pentachlorure de phosphore PCl5 à 110 °C :
L'acide hexafluorophosphorique aqueux peut être obtenu notamment en faisant réagir (1) du pentoxyde de phosphore P4O10 avec du fluorure d'hydrogène HF, (2) de l'acide phosphorique H3PO4 avec du fluorure d'hydrogène HF, ou (3) de l'acide phosphorique H3PO4 avec du fluorure de calcium CaF2 et de l'acide sulfurique H2SO4 :
- P4O10 + 24 HF → 4 HPF6 + 10 H2O ;
- H3PO4 + 6 HF → HPF6 + 4 H2O ;
- H3PO4 + 3 CaF2 + 3 H2SO4 → HPF6·4H2O + 3 CaSO4.
L'acide hexafluorophosphorique est utilisé en recherche ou pour des applications techniques, par exemple comme catalyseur de photopolymérisation.
Notes et références
- Entrée « Hexafluorophosphoric acid » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 7 juin 2018 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) D. W. Davidson et S. K. Garg, « The Hydrate of Hexafluorophosphoric Acid », Revue canadienne de chimie, vol. 50, no 21, , p. 3515-3520 (DOI 10.1139/v72-565, lire en ligne)
- (en)George A. Olah, G. K. Surya Prakash, Arpad Molnar et Jean Sommer, Superacid Chemistry, 2e édition, p. 44, Wiley-Interscience, Hoboken, États-Unis, 2009. (ISBN 978-0-471-59668-4)
