Diclofénac
Le diclofénac est un dérivé arylacétique, produit qui entre dans la classe des anti-inflammatoires non stéroïdiens (AINS) et qui est largement diffusé dans la pharmacopée mondiale sous diverses appellations.
| Diclofénac | |
| |
| Identification | |
|---|---|
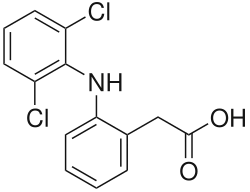
| Nom UICPA | acide 2-[2-(2,6-dichlorophenyl)aminophényl]éthanoïque |
| No CAS | |
| No ECHA | 100.035.755 |
| No CE | 239-348-5 |
| Code ATC | D11, M01, M02, S01 |
| PubChem | 3033 |
| SMILES | |
| InChI | |
| Apparence | Solide |
| Propriétés chimiques | |
| Formule | C14H11Cl2NO2 [Isomères] |
| Masse molaire[1] | 296,149 ± 0,017 g/mol C 56,78 %, H 3,74 %, Cl 23,94 %, N 4,73 %, O 10,8 %, |
| pKa | 4.15 [2] |
| Propriétés physiques | |
| T° fusion | 283 à 285 °C |
| Solubilité | 2,37 mg·l-1 (eau, 25 °C)[2] |
| Écotoxicologie | |
| DL50 | 6.11 ± 2.48 mg/L (D. rerio embryo) (144h)[3] |
| LogP | 4,51 [2] |
| Données pharmacocinétiques | |
| Biodisponibilité | 100 % |
| Demi-vie d’élim. | 1 à 2 heures |
| Excrétion |
biliaire 99 % |
| Considérations thérapeutiques | |
| Voie d’administration | Orale, injectable (IM), rectale ou application cutanée |
| Unités du SI et CNTP, sauf indication contraire. | |
Au Canada, aux États-Unis, en Grèce et au Royaume-Uni, il est commercialisé sous le nom de Pennsaid, un produit développé par la compagnie canadienne Nuvo Research. En France, au Canada et aux États-Unis, il est aussi commercialisé sous le nom Voltaren (ou Voltarène) par GlaxoSmithKline.

Il a été très utilisé en médecine vétérinaire, mais suscite des controverses en raison de sa rémanence environnementale, à partir des cadavres d'animaux d'élevage (de vaches en particulier[4]). Il a ainsi intoxiqué de nombreux vautours et animaux nécrophages, conduisant certaines espèces au bord de la disparition[5] - [6] - [7] au Pakistan notamment[8] et sur tout le sous-continent indien[9] - [10] — cas de l'extinction des vautours en Inde — où les vautours jouent un rôle sanitaire important en éliminant rapidement les cadavres.
Présentation
- Topique cutané acide
- Comprimé
- Granulés solubles
- Forme injectable (intramusculaire)
- Suppositoire
- Timbre transdermique ou patch
Indications
Anti-inflammatoires, antirhumatismaux non stéroïdiens (code ATC : M01AB05). Le diclofénac est un anti-inflammatoire non stéroïdien dérivé de l'acide phénylacétique du groupe des acides arylcarboxyliques. Il est prescrit en cas de douleurs liées à des inflammations articulaires, à de l'arthrose ou en cas de sciatique. Il possède les propriétés suivantes :
- activité antalgique ;
- activité antipyrétique ;
- activité anti-inflammatoire ;
- inhibition de courte durée des fonctions plaquettaires.
L'ensemble de ces propriétés est lié à une inhibition de la synthèse des prostaglandines.
Effets secondaires
Ils sont essentiellement digestifs et sont communs aux autres anti-inflammatoires non stéroïdiens. La prise de diclofénac augmente le risque de survenue de maladies cardiovasculaires et d'insuffisance cardiaque[11]. Ainsi, le risque d'incident cardiovasculaire de personnes qui commencent leur traitement à base de diclofénac augmente de 50 % par rapport à celles qui ne prennent rien[12].
Effets indésirables possibles
- Accident thrombotique artériel
- Infarctus aigu du myocarde
- Accident vasculaire cérébral
- Flatulence
- Stomatite ulcérative
- Douleur abdominale
- Méléna
- Hématémèse
- Leucopénie
- Agranulocytose
- Thrombopénie
- Purpura thrombopénique
- Aplasie médullaire
- Anémie hémolytique
- Choc anaphylactique
- Réaction anaphylactoïde
- Bronchospasme
- Pneumopathie d'hypersensibilité
- Vascularite
- Purpura allergique
- Hypotension
- Insomnie
- Irritabilité
- Céphalée
- Étourdissement
- Vertige
- Somnolence
- Paresthésie
- Convulsions
- Tremblement
- Méningite aseptique
- Bourdonnement d'oreille
- Asthénie
- Vision trouble
- Diplopie
- Insuffisance cardiaque
- Œdème
- Hypertension artérielle
- Nausée
- Vomissement
- Diarrhée
- Dyspepsie
- Anorexie
- Crampe abdominale
- Douleur épigastrique
- Éructation
- Ulcère gastroduodénal
- Perforation digestive
- Hémorragie digestive
- Rectite
- Colite hémorragique
- Exacerbation de rectocolite hémorragique
- Exacerbation de maladie de Crohn
- Exacerbation de colite ulcéreuse
- Pancréatite
- Constipation
- Irritation locale
- Anite
- Élévation des transaminases
- Hépatite
- Ictère
- Hépatite fulminante
- Éruption cutanée
- Urticaire
- Syndrome de Stevens-Johnson
- Syndrome de Lyell
- Dermatose bulleuse
- Eczéma
- Alopécie
- Réaction de photosensibilisation
- Rétention hydrosodée
- Hyperkaliémie
- Insuffisance rénale aigüe
- Néphrite interstitielle
- Nécrose tubulaire aigüe
- Syndrome néphrotique
- Nécrose papillaire
Contre-indications
- Au-delà de cinq mois de grossesse révolus.
- Antécédents d'allergie ou d'asthme déclenchés par la prise de diclofénac ou de substances d'activité proche, telles qu'autres AINS, aspirine.
- Hypersensibilité à l'un des excipients.
- Ulcère gastroduodénal en évolution.
- Insuffisance hépatocellulaire sévère.
- Insuffisance rénale sévère.
- Insuffisance cardiaque sévère non contrôlée.
- Enfant de moins de 16 kg, en raison du dosage inadapté de ce médicament.
- Antécédents de rectites ou de rectorragies (contre-indication liée à la voie d'administration) : suppositoires à 25 mg et à 100 mg.
- Troubles de l'hémostase ou traitement anticoagulant en cours ; contre-indication liée à la voie intramusculaire (solution injectable à 25 mg·ml-1).
En France, l'Agence nationale de sécurité du médicament et des produits de santé (ANSM) indique le 22 août 2013 que les évaluations menées en 2012-2013 par le Comité des médicaments à usage humain (CHMP) contre-indiquent le diclofénac « chez les patients atteints d’insuffisance cardiaque avérée, de cardiopathie ischémique, d’artériopathie périphérique et/ou de maladie vasculaire cérébrale » et recommande que le traitement ne soit instauré qu'« après une évaluation du rapport bénéfice/risque chez les patients présentant des facteurs de risque cardiovasculaires (hypertension artérielle, hyperlipidémie, diabète sucré et tabagisme)[13] - [14]. »
Métabolisme
Le diclofénac est métabolisé rapidement et pratiquement totalement, essentiellement au niveau du foie. L'excrétion est à la fois urinaire et fécale. La demi-vie d'élimination plasmatique du diclofénac inchangé se situe autour de 1 à 2 heures. La clairance plasmatique totale est d'environ 263 ml·min-1.
Médecine vétérinaire et écotoxicologie
Le diclofénac était largement utilisé pour le bétail en Asie du Sud dans les années 1990 ; son emploi a mené plusieurs espèces de vautours à la quasi-extinction comme le cas de l'extinction des vautours en Inde[5], ce qui a secondairement provoqué de graves problèmes sanitaires (prolifération des chiens errants et épidémie de rage…). Le diclofénac a aussi presque fait disparaitre le vautour de l’espèce Gyps en Asie du Sud[15].
L'ONU, via le PNUE a encadré la signature d'un Mémorandum d’Entente sur la conservation des oiseaux de proie migrateurs d’Afrique et d’Eurasie, qui « souligne le nombre important de rapaces migrateurs d’Afrique-Eurasie ayant un statut de conservation défavorable au niveau régional et/ou mondial résultant de l’empoisonnement qui, dans certains cas, est lié au braconnage d’espèces menacées telles les éléphants et les rhinocéros ».
Et un Groupe de travail sur les vautours a été créé pour préparer un Plan d’action Vautours relatif à la conservation des 15 espèces de vautours migratrices du ‘vieux monde’ en vue du rétablissement d'un état de conservation favorable pour ces espèces avant 2029 (plan adopté par la Résolution 12.10)[16].
Parmi les mesures visant à essayer de freiner en Asie la régression des vautours figurent des « restaurants pour vautours » qui sont des aires de nourrissage où les administrations et les éleveurs peuvent venir déposer les cadavres jugés assez « sains » pour les nourrir à moindre risque[17]. Un problème similaire existe en Afrique[18]. Les vautours fauves et percnoptères pyrénéens sont également menacés par ce médicament utilisé en Espagne[19].
Teneurs maximales en résidus
Des résidus peuvent être présents dans la viande ou le lait. L'EMAE a pour l'Europe mis à jour ses recommandations en février 2009 pour les bovins et porcs[20] :
- chez les bovins, les résidus de diclofénac ne devraient pas dépasser 5 μg/kg dans le muscle, 5 μg/kg dans le gras, 5 μg/kg dans le foie, 10 μg/kg dans le rein, 0,1 μg/kg dans le lait ;
- chez le porc, les résidus de diclofénac ne devraient pas dépasser 5 μg/kg dans le muscle, 1 μg/kg dans le gras et/ou la peau, 5 μg/kg dans le foie, 10 μg/kg dans le rein.
Étymologie
Le nom « diclofénac » est dérive de son nom chimique : acide 2-(2,6-dichloranilino) phénylacétique. Il a d'abord été synthétisé par Alfred Sallmann et Rudolf Pfister, introduit sous le nom de Voltaren par Ciba-Geigy (aujourd'hui Novartis) en 1973[21].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Diclofénac », sur ChemIDplus, consulté le 3 septembre 2009
- Praskova, Eva & Voslarova, Eva & Siroka, Z & Plhalova, Lucie & Macova, S & Maršálek, Petr & Pistekova, V & Svobodova, Z. (2011). "[Assessment of diclofenac LC50 reference values in juvenile and embryonic stages of the zebrafish (Danio rerio)]". Polish journal of veterinary sciences. 14. 545-9. 10.2478/v10181-011-0081-0.
- Green, R. E., Taggart, M. A., Das, D., Pain, D. J., Sashi Kumar, C., Cunningham, A. A., & Cuthbert, R. (2006). Collapse of Asian vulture populations: risk of mortality from residues of the veterinary drug diclofenac in carcasses of treated cattle, Journal of Applied Ecology, 43(5), 949-956.
- « Néphrologie Les reins de vautour ne tolèrent pas le diclofénac » [PDF] (consulté le ), p. 3.
- hultz, S., Baral, H.S., Charman, S., Cunningham, A.A., Das, D., Ghalsasi, G.R., Goudar, M.S., Green, R.E., Jones, A., Nighot, P., Pain, D.J. and Prakash, V. 2004. Diclofenac poisoning is widespread in declining vulture populations across the Indian subcontinent. Proc. Roy. Soc. Lond. B (Suppl.) doi 10.1098/rsbl.2004.0223
- Green, R.E., Newton, I., Shultz, S., Cunningham, A.A., Gilbert, G.,Pain, D.J. and Prakash, V. 2004. Diclofenac poisoning as a cause of vulture population declines across the Indian subcontinent, Journal of Applied Ecology 41: 793-800.
- Oaks, J. L., Gilbert, M., Virani, M. Z., Watson, R. T., Meteyer, C. U., Rideout, B. A., ... & Khan, A. A. (2004). http://www.2ndchance.info/goutdiclofenacNature.pdf Diclofenac residues as the cause of vulture population decline in Pakistan], Nature, 427(6975), 630-633.
- Shultz, S., Baral, H. S., Charman, S., Cunningham, A. A., Das, D., Ghalsasi, G. R., ... & Prakash, V. (2004). Diclofenac poisoning is widespread in declining vulture populations across the Indian subcontinent. Proceedings of the Royal Society of London. Series B: Biological Sciences, 271(Suppl 6), S458-S460.
- Green, R. E., Newton, I. A. N., Shultz, S., Cunningham, A. A., Gilbert, M., Pain, D. J., & Prakash, V. (2004). Diclofenac poisoning as a cause of vulture population declines across the Indian subcontinent, Journal of Applied Ecology, 41(5), 793-800.
- Coxib and traditional NSAID Trialists Collaboration, Vascular and upper gastrointestinal effects of non-steroidal anti-inflammatory drugs: meta-analyses of individual participant data from randomised trials, Lancet, 2013;382769-779
- (en) Morten Schmidt, Henrik Toft Sørensen, Lars Pedersen, « Diclofenac use and cardiovascular risks: series of nationwide cohort studies », British Medical Journal, vol. 362, (DOI 10.1136/bmj.k3426).
- « Médicament : l’ANSM restreint l’utilisation du diclofénac », sur www.lequotidiendumedecin.fr, (consulté le )
- « Diclofénac par voie orale ou injectable Nouvelles restrictions d’utilisation liées à une augmentation du risque de thrombose artérielle - Point d'Information », sur ansm.sante.fr, (consulté le )
- ONU (2020) Convention sur les espèces migratrices ; UNEP/CMS/Résolution 11.15 (Rev.COP13) Prévenir l'empoisonnement des oiseaux migrateurs ; adoptée par la Conférence des Parties lors de sa 13e réunion (Gandhinagar, février 2020) https://www.cms.int/sites/default/files/document/cms_cop13_res.11.15_rev.cop13_f.pdf.
- https://www.cms.int/sites/default/files/document/cms_cop13_res.11.15_rev.cop13_f.pdf
- (en) Martin Gilbert, Richard T. Watson, Shakeel Ahmed, Muhamad Asim et Jeff A. Johnson, « Vulture restaurants and their role in reducing diclofenac exposure in Asian vultures », Bird Conservation International, vol. 17, no 1, , p. 63-77 (ISSN 0959-2709, e-ISSN 1474-0001, DOI 10.1017/S0959270906000621, lire en ligne).
- Naidoo, V., Wolter, K., Cuthbert, R., & Duncan, N. (2009). "Veterinary diclofenac threatens Africa’s endangered vulture species", Regulatory Toxicology and Pharmacology, 53(3), 205-208.
- https://reporterre.net/Un-medicament-toxique-menace-la-survie-des-vautours-en-France
- Summary opinion∗of the committee for medicinal products for veterinary use on the establishment of maximum residue limits, Diclofénac, EMEA
- (en) Altman, Roy, Bosch, Bill, Brune, Kay, Patrignani, Paola et Young, Clarence, « Advances in NSAID Development: Evolution of Diclofenac Products Using Pharmaceutical Technology », Drugs, vol. 75, no 8, , p. 859–877 (DOI 10.1007/s40265-015-0392-z, lire en ligne, consulté le )
Annexes
Articles connexes
- Extinction des vautours en Inde
- Compendium suisse des médicaments : spécialités contenant Diclofénac