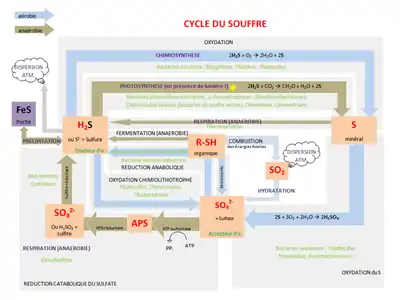
Cycle du soufre
Le cycle du soufre est le cycle biogéochimique des différentes formes du soufre. Le soufre est un élément essentiel à la vie qui, comme le carbone, le phosphore, l'oxygène, l'azote ou encore l'eau, possède son propre cycle de vie. En effet, le soufre est présent partout sur Terre, atmosphère, océans, continents, mais aussi chez tous les êtres vivants sous forme de molécules organiques : les acides aminés soufrés constituants de protéines (méthionine et cystéine)[1] - [2] - [3] - [4].
Dans l'atmosphère, on rencontre le soufre sous forme de gaz : dioxyde de soufre (SO2), hydrogène sulfuré (H2S) ; de soufre réduit comme dans le diméthylsulfure (DMS) dont la formule est CH3SCH3 et le carbonyle de sulfure (COS) ; ainsi que dans les sulfates volatils (SO42−). Le SO2 et l'H2S proviennent de la minéralisation de la matière organique selon le pH du milieu ou du métabolisme de certaines bactéries (ex: Désulfovibrio spp.). Les volcans participent au cycle en produisant d'énormes quantités de sulfates (SO4) qui viennent s'ajouter aux sulfates issus du COS. La teneur en soufre atmosphérique peut influencer le climat planétaire par le biais des volcans car certains composés soufrés sont à la base des gouttes de pluies (formation des nuages) et peuvent également refléter une partie du rayonnement solaire. De plus, lorsque l'oxyde de soufre s'associe à l'humidité de l'air, se produit une libération d'acide sulfurique et d'acide nitrique qui retombent ensuite lors des précipitations : ce sont les pluies acides[1] - [2] - [3] - [4].
Dans le sol, le soufre se rencontre à l'état minéral, en grande quantité, dans les schistes bitumineux, charbon et hydrocarbures, ainsi que sous forme de sulfites et sulfates, indispensables à la croissance des végétaux. Les minéraux tels que la pyrite (FeS2) sont également riches en soufre ; ils se sont formés lors de phases sédimentaires et pourront être réintroduits dans le cycle par l'érosion et le volcanisme[1] - [2] - [3] - [4].
Dans l'océan, le soufre se rencontre en majorité sous forme de sulfates dissous SO42−, qui seront assimilés par des organismes, et entreront dans la composition de molécules organiques, ou sédimenteront sur les fonds. Le COS est produit en partie par l'érosion continentale, et s'échappe dans l'atmosphère par la surface des océans[1] - [2] - [3] - [4].
Cependant, au XXIe siècle, l'Homme, de par ses activités, produit la majorité des flux de soufre sur la planète, notamment en brûlant les combustibles fossiles tels que le pétrole et le charbon. À court terme, ce cycle n'est pas vraiment fermé, si on considère l'enfoncement des roches sédimentaires contenant du soufre dans le manteau magmatique lors d'une subduction. Ces roches pourront être réutilisées par le volcanisme à long terme[3]
Les principales étapes du cycle du soufre sont :
- la minéralisation du soufre organique en une forme inorganique : le sulfure d'hydrogène (H2S).
- l'oxydation des sulfures, du soufre élémentaire (S) et de ses composés connexes en sulfates (SO42−).
- la réduction des sulfates en sulfures.
- l'immobilisation microbienne des composés soufrés et leur incorporation dans une forme organique du soufre.
Relations avec les autres cycles
Dans les couches terrestres, la zone de réduction des sulfates par les microorganismes est comprise entre la zone méthanogène et la zone de réduction du fer lorsqu'une source de carbone existe dans le sol. Le cycle du soufre peut interagir avec ces deux cycles. Le cycle du soufre produit de l’H2S lors de la réduction catabolique du soufre sous forme de SO42−. Le H2S, produit par exemple dans un milieu dulçaquicole, va piéger le fer sous forme de FeS2. Dans ce milieu type, le piégeage du fer va bloquer le cycle du phosphore, car le fer ne pourra plus piéger le phosphate. Le phosphate non-piégé se traduit souvent par une prolifération des algues, et est déterminant dans le phénomène d’eutrophisation.
Le soufre sous sa forme réduite H2S est un donneur d’électron utilisé par les bactéries phototrophes non productrices d’oxygène (ex: les bactéries vertes et bactéries pourpres sulfureuses).
Les bactéries méthanogènes entrent en compétition avec les bactéries réduisant le sulfate : la réduction du SO42− est énergétiquement plus favorable que celle du méthane. Ainsi, en milieu naturel, s’il y a plus de SO42− que de méthane, on observera plutôt un développement des bactéries sulfitoréductrices que des méthanogènes. De plus, les rejets de SO42− par les activités humaines ont une influence sur le cycle du méthane. En effet, SO42− diminue la production de méthane, réduisant ainsi le méthane atmosphérique qui joue un rôle important sur l'augmentation de l'effet de serre. De ce fait, SO42− peut être utilisé pour réduire l’effet de serre[5].
Anaérobie : Oxydation photolithotrophe
L'oxydation photolitotrophe est réalisée en milieu anaérobie par les phototrophes (bactéries pourpres sulfureuses et bacteries vertes sulfureuses). Elles utilisent le CO2 comme source de carbone et le H2S comme source d'hydrogène pour la photosynthèse.Ces bactéries font une photosynthèse dite anoxygénique réduisant le CO2 par le H2S. En conditions anaérobies, le H2S cède des électrons au CO2, le produit étant le soufre élémentaire : 2H2S + CO2 → CH2O + H2O +2S.
Cette réaction est endergonique : elle utilise la lumière comme source d'énergie.
Aérobie : Réduction anabolique des sulfates
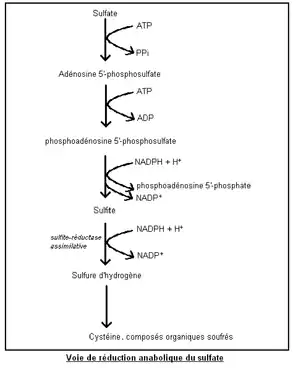
La réduction anabolique des sulfates SO42− est utilisée dans la biosynthèse des acides aminés et des protéines. Elle s’effectue en milieu aérobie, soit dans des sédiments ou sols mouillés et oxygénés. Elle est appelée réduction assimilative (ou assimilatrice) par opposition à la réduction catabolique des sulfates, dite dissimilatrice, se déroulant en milieu anaérobie.
La réduction aérobie des sulfates est dite anabolique car elle consomme de l’énergie (sous forme d’ATP ou NADPH + H+) afin de permettre l’incorporation par réduction d’une molécule inorganique (ici le sulfate) dans la matière organique.
Les sulfates sont réduits en sulfures pour permettre la synthèse des acides aminés soufrés (cystéine et méthionine) ou encore de coenzymes [6]. Les plantes, mais également des bactéries sulfatoréductrices aérobies, permettent cette réduction anabolique[7].
La réduction aérobie des sulfates est très complexe. Elle nécessite son activation par la formation de 3'-phosphoadénosine 5'-phosphosulfate suivie de sa réduction en sulfite SO32−. Puis celui-ci est directement réduit en sulfure d'hydrogène H2S par la sulfite-réductase assimilative[7].
La cystéine peut alors être synthétisée à partir de H2S (chez les plantes et les bactéries) en deux étapes, la sérine étant le précurseur de la cystéine :
- Dans un premier temps, l'acétylsérine est formée à partir de l'acétyl-CoA dont le groupement acétyle est transféré à la sérine.
- Dans un second temps, H2S déplace le groupement acétyle pour former la cystéine[8].
Après sa synthèse, la cystéine participe à l’élaboration d’autres molécules organiques contenant du soufre. Ainsi, le soufre est réintroduit dans la matière organique[7].
Aérobie : oxydation chimiolithotrophe
Le soufre organique du sol est minéralisé plus ou moins rapidement sous forme de sulfure d'hydrogène (H2S) par de nombreux microorganismes en milieu anaérobie. Le sulfure d'hydrogène (H2S) résultant de cette réaction est oxydé en milieu aérobie pour donner des sulfates sous l'action de bactéries chimiolithotrophes. Les bactéries chimiolithotrophes sulfooxydantes sont des organismes hautement spécialisés, n'entrant pas en compétition avec les bactéries hétérotrophes car ne dépendant pas d'une source de carbone organique. Il existe beaucoup de bactéries oxydant le soufre dans le groupe b des protéobactéries, dont un genre principal : Thiobacillus. Thiobacillus est un petit bacille Gram négatif, pouvant supporter des pH extrêmement acides. On retiendra surtout Thiobacillus denitrificans, qui est une bactérie anaérobie facultative, pouvant vivre en présence ou absence d'O2.
Anaérobie : Réduction catabolique du SO42−
Dès lors, sans oxygène, Thiobacillus denitrificans oxyde les composés du soufre à l'aide des nitrates (NO32−) et libère l'azote à l'état gazeux (N2).
La respiration anaérobie est caractérisée par un accepteur final sous la forme d'un composé minéral autre que l'oxygène (nitrate, sulfate, fer, CO2, soufre).
L'oxydation du soufre permet de produire de l'énergie pour les synthèses et la maintenance cellulaire.
On identifie deux types de réactions :
5 S2O32− + 8 NO32− + H2O → 10 SO42− + 2 H+ + 4 N2 5 S4O62− + 14 NO32− + 8 H2O → 20 SO42− + 16 H+ + 7 N2
Les réactifs de l'oxydation sont : H2S (sulfure d'hydrogène), S (soufre), S2O32− (thiosulfate), S4O62− (tétrathionate). Les produits de l'oxydation sont : SO42− (sulfate) et N2 (diazote).
La réduction catabolique du soufre
Le soufre est un élément essentiel à la vie. À l’origine de la Terre, le soufre était contenu dans les roches ignées, principalement dans la pyrite (FeS2). Le dégazage de la croûte terrestre a transféré à l’océan une grande quantité de soufre sous forme d'ions sulfate (SO42−) et à l’atmosphère sous forme de dioxyde de soufre (SO2), tétroxyde de soufre (SO4), sulfure de diméthyle (CH3SCH3) et COS. Les activités anthropiques contribuent à augmenter la teneur en soufre dans les réservoirs. Voir article Drainage minier acide.
Le cycle du soufre comprend 2 phases, l’une aérobie et l’autre anaérobie. Pendant la phase anaérobie s’effectue la réduction catabolique qui produit du sulfure à partir des sulfates.
L’entrée du soufre dans les synthèses biologiques ne se fait qu’à l’état le plus réduit ; en fonction de cette contrainte, les organismes ne peuvent utiliser le sulfate qu’après réduction à raison de 8 électrons par mole. Ces réductions sont pratiquées à deux fins :
- L’assimilation : elle prépare le soufre sous une forme directement utilisable par le métabolisme cellulaire.
- La dissimilation : l’ion sulfate ou des entités intermédiaires font office d’accepteur d’électrons dans une respiration anaérobie.
Lors de la réduction catabolique qui correspond à la dissimilation, l’accepteur d’électrons est le sulfate SO42− et le donneur d’électrons est le dihydrogène H2. Les produits réduits obtenus sont le sulfure H2S et l’eau H2O. Bilan :
SO42− + 4 H2 + 2 H+ → H2S + 4 H2O
Les organismes responsables de la réduction catabolique sont des bactéries appelées sulfatoréductrices. On estime que ce phénomène date de 3,47 milliards d’années du fait de la présence de traces de sulfure et de carbone organiques dans les veines de Barytine (formées à l’origine du gypse). Les bactéries sulfatoréductrices sont pour la plupart hyperthermophiles et vivent à plus de 80 °C ; celles qui n’appartiennent pas aux archéobactéries sont appelées thermosulfobacterium. C’est ce qui explique leur présence dans des milieux à température élevée (sources d’eau chaudes des abysses, régions volcaniques). Les autres réducteurs de sulfate vivent au-dessus de 70 °C. Ce sont principalement des eubactéries gram négatif, flagellées ou non (exemple : Desulfovibrio spp., Desulfobacter spp., Desulfococcus spp.). Les sulfato-réductrices tirent leur énergie de l’oxydation de différents substrats par le sulfate et le sulfite. Un des substrats les plus courants est l’hydrogène, son emploi comme donneur d’électrons fait appel à une hydrogénase couplée à un système d’accepteur par un cytochrome interposé. Cet hydrogène peut être fourni par l’acétate, le lactate, les acides gras et des composés aromatiques.
Les bactéries qui utilisent l’hydrogène comme donneur d’électrons peuvent se subdiviser en deux groupes selon qu’ils assimilent le CO2 ou pas. On distingue alors les chimioautotrophes (assimilent le CO2) et les chimiohétérotrophes (assimilent les sources carbonées).
La réduction du sulfate des milieux marins ou côtiers a une importance majeure dans le cycle naturel du soufre et actionne un recyclage non négligeable de la matière organique. Des milieux continentaux et eaux douces, le sulfate étant plus rare, les organismes sulfatoréducteurs sont en compétition avec d’autres espèces anaérobies, notamment avec les acétogènes et les méthanogènes.
Nomenclature
H2SO4 : acide sulfurique ; H2SO3 : acide sulfureux ; HSO4− : ion hydrogénosulfate ; HSO3− : ion hydrogénosulfite ; SO42− : ion sulfate ; H2S : acide sulfhydrique ; HS− : ion hydrogénosulfure ; S2− : ion sulfure[9].
Notes et références
- (fr) http://crdp.ac-amiens.fr/edd/air/air_maj_detail_p1_4.htm
- (fr) http://www.unifa.fr
- (fr) Écosystème, 3e édition, Dunod
- (fr) Précis d'écologie, 8e édition, Dunod
- article de Joshua Schimel, Université de Californie.
- Vie microbienne du sol et production végétale, de Pierre DAVET, 1996, éd. QUAE.
- Sources : http://www.ifremer.fr/envlit/glossaire/index.php?p=definition&num=1225 ; Microbiologie, de Lansing M. Prescott, John P. Harley, Donald A. Klein, 2003, éd De Boeck University ; Écologie, De Robert E. Ricklefs, Gary L. Miller, 2005, éd De Boeck University
- Cours Cycle azote metabolisme acides amines uree urea Enseignement et recherche Biochimie Emmanuel Jaspard Universite Angers
- Toute la chimie 2e période (2004) BALOU D., FABRITIUS E., GILLES A., Ellipses, Paris