Chlorure d'indium(III)
Le chlorure d'indium(III) est un composé chimique d'indium et de chlore et de formule brute InCl3. Il peut être appréhendé comme un sel ionique ainsi que nous le montre sa structure à l'état solide ou bien comme un composé moléculaire comme le suggère son nom IUPAC, « trichloroindigane ». Il se présente sous la fome d'un sel incolore lorsqu'il est monocristallin ou blanc lorsqu'il est polycristallin.
| Chlorure d'indium(III) | |||
-chlorid.png.webp)
| |||
| __ In3+ __ Cl− | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | trichloroindigane | ||
| Synonymes |
Trichlorure d'indium |
||
| No CAS | (.4H2O) |
||
| No ECHA | 100.032.500 100.030.027, 100.032.500 | ||
| No CE | 233-043-0 | ||
| No RTECS | NL1400000 | ||
| PubChem | 24812 | ||
| SMILES | |||
| InChI | |||
| Apparence | poudre hygroscopique[1] | ||
| Propriétés chimiques | |||
| Formule | InCl3 | ||
| Masse molaire[2] | 221,177 ± 0,009 g/mol Cl 48,09 %, In 51,91 %, |
||
| Propriétés physiques | |||
| T° fusion | 586 °C[1] | ||
| T° ébullition | 800 °C[1] | ||
| Solubilité | eau : 661 g·l-1 à 22 °C[3] éthanol : 532 g·l-1 à 22 °C[3] |
||
| Masse volumique | 3,46 g·cm-3[1] - [4] à 25 °C[4] | ||
| Précautions | |||
| SGH[1] - [4] | |||
  |
|||
| Transport[1] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Il est notamment utilisé en synthèse organique comme acide de Lewis.
Propriétés
Le chlorure d'indium(III) forme des cristaux blancs et hygroscopiques facilement sublimables[5]. Le point de fusion est donné à 586 °C et le point de sublimation à 418 °C [6]. L'équation d'Antoine qui donne la pression de vapeur saturante en fonction de la température est pour, InCl3, de la forme ln(P) = −A/T+B, avec P, la pression en Torr, T, la température en K et les paramètres A = 8086 ± 168 et B = 12,654 dans l'intervalle de température de 489 K à 564 K (216 à 291 °C)[7]. La chaleur de sublimation est de 154 kJ·mol-1[7]. En phase gazeuse, le chlorure d'indium(III) est sous forme de dimères, In2Cl6.
Le trichlorure d'indium anhydre réagit violemment avec l'eau et s'hydrolyse (protolyse) rapidement[8] C'est le composé d'indium le plus soluble[9].
En solution avec de l'acide chlorhydrique, InCl3 étant un acide de Lewis, forme avec les ions chlorure, qui sont des ligands donneurs, des complexes hexachloro, [InCl6]3− et aquopentachloro [InCl5(H2O)]2−[6] - [10].
Le chlorure d'indium(III) fondu (liquide) est un conducteur électrique[10]. InCl3 réagit avec de l'indium métallique à haute température pour former des chlorures d'indium de valence inférieure comme In5Cl9, In2Cl3 et InCl[10].
Structure
InCl3, à l'état solide, a une structure cristalline monoclinique isotypique à celle du chlorure d'aluminium(III) et de groupe d'espace C2/m avec les paramètres suivants : a = 64,1 pm, b = 111,0 pm, c = 63,1 pm et ß = 109°48'[3]. Ainsi comme donc AlCl3 et TlCl3, la structure d'InCl3 consiste en l'empilement selon l'axe c de couches constituées de rangements très compacts d'ions chlorures encadrant une couche d'ions In3+ ayant une géométrie de coordination octaédrique[10]. Ce motif est semblable à celui observé dans le chlorure d'yttrium, YCl3[11].
Synthèse
L'indium est un métal relativement électropositif. Chauffé, il brûle dans le gaz dichlore pour donner le trichlorure anhydre.
- In solide cristal + 3/2 Cl2 gaz chlore → InCl3 poudre blanche
Le chlorure d'indium peut être également obtenu anhydre par réaction d'un mélange d'oxyde d'indium(III), In2O3 et de charbon actif dans un courant de dichlore[5] - [8].
Le trichlorure d'indium peut également être préparé en dissolvant de l'indium dans de l'acide chlorhydrique[8]. La forme tétrahydrate de celui-ci est cristallisée à partir de solutions aqueuses[8].
Une autre synthèse publiées utilise une cellule électrochimique avec une mélange méthanol/benzène comme solution (solvant)[12]. Enfin, une autre voie de synthèse passe par la réaction de l'oxyde d'indium(III) avec du chlorure de thionyle à 300 °C[3]:
Utilisation
Dans une solution anhydre de diéthyl éther, InCl3 réagit avec de l'hydrure de lithium, LiH, pour former LiInH4, un composé instable qui se décompose au-dessous de 0 °C[13], et qui réagit donc in situ comme réducteur en synthèse organique[14] pour préparer des amines tertiaires et des adduits phosphine-InH3.
Le triméthylindium, InMe3 peut être produit par la réaction d'InCl3 en solution dans l'éther diéthylique avec un réactif de Grignard (organomagnésien mixte), l'iodure de méthylmagnésium (MeMgI) ou avec du méthyllithium (LiCH3). Le triéthylindium peut être de la même façon obtenu avec le bromure d'éthylmagnésium (EtMgBr), un autre réactif de Grignard[15] :
- InCl3 + 3LiMe → Me3In.OEt2 + 3LiCl
- InCl3 + 3MeMgI → Me3In.OEt2 + 3MgClI
- InCl3 + 3EtMgBr → Et3In.OEt2 + 3MgBr2
L'éther peut être éliminé par chauffage à 25 °C sous vide.
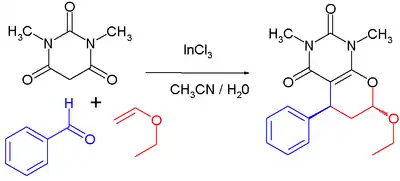
Un autre usage important du trichlorure d'indium en synthèse organique est celui d'un catalyseur acide de Lewis dans des acylations de Friedel-Crafts et des réactions de Diels-Alder. Un exemple d'une telle réaction se déroule à température ambiante, avec une charge de catalyseur de 1 % molaire et dans un mélange acétonitrile-eau[16]. La première étape est une condensation de Knoevenagel entre l'acide barbiturique et l'aldéhyde, la seconde est une réaction de Diels-Alder à demande électronique inverse qui est une réaction à plusieurs constituants, l'acide N,N'-diméthylbarbiturique (en noir), le benzaldéhyde (en bleu) et l'éthyle vinyle éther (en rouge):
Avec InCl3 comme catalyseur, le rendement chimique publié est de 90 % et le pourcentage d'isomère trans est de 70 %. Sans le catalyseur, le rendement baisse à 65 % avec 50 % de produit trans.
Par ailleurs, Le chlorure d'indium(III) est aussi utilisé en médecine nucléaire et pour la production de sulfure d'indium (pour les cellules solaires CIGS).
Notes et références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Indium(III) chloride » (voir la liste des auteurs).
- (fr) Indium(III) chloride, ultra dry, 99.999% chez Alfa Aesar.
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) Georg Brauer, Handbuch der Präparativen Anorganischen Chemie. 3., Band I, 1975, Enke, Stuttgart, 1975, p.867. (ISBN 3-432-02328-6).
- Fiche Sigma-Aldrich du composé Indium(III) chloride, anhydrous, powder, ≥99.999%, consultée le 22/06/2014.
- F. Noel, Indium and Indium Compounds, Ullmann's Encyclopedia of Industrial Chemistry, 2012, Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim. DOI 10.1002/14356007.a14_157
- A.F. Holeman, E. Wiberg, Lehrbuch der Anorganischen Chemie, 1985, Walter de Gruyter, Berlin, New York, p. 891.
- F.J. Smith, R.F. Barrow, The heats of sublimation of inorganic substances. Part 6: Some halides of gallium and indium, Trans. Faraday Soc., 1958, vol.54, pp. 826–829. DOI 10.1039/TF9585400826.
- L. Kolditz, Anorganische Chemie, VEB Deutscher Verlag der Wissenschaften, Berlin, 1983, p. 355.
- Araki, S., Hirashita, T., Indium trichloride in Encyclopedia of Reagents for Organic Synthesis, Ed: L. Paquette, 2004, J. Wiley & Sons, New York. DOI 10.1002/047084289.
- Egon Wiberg, Arnold Frederick Holleman, Inorganic Chemistry, 2001, Elsevier. (ISBN 0123526515)
- A.F. Wells, Structural Inorganic Chemistry, 1984, Clarendon Press, Oxford. (ISBN 0-19-855370-6).
- Habeeb, J. J., Tuck, D. G., Electrochemical Synthesis of Indium(III) Complexes, Inorganic Syntheses, 1979, vol. XIX. (ISBN 0-471-04542-X).
- Anthony John Downs, Chemistry of aluminium, gallium, indium, and thallium, 1993, Springer. (ISBN 0-7514-0103-X)
- Hisashi Yamamoto, Koichiro Oshima, 'Main Group Metals in Organic Synthesis, vol. 1, 2004, Wiley VCH. (ISBN 3527305084)
- Schultz, Neumayer, Marks, Main Group compounds, Inorganic Syntheses, 1997, vol. 31, John Wiley & Sons. (ISBN 0471152889)
- Prajapati, D., Mukut Gohain, M., An efficient synthesis of novel pyrano[2,3-d]- and furopyrano[2,3-d]pyrimidines via Indium-Catalyzed Multicomponent Domino Reaction, Beilstein Journal of Organic Chemistry, 2006, vol. 2(11). DOI 10.1186/1860-5397-2-11