Oxyde de gallium(III)
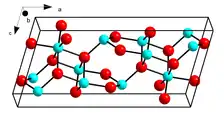
L’oxyde de gallium(III) est un composé chimique de formule Ga2O3. Il s'agit d'un solide blanc ou incolore cristallisé selon plusieurs structures polymorphes. La plus stable est le β-Ga2O3, cristallisé dans le système monoclinique selon le groupe d'espace C2/m (no 12) avec pour paramètres a = 1 223,2 pm, b = 304,1 pm, c = 580,1 pm, β = 103,73° et Z = 4[6]. Il existe également une forme α-Ga2O3 trigonale (R3c, no 167) semblable au corindon (α-Al2O3) stable à plus haute pression avec pour paramètres a = 498,25 pm, c = 1 343,3 pm et Z = 6[7].
| Oxyde de gallium(III) | |
| |
| __ Ga __ O Structure cristalline de l'oxyde de gallium(III) β |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.031.525 |
| No CE | 234-691-7 |
| PubChem | 5139834 |
| Apparence | poudre blanche inodore[1] |
| Propriétés chimiques | |
| Formule | Ga2O3 |
| Masse molaire[2] | 187,444 ± 0,003 g/mol Ga 74,39 %, O 25,61 %, |
| Propriétés physiques | |
| T° fusion | β : 1 740 °C[3] α : 1 900 °C[1] |
| Solubilité | pratiquement insoluble dans l'eau[1] |
| Masse volumique | β : 5,88 g/cm3[3] α : 6,44 g/cm3[1] à 20 °C |
| Cristallographie | |
| Système cristallin | β : monoclinique α : trigonal |
| Symbole de Pearson | β : mS20 α : hR30 |
| Classe cristalline ou groupe d’espace | β : C2/m (no 12) [4] α : R3c (no 167) [5] |
| Notation Schönflies | β : C3 2h ; α : D6 3d. |
| Paramètres de maille | polymorphe β : a = 1 223,2 pm, b = 304,1 pm, c = 580,1 pm, β = 103,73°, Z = 4[6]. polymorphe α : a = 498,25 pm, c = 1 343,3 pm, Z = 6[7]. |
| Précautions | |
| NFPA 704[3] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse et polymorphes
L'oxyde de gallium(III) peut être obtenu en déshydratant l'hydroxyde de gallium(III) à 500 °C[8] :
Il est également possible de procéder par décomposition du nitrate de gallium Ga(NO3)3 à 200 °C. Ces deux voies donnent des polymorphes différents, qui finissent par redonner la forme β plus stable à température plus élevée.
Les cinq polymorphes connus de l'oxyde de gallium(III) sont les suivants :
- α-Ga2O3 — Stable à haute pression, il peut être obtenu en chauffant le β-Ga2O3 sous 65 kbar à 1 100 °C. Il a une structure de type corindon(α-Al2O3). L'hydrate peut être préparé en décomposant l'hydroxyde de gallium précipité à 500 °C. Il est possible d'épitaxier des couches minces d'α-Ga2O3 sur des substrats de saphir orientés selon leur plan c (0001), leur plan m (10-10) ou leur plan a (11-20).
- β-Ga2O3 — Stable dans les conditions normales de température et de pression, il peut être déposé par hétéroépitaxie sous forme de couches minces sur des substrats tels que le saphir, le GaN, le SiC et le Si, ainsi que par homoépitaxie. On a par exemple réalisé l'ALD sur des substrats de saphir à des températures comprises entre 190 et 550 °C[9]. Des films de β-Ga2O3 de haute qualité ont également été produits par MBE, HVPE (en) et MOCVD[10]. La technique HVPE est préférée pour les dispositifs à semiconducteurs de puissance verticaux en raison de son taux de croissance rapide[11]. Les couches épitaxiales de β-Ga2O3 déposées par MOCVD présentent une meilleure mobilité électronique et une moindre concentration résiduelle de porteurs que celles obtenues par d'autres techniques de croissance de couches minces[12] - [13].
- γ-Ga2O3 — De structure spinelle altérée[14] semblable à celle du γ-Al2O3[15], il est obtenu par chauffage rapide du gel d'hydroxyde à une température de 400 à 500 °C. Une forme plus cristalline de ce polymorphe peut être préparée directement à partir de gallium métallique par synthèse solvothermale (en)[16].
- δ-Ga2O3 — De structure cubique centrée[17] - [18], il est obtenu en chauffant le Ga(NO3)3 à 250 °C[19].
- ε-Ga2O3 — De structure orthorhombique observée par cristallographie aux rayons X comme un empilement compact[20], il est obtenu en chauffant δ-Ga2O3 à 550 °C. Des couches minces d'ε-Ga2O3 peuvent être déposées par MOCVD à l'aide de triméthylgallium Ga(CH3)3 et d'eau H2O sur des substrats de saphir à des températures comprises entre 550 et 650 °C[21].
Réactions
L'oxyde de gallium(III) est amphotère[22]. Il réagit avec les oxydes de métaux alcalins à haute température pour former, par exemple, NaGaO2, et avec les oxydes de Mg, Zn, Co, Ni, Cu pour former des spinelles, comme MgGa2O4[23]. Il se dissout dans une base forte pour former une solution de l'ion gallate Ga(OH)4−.
Avec l'acide chlorhydrique HCl, il forme du trichlorure de gallium GaCl3[24] :
Il peut être réduit en oxyde de gallium(I) Ga2O par l'hydrogène H2[25] ou par réaction avec le gallium métallique[26] :
Propriétés et applications
Ga2O3 est un semiconducteur ayant une largeur de bande interdite de 4,7 à 4,9 eV susceptible de présenter un intérêt en électronique de puissance[10], pour certaines applications optoélectroniques telles que les photodétecteurs[27], comme matériau phosphorescent[28] ou encore pour des détecteurs de gaz[29]. Il présente une conductivité thermique et une mobilité électronique inférieures d'un ordre de grandeur par rapport à celles du nitrure de gallium GaN et du carbure de silicium SiC, mais il pourrait être économiquement bien plus rentable car c'est le seul semiconducteur à large bande interdite susceptible d'être produit simplement à partir de la phase liquide[10] - [30] - [31] (procédé de Czochralski[32]). Il est réputé être résistant aux rayonnements ionisants, ce qui le rend également intéressant pour les applications militaires et spatiales[33] - [34].
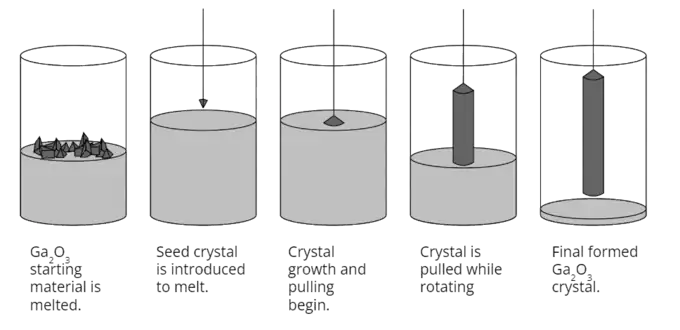 (en) Production d'un monocristal de Ga2O3 par procédé de Czochralski.
(en) Production d'un monocristal de Ga2O3 par procédé de Czochralski.
Notes et références
- Entrée « Gallium(III) oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 9 janvier 2023 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé Gallium(III) oxide, 99.99% (metals basis) », sur Alfa Aesar (consulté le ).
- D. Dohy et J. R. Gavarri, « Oxyde β-Ga2O3: Champ de force, dilatation thermique, et rigidité anisotropes », Journal of Solid State Chemistry, vol. 49, no 1, , p. 107-117 (DOI 10.1016/0022-4596(83)90222-0, Bibcode 1983JSSCh..49..107D, lire en ligne).
- (en) L. J. Eckert et R. C. Bradt, « Thermal Expansion of Alpha Ga2O3 », Journal of the American Ceramic Society, vol. 56, no 4, , p. 229-230 (DOI 10.1111/j.1151-2916.1973.tb12471.x, lire en ligne).
- (en) S. Geller, « Crystal Structure of β‐Ga2O3 », The Journal of Chemical Physics, vol. 33, no 3, , p. 676-684 (DOI 10.1063/1.1731237, Bibcode 1960JChPh..33..676G, lire en ligne).
- (en) M. Marezio et J. P. Remeika, « Bond Lengths in the α‐Ga2O3 Structure and the High‐Pressure Phase of Ga2−xFexO3 », The Journal of Chemical Physics, vol. 46, no 5, , p. 1862-1865 (DOI 10.1063/1.1840945, Bibcode 1967JChPh..46.1862M, lire en ligne).
- (de) A. F. Holleman, E. Wiberg et N. Wiberg, Lehrbuch der Anorganischen Chemie, 102e éd., Walter de Gruyter, Berlin, 2007, p. 1196. (ISBN 978-3-11-017770-1)
- (en) Elham Rafie Borujeny, Oles Sendetskyi, Michael D. Fleischauer et Kenneth C. Cadien, « Low Thermal Budget Heteroepitaxial Gallium Oxide Thin Films Enabled by Atomic Layer Deposition », ACS Applied Materials & Interfaces, vol. 12, no 39, , p. 44225-44237 (PMID 32865966, DOI 10.1021/acsami.0c08477, S2CID 221403770, lire en ligne).
- (en) Andrew J. Green, James Speck, Grace Xing, Peter Moens, Fredrik Allerstam, Krister Gumaelius, Thomas Neyer, Andrea Arias-Purdue, Vivek Mehrotra, Akito Kuramata, Kohei Sasaki, Shinya Watanabe, Kimiyoshi Koshi, John Blevins, Oliver Bierwagen, Sriram Krishnamoorthy, Kevin Leedy, Aaron R. Arehart, Adam T. Neal, Shin Mou, Steven A. Ringel, Avinash Kumar, Ankit Sharma, Krishnendu Ghosh, Uttam Singisetti, Wenshen Li, Kelson Chabak, Kyle Liddy, Ahmad Islam, Siddharth Rajan, Samuel Graham, Sukwon Choi, Zhe Cheng et Masataka Higashiwaki, « β-Gallium oxide power electronics », APL Materials, vol. 10, no 2, , article no 029201 (DOI 10.1063/5.0060327, Bibcode 2022APLM...10b9201G, S2CID 246660179, lire en ligne).
- (en) Duyoung Yang, Byungsoo Kim, Tae Hoon Eom, Yongjo Park et Ho Won Jang, « Epitaxial Growth of Alpha Gallium Oxide Thin Films on Sapphire Substrates for Electronic and Optoelectronic Devices: Progress and Perspective », Electronic Materials Letters, vol. 18, no 2, , p. 113-128 (DOI 10.1007/s13391-021-00333-5, Bibcode 2022EML....18..113Y, S2CID 245773856, lire en ligne).
- (en) J. Y. Tsao, S. Chowdhury, M. A. Hollis, D. Jena, N. M. Johnson, K. A. Jones, R. J. Kaplar, S. Rajan, C. G. Van de Walle, E. Bellotti, C. L. Chua, R. Collazo, M. E. Coltrin, J. A. Cooper, K. R. Evans, S. Graham, T. A. Grotjohn, E. R. Heller, M. Higashiwaki, M. S. Islam, P. W. Juodawlkis, M. A. Khan, A. D. Koehler, J. H. Leach, U. K. Mishra, R. J. Nemanich, R. C. N. Pilawa-Podgurski, J. B. Shealy, Z. Sitar, M. J. Tadjer, A. F. Witulski, M. Wraback et J. A. Simmons, « Ultrawide-Bandgap Semiconductors: Research Opportunities and Challenges », Advanced Electronic Materials, vol. 4, no 1, , article no 1600501 (DOI 10.1002/aelm.201600501, S2CID 38628999, lire en ligne).
- (en) Yuewei Zhang, Fikadu Alema, Akhil Mauze, Onur S. Koksaldi, Ross Miller, Andrei Osinsky et James S. Speck, « MOCVD grown epitaxial β-Ga2O3 thin film with an electron mobility of 176 cm2/V/s at room temperature », APL Materials, vol. 7, no 2, , article no 022506 (DOI 10.1063/1.5058059, Bibcode 2019APLM....7b2506Z, S2CID 104453229, lire en ligne).
- (en) Helen. Y. Playford, Alex C. Hannon, Matthew G. Tucker, Daniel M. Dawson, Sharon E. Ashbrook, Reza J. Kastiban, Jeremy Sloan et Richard I. Walton, « Characterization of Structural Disorder in γ-Ga2O3 », The Journal of Physical Chemistry C, vol. 118, no 29, , p. 16188-16198 (DOI 10.1021/jp5033806, lire en ligne).
- (en) Norman N. Greenwood et Alan Earnshaw, Chemistry of the Elements, 2e éd., Butterworth-Heinemann, 1997, p. 247. (ISBN 978-0-08-037941-8)
- (en) Helen Y. Playford, Alex C. Hannon, Emma R. Barney, Richard I. Walton, « Structures of Uncharacterised Polymorphs of Gallium Oxide from Total Neutron Diffraction », Chemistry, vol. 19, no 8, , p. 2803-2813 (PMID 23307528, DOI 10.1002/chem.201203359, lire en ligne).
- (en) Rustum Roy, V. G. Hill et E. F. Osborn, « Polymorphism of Ga2O3 and the System Ga2O3—H2O », Journal of the American Chemical Society, vol. 74, no 3, , p. 719-722 (DOI 10.1021/ja01123a039, lire en ligne).
- (en) Charles T. Prewitt, Robert D. Shannon, Donald Burl Rogers et Arthur W. Sleight, « The C rare earth oxide-corundum transition and crystal chemistry of oxides having the corundum structure », Inorganic Chemistry, vol. 8, no 9, , p. 1985-1993 (DOI 10.1021/ic50079a033, lire en ligne).
- (en) Liandi Li, Wei Wei et Malte Behrens, « Synthesis and characterization of α-, β-, and γ-Ga2O3 prepared from aqueous solutions by controlled precipitation », Solid State Sciences, vol. 14, no 7, , p. 971-981 (DOI 10.1016/j.solidstatesciences.2012.04.037, Bibcode 2012SSSci..14..971L, lire en ligne).
- (en) Ildikó Cora, Francesco Mezzadri, Francesco Boschi, Matteo Bosi, Maria Čaplovičová, Gianluca Calestani, István Dódony, Béla Pécz et Roberto Fornari, « The real structure of ε-Ga2-O3 and its relation to κ-phase », CrystEngComm, vol. 19, no 11, , p. 1509-1516 (DOI 10.1039/C7CE00123A, lire en ligne).
- (en) F. Boschi, M. Bosi, T. Berzina, E. Buffagni, C. Ferrari et R. Fornari, « Hetero-epitaxy of ε-Ga2O3 layers by MOCVD and ALD », Journal of Crystal Growth, vol. 443, , p. 25-30 (DOI 10.1016/j.jcrysgro.2016.03.013, Bibcode 2016JCrGr.443...25B, lire en ligne).
- (en) Darrell D. Ebbing et Steven D. Gammon, General Chemistry, 9e éd., 2010. (ISBN 978-0538497527)
- (en) Anthony John Downs, Chemistry of aluminium, gallium, indium, and thallium, Blackie academic and professional, 1993. (ISBN 075140103X)
- (en) J. J. Zuckerman et A. P. Hagen, Inorganic Reactions and Methods, the Formation of Bonds to Halogens, 2e partie, 2009, Wiley-VCH Verlag GmbH. (ISBN 978-0470145395)
- (en) H. Fred Koch, Luc A. Girard et D. Max Roundhill, « Determination of Gallium in a Cerium Surrogate and in Drops from a Copper Collector by ICP as Model Studies for the Removal of Gallium from Plutonium », Atomic spectroscopy, vol. 20, no 1, , p. 30-32.
- (en) N. N. Greenwood, H. J. Emeleus et A. G. Sharpe, « The chemistry of Gallium », Advances in Inorganic Chemistry and Radiochemistry, vol. 5, Elsevier, Academic Press, 1963. (ISBN 978-0080578545)
- (en) M. Pavesi, F. Fabbri, F. Boschi, G. Piacentini, A. Baraldi, M. Bosi, E. Gombia, A. Parisini et R. Fornari, « ε-Ga2O3 epilayers as a material for solar-blind UV photodetectors », Materials Chemistry and Physics, vol. 205, , p. 502-507 (DOI 10.1016/j.matchemphys.2017.11.023, lire en ligne).
- (en) Jianhua Lin, Liuyan Zhou, Yuyu Shen, Jie Fu, Yanling Chen, Lei Lei, Renguang Ye, Yang Shen, Degang Deng et Shiqing Xu, « [Zn2+–Ge4+] co-substitutes [Ga3+–Ga3+] to coordinately broaden the near-infrared emission of Cr3+ in Ga2O3 phosphors », Physical Chemistry Chemical Physics, vol. 25, no 3, , p. 2090-2097 (PMID 36562283, DOI 10.1039/D2CP04737C, S2CID 254561209, lire en ligne).
- (en) Zhifu Liu, Toshinari Yamazaki, Yanbai Shen, Toshio Kikuta, Noriyuki Nakatani et Yongxiang Li, « O2 and CO sensing of Ga2O3 multiple nanowire gas sensors », Sensors and Actuators B: Chemical, vol. 129, no 2, , p. 666-670 (DOI 10.1016/j.snb.2007.09.055, lire en ligne).
- (en) Samantha B. Reese, Timothy Remo, Johney Green et Andriy Zakutayev, « How Much Will Gallium Oxide Power Electronics Cost? », Joule, vol. 3, no 4, , p. 903-907 (DOI 10.1016/j.joule.2019.01.011, S2CID 127789383, lire en ligne).
- (en) Karen N. Heinselman, Drew Haven, Andriy Zakutayev et Samantha B. Reese, « Projected Cost of Gallium Oxide Wafers from Edge-Defined Film-Fed Crystal Growth », Crystal Growth & Design, vol. 22, no 8, , p. 4854-4863 (DOI 10.1021/acs.cgd.2c00340, lire en ligne).
- (en) Zbigniew Galazka, « Growth of bulk β-Ga2O3 single crystals by the Czochralski method », Journal of Applied Physics, vol. 131, no 3, , article no 031103 (DOI 10.1063/5.0076962, Bibcode 2022JAP...131c1103G, S2CID 246074647, lire en ligne).
- (en) D. A. Bauman, A. I. Borodkin, A. A. Petrenko, D. I. Panov, A. V. Kremleva, V. A. Spiridonov, D. A. Zakgeim, M. V. Silnikov, M. A. Odnoblyudov, A. E. Romanov et V. E. Bougrov, « On improving the radiation resistance of gallium oxide for space applications », Acta Astronautica, vol. 180, , p. 125-129 (DOI 10.1016/j.actaastro.2020.12.010, Bibcode 2021AcAau.180..125B, lire en ligne).
- (en) Steven J. Ren Pearton et Mark Fan Law, « Fundamental Studies and Modeling of Radiation Effects in beta-Gallium Oxide », sur https://apps.dtic.mil/, Defense Technical Information Center (en), (consulté le ).






