Flurbiprofène
Le flurbiprofène est un composé chimique utilisé en pharmacie. C'est un inhibiteur de la cyclooxygénase[2]. Ses propriétés anti-inflammatoires (AINS) dérivées de l'acide phénylalkanoïque traitent l'inflammation et la douleur, et sont utilisées pour lutter contre l'arthrite[3].
| Flurbiprofène | |||
-Flurbiprofen_Structural_Formulae_V.1.svg.png.webp)
| |||
| Énantiomère R du flurbiprofène (en haut) et S-flurbiprofène (en bas) | |||
| Identification | |||
|---|---|---|---|
| Nom UICPA | acide (RS)-2-(2-fluorobiphényl-4-yl)propanoïque | ||
| No CAS | |||
| No ECHA | 100.023.479 | ||
| No CE | 225-827-6 | ||
| No RTECS | DU8341000 | ||
| Code ATC | M01 M02 S01 |
||
| DrugBank | DB00712 | ||
| PubChem | 3394 | ||
| ChEBI | 5130 | ||
| SMILES | |||
| InChI | |||
| Propriétés chimiques | |||
| Formule | C15H13FO2 [Isomères] |
||
| Masse molaire[1] | 244,260 9 ± 0,013 5 g/mol C 73,76 %, H 5,36 %, F 7,78 %, O 13,1 %, |
||
| Propriétés physiques | |||
| T° fusion | 110 à 112 °C[2] | ||
| Précautions | |||
| SGH[2] | |||
 |
|||
| Transport[2] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
En France, des spécialités pharmaceutiques en contiennent comme principe actif dans des pastilles contre les maux de gorge.
Un des énantiomères (le tarenflurbil [(R)-flurbiprofène]) est actuellement dans des essais cliniques pour le traitement de cancer de la prostate métastatique.
Historique
Le flurbiprofène est un dérivé de l’acide propanoïque synthétisé pour la première fois dans les années 1960. Sa première mention, sous le nom d’acide 2-(2-fluoro-4-biphénylyl)propionique, est dans un brevet déposé en 1969 par le Dr Stewart Adams du laboratoire Boots UK et publié en 1973 . Ce brevet mentionne les activités anti-inflammatoire, analgésique et antipyrétique de la molécule[4].
En 1972, une étude clinique évalue l’efficacité du flurbiprofène comme traitement de l’arthrite rhumatoïde. Les résultats indiquent que ce principe actif semble bien toléré et non toxique pour les patients pour une prise de courte durée. L'effet du flurbiprofène est supérieur à celui obtenu par un placebo lors d'une étude en double aveugle[5]. Il est ensuite commercialisé pour la première fois en Angleterre en 1977 par le laboratoire Boots UK sous le nom de Froben[6].
En 1979, le laboratoire Boots UK commercialise le Froben en France mais ce n'est plus le cas de nos jours puisque l'autorisation de mise sur le marché de ce produit est abrogée[7].
Deux médicaments sont toujours commercialisés en France et sont prescrits pour traiter les rhumatismes, l’arthrose, les lombalgies et les règles douloureuses. On trouve le flurbiprofène en France sous le nom de Cebutid que distribue l'entreprise Boots Dacour[8] dès 1978[9], qui vend ses droits en 1995 à BASF[10], droits acquis par la suite par Shire France SA en 1999[11] et rachetés en 2007 par Almirall SAS[12]. Le laboratoire Théramex, racheté en 2010 par Teva Pharmaceutical Industries[13], commercialise cette molécule sous la dénomination Antadys dès 1984[14].
On peut retrouver sur le marché des pastilles contenant du flurbiprofène pour lutter contre les maux de gorge, notamment le Strefen mis sur le marché par Boots UK en 2000[15]. Le laboratoire Reckitt Benckiser en a racheté les droits en 2006[16].
Synthèse
Synthèse historique
La synthèse historique, décrite par Stewart Adams (en), consiste en plusieurs étapes. Elle commence par une réaction de Willgerodt-Kindler avec un mélange de 3-acétyl-2-fluorobiphényl [1] et de morpholine [2] le tout chauffé à reflux. Une réaction de déshydratation donne le composé [3], puis le composé [4] après ajout de soufre. Des réarrangements donnent successivement les composés [5], [6] et [7]. Le composé [7] est en équilibre avec sa forme tautomère, le thiomorpholide [8][17].
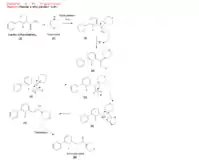
Ce thiomorpholide [8] est hydrolysé en milieu acétique par chauffage à reflux [9]. Un précipité d’acide (2-fluoro-4-biphénylyl)acétique [10] est collecté. Une réaction d'estérification de l’acide [10] permet ensuite l'obtention du (2-fluoro-4-biphénylyl)acétate d’éthyle [11]. Cet ester est mis en présence d’éthanolate de sodium qui donne l'ester pour générer le carbanion correspondant [12]. Ce dernier agit alors comme un nucléophile dans une réaction d’addition-élimination avec du carbonate de diéthyle pour donner la malonate [13], qui est déprotoné à l'aide d’éthanolate de sodium. Le carbanion correspondant [14] réagit alors avec du sulfate de diméthyle pour donner le composé méthylé [15]. La malonate [15] subit ensuite une double réaction de saponification en milieu acide pour fournir le dérivé d'acide malonique [16], qui est décarboxylé en acide 2-(2-fluoro-4-biphénylyl)propionique [17], aussi appelé flurbiprofène[18].
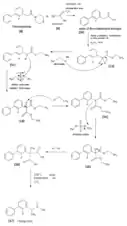
Synthèse racémique
Du bromure de (3-fluoro-4-phényl)phényle [1] est traité par du magnésium pour donner l'organomagnésien correspondant. Cet organomagnésien attaque le propanal lors d'une addition nucléophile et la fonction alcoolate secondaire ainsi formée est oxydée par de l’acide chromique pour donner de la 3-fluoro-4-phényl propiophénone [2]. L’énamine [3] est ensuite obtenue par action de pyrrolidine sur la cétone [2]. Le composé [3] est ensuite traité par de l’azoture de diphénylphosphoryle (DPPA) pour donner une amidine phosphorylée [4]. Cette amidine est hydrolysée par de l’hydroxyde de potassium pour donner rac-flubiprofène [5], le flurbiprofène racémique[19].
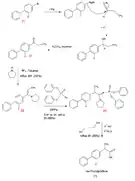
Mécanisme d'action
Le flurbiprofène, comme la plupart des AINS, est un inhibiteur réversible de la cyclooxygénase, et plus particulièrement de COX-1 et de COX-2. La molécule, non sélective, se fixe indifféremment sur les deux enzymes avec une liaison identique : elle s’engage dans le canal hydrophobe et effectue une liaison ionique entre son groupement carboxylate COO− et l’amine de Arg120 des enzymes, maintenue sous forme NH3+. De plus, il y a formation d’une liaison hydrogène entre le groupement carboxylate du flurbiprofène et Tyr355. Le groupement fluorophényle de la molécule crée des interactions de type Van der Waals avec la chaîne principale de Gly526 et de Ala527. Enfin, il y a des interactions entre le cycle du phényle du flurbiprofène et Ser530[20] - [21].
Le ligand naturel est l'acide arachidonique, qui sert de second messager dans la signalisation cellulaire. Il se détache de la membrane et s’engage dans le canal hydrophobe de COX pour être transformé en prostaglandine G2, puis en prostaglandine H2. La conséquence est une augmentation de l’inflammation[22].
Lors de la prise d’un médicament à base de flurbiprofène, le principe actif se loge dans la poche hydrophobe et empêche la fixation de l’acide arachidonique, ce qui permet de bloquer l’inflammation.
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Flurbiprofen chez Sigma-Aldrich.
- « Medical Dictionary, Houghton Mifflin Company », consulté le 21 juillet 2010
- Brevet US 3755427 "2-(mono-and difluoro-4-biphenyl)propionic acids"
- « Clinico-pharmacological studies and clinical evaluation of flurbiprofen. A new non-steroidal antirheumatic agent. », consulté le 14 mars 2015
- Pharmaceutical Manufacturing Encyclopedia sur Google Livres
- « Agence nationale de sécurité du médicament et des produits de santé », consulté le 14 mars 2015
- « Fusion de Boots et Dacour », consulté le 14 mars 2015
- « Commission de transparence de la Haute Autorité de Santé », consulté le 14 mars 2015
- « BASF boucle le rachat des medicaments de Boots », consulté le 14 mars 2015
- « Shire Pharmaceuticals Group plc, Annual report and statutory accounts for the year ended 31 December 1999 », consulté le 14 mars 2015
- « Almirall Acquires a Portfolio of Eight Products from Shire Plc for Us$213 Million (€151 Million ) », consulté le 14 mars 2015
- « Merck Serono cède Théramex à la société Teva pour 265 millions d'euros », consulté le 14 mars 2015
- « Commission de transparence de la Haute Autorité de Santé », consulté le 14 mars 2015
- « Commission de transparence de l'Agence française de sécurité sanitaire des Produits de Santé », consulté le 14 mars 2015
- « Reckitt Benckiser buys Boots unit », consulté le 14 mars 2015
- « Basé sur la réaction de Willgerodt-Kindler décrite sur www.organic-chemistry.org », consulté le 27 mars 2015
- « Flurbiprofen Comprehensive Profile », consulté le 27 mars 2015
- Brevet US 3385886 "Phenyl propionic acids"
- « Se référer au "2.3.1. MODE D'ACTION GENERAL" », consulté le 01 mai 2016
- « Pharmacologie et classification des inhibiteurs de la cyclooxygénase », consulté le 01 mai 2016
- « "...conversion of arachidonic acid to prostaglandin G2 (PGG2) and PGG2 to prostaglandin H2 (PGH2)..." », consulté le 01 mai 2016
