Oxyde de scandium
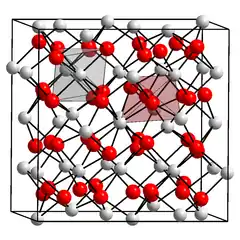
L'oxyde de scandium est un composé chimique de formule Sc2O3. Il se présente sous la forme d'une poudre blanche inodore et non combustible, pratiquement insoluble dans l'eau, cristallisée dans le système cubique avec le groupe d'espace Ia3 (no 206) et comme paramètres cristallins a = 985 pm et Z = 16. Dans cette structure, les cations Sc3+ sont coordonnés chacun à six anions O2− selon une géométrie octaédrique[3]. Son point de fusion élevé — certaines sources indiquent 2 485 °C[4] — en fait un matériau réfractaire. C'est un isolant électrique dont la largeur de bande interdite vaut 6 eV[5]. Il existe un minéral naturel extrêmement rare, la kangite (en), constitué d'oxyde de scandium substitué par des impuretés métalliques, de formule générale (Sc,Ti,Al,Zr,Mg,Ca,⋯)2O3, observée notamment dans la météorite d'Allende[6].
| Oxyde de scandium | |
| |
| __ Sc3+ __ O2− Structure cristalline de l'oxyde de scandium |
|
| Identification | |
|---|---|
| No CAS | |
| No ECHA | 100.031.844 |
| No CE | 235-042-0 |
| PubChem | 4583683 |
| SMILES | |
| InChI | |
| Apparence | solide blanc cristallisé[1] |
| Propriétés chimiques | |
| Formule | O3Sc2 |
| Masse molaire[2] | 137,91 ± 0,000 9 g/mol O 34,8 %, Sc 65,2 %, |
| Propriétés physiques | |
| T° fusion | > 1 000 °C[1] |
| Solubilité | pratiquement insoluble dans l'eau[1] |
| Masse volumique | 3,864 g·cm-3[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
L'oxyde de scandium se forme par combustion du scandium dans l'air. C'est la principale forme sous laquelle on trouve le scandium dans ses minerais. Les minéraux riches en scandium, comme la thortveitite (Sc,Y)2(Si2O7) et la kolbeckite ScPO4·2H2O sont rares, mais on trouve des traces de scandium dans de nombreux autres minéraux, de sorte que l'oxyde de scandium est un sous-produit de l'extraction de nombreux autres éléments.
L'oxyde de scandium réagit par chauffage avec la plupart des acides pour donner un hydrate. Ainsi, le chauffage d'oxyde de scandium dans un excès d'acide chlorhydrique HCl donne un hydrate de chlorure de scandium (en) ScCl3·nH2O qui peut être déshydraté par évaporation en présence de chlorure d'ammonium NH4Cl ; le mélange est ensuite purifié pour éliminer le chlorure d'ammonium par sublimation entre 300 et 500 °C[7]. Le chlorure d'ammonium est nécessaire pour stabiliser l'hydrate ScCl3·nH2O qui formerait sinon un oxychlorure mixte en séchant.
De même, la réaction avec l'acide triflique CF3SO3H donne un triflate de scandium hydraté Sc(OTf)3·nH2O[8].
Le scandium élémentaire est produit industriellement par réduction de l'oxyde de scandium. Cela se fait via la conversion en fluorure de scandium (en) ScF3 suivie de la réduction par le calcium métallique, selon un procédé semblable au procédé Kroll d'extraction du titane.
L'oxyde de scandium forme des sels appelés scandates avec les métaux alcalins, de manière semblable à l'oxyde de lutécium(III) Lu2O3 mais à l'opposé de l'oxyde d'yttrium(III) Y2O3 et de l'oxyde de lanthane La2O3. Avec l'hydroxyde de potassium KOH, il donne par exemple le scandate K3Sc(OH)6. Ceci rapproche l'oxyde de scandium de l'alumine Al2O3.
Notes et références
- Entrée « Scandium oxide » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 9 mai 2021 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Osvald Knop et Jean M. Hartley, « Refinement of the crystal structure of scandium oxide », Canadian Journal of Chemistry, vol. 46, no 8, , p. 1446-1450 (DOI 10.1139/v68-236, lire en ligne)
- « Fiche du composé Scandium(III) oxide, REacton®, 99.998% (metals basis), REM 50ppm max », sur Alfa Aesar (consulté le ).
- (en) A. V. Emeline, G. V. Kataeva, V. K. Ryabchuk et N. Serpone, « Photostimulated Generation of Defects and Surface Reactions on a Series of Wide Band Gap Metal-Oxide Solids », The Journal of Physical Chemistry B, vol. 103, no 43, , p. 9190-9199 (DOI 10.1021/jp990664z, lire en ligne)
- (en) Chi Ma, Oliver Tschauner, John R. Beckett, George R. Rossman et Wenjun Liu, « Kangite, (Sc,Ti,Al,Zr,Mg,Ca,□)2O3, a new ultra-refractory scandia mineral from the Allende meteorite: Synchrotron micro-Laue diffraction and electron backscatter diffraction », American Mineralogist, vol. 98, nos 5-6, , p. 870-878 (DOI 10.2138/am.2013.4290, Bibcode 2013AmMin..98..870M, lire en ligne)
- (en) Robert W. Stotz et Gordon A. Melson, « Preparation and mechanism of formation of anhydrous scandium(III) chloride and bromide », Inorganic Chemistry, vol. 11, no 7, , p. 1720-1721 (DOI 10.1021/ic50113a058, lire en ligne)
- (en) J. A.McCleverty et T. J. Meyer, Comprehensive Coordination Chemistry II, vol. 3, 2003, Elsevier Science, p. 99. (ISBN 0-08-043748-6)