Minéral argileux
Les minéraux argileux, ou simplement les argiles, sont des aluminosilicates hydratés de la famille des phyllosilicates. Ces minéraux sont les constituants principaux des roches argileuses et du matériau obtenu à partir de ces roches après un éventuel raffinage (ces roches et ce matériau sont également appelées argiles).
| Minéral argileux Catégorie IX : silicates[1] | |
 Exemples de kaolinite, l'un des minéraux argileux. | |
| Général | |
|---|---|
| Classe de Strunz | 9.E |
| Formule chimique | kaolinite ou halloyisite (Al2O3 · 2SiO2 · (OH)4 ou Al2(Si2O5)(OH)4 , autres silicates et phyllosilicates tels l'illite K0.65Al2[Al0.65Si3.35O10]OH, la montmorillonite (Na,Ca)0.3(Al,Mg)2Si4O10OH22. n H2O, la sépiolite Mg4Si6O15(OH)22. 6 H2O... |
| Identification | |
| Couleur | blanc, gris, jaunâtre, brunâtre, verdâtre, rose, rougeâtre, blanchâtre. Très souvent variable selon leur composition |
| Système cristallin | triclinique (kaolinite), monoclinique (montmorillonite)... |
| Clivage | parfait suivant (001) dans le plan des feuillets |
| Cassure | ? |
| Habitus | matière cryptocristalline, pulvérulent, |
| Échelle de Mohs | 1 à 2 |
| Éclat | terreux |
| Propriétés optiques | |
| Transparence | transparente à opaque |
| Propriétés chimiques | |
| Densité | 2,25 (saponite), 2,6 (kaolinite), 2 à 2,7 (montmorillonite), 2,6 à 2,9 (illite) |
| Comportement chimique | propriétés mécaniques (glaises à moulages, plasticité...) |
| Unités du SI & CNTP, sauf indication contraire. | |
Minéraux argileux
Ces derniers sont classés en trois grandes familles selon l'épaisseur des feuillets (0,7 ; 1,0 ou 1,4 nm), qui correspondent à un nombre de couches d'oxydes tétraédriques (Si) et octaédriques (Al, Ni, Mg, Fe2+, Fe3+, Mn, Na, K, etc.). L'interstice entre feuillets peut contenir de l'eau ainsi que des ions. Il en résulte des variations de la distance entre feuillets, et donc des variations dimensionnelles macroscopiques de l'argile quand elle s'hydrate (dilatation) ou s'assèche (contraction) pouvant provoquer des fissures. Un matériau sec qui contient beaucoup de minéraux argileux « happe à la langue » (absorbe de l'eau en formant une pâte plastique)[2].
Les phyllosilicates se présentent sous forme de petits cristaux micrométriques, en plaquettes hexagonales ou en (micro)fibres. Ce sont les minéraux phylliteux halloysite, kaolinite, montmorillonite, illite et bravaisite, la glauconite, les smectites, les interstratifiés comme les vermiculites, les minéraux fibreux tels que les attapulgites ou les sépiolites, enfin les chlorites et les micas, ces dernières en très petits morceaux souvent altérés pour être assimilés à des argiles[alpha 1].
L'origine est variée : altération de roches ou résidus de roches suivant des conditions locales suivant les zones d'altération des roches endogènes[alpha 2], sols à apport sédimentaire, diagenèse, éruption volcanique, météorites spécifiques. L'essor des études par rayons X (radiocristallographie, diffraction X...) a permis l'étude et la caractérisation des argiles.
Structure des minéraux argileux
Les minéraux argileux sont tous constitués à partir d'un empilement de feuillets tétraédriques et octaédriques entrecoupé par un espace appelé espace interfoliaire :
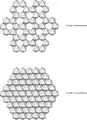
- Les feuillets tétraédriques sont agencés en mailles hexagonales et sont constitués de tétraèdres d'oxygène entourant un atome de silicium ou d'aluminium.
- Les feuillets octaédriques sont composés d'octaèdres formés par deux plans d'oxygènes-hydroxyles encadrant des atomes plus larges tels que : Al, Fe, Mg, Li, etc. Les cations constituants du feuillet octaédrique induisent, selon leur valence, une modification du taux de remplissage de la couche. Ainsi, pour une couche octaédrique purement magnésienne par exemple, constituée donc d'atomes de Mg2+, un taux de remplissage de 100 % est constitué, tous les octaèdres sont occupés, on parle d'argile trioctaédrique. À l'inverse, pour une couche octaédrique purement alumineuse par exemple, constituée donc d'atomes d'Al3+, le taux de remplissage sera au 2/3, deux octaèdres sont remplis et un est laissé vide, on parle de vacance.
- Des substitutions peuvent intervenir entre les différents atomes constituants de la couche tétraédrique ou octaédrique. Ces substitutions induisent un déficit de charge permanent, faisant de beaucoup d'argiles des espèces stablement chargées négativement. Ces charges sont compensées par l'incorporation de cations au sein de l'interfoliaire de l'argile.
- Les groupements OH− présents en bordure des argiles induisent également une capacité d'échange et d'adsorption d'espèces chargées. Ces groupements hydroxyles sont cependant dépendant du pH ainsi : À bas pH, les hydroxyles de surfaces sont entièrement protonés (OH) l'argile montre une charge de bordure globalement positive. À haut pH, les hydroxyles se déprotonent, la surface est globalement négative (O2−). On parle alors ici de charges variables. Ces dernières sont nettement moins importantes que les charges permanentes, mais jouent tout de même un rôle dans la capacité d'échange de l'argile.
- Exemple de calcul de la charge permanente : Si on considère une Kaolinite, de formule Si4Al4O10(OH)8, le bilan de charge est le suivant : 4 atomes Si4+ + 4 atomes Al3+ + 18 atomes O2− + 8 atomes H+ = . Cette argile n'a pas de charge permanente et donc aucun cation interfoliaire pour neutraliser la charge. La totalité de la capacité d'échange de cette argile est liée à ses charges variables de bordure. À l'inverse, une Montmorillonite de formule (Na)0,6(Al3.4, Mg0.6)Si8O20(OH)4·nH2O montre le bilan suivant : 8 atomes Si4+ + 3.4 atomes Al3+ + 0.6 atomes Mg2+ + 24 atomes O2− + 4 atomes H+ = ce déficit est comblé par l'incorporation de 0.6 cations monovalent, ou 0.3 cations divalent (dans l'exemple on considère Na0.6). La totalité de la capacité d'échange de cette argile est liée à ses charges permanentes ainsi qu'à ses charges de bordure.
Propriétés de gonflement et d'échange
Certaines argiles présentent la capacité d'augmenter leurs espaces interfoliaire. Cette propriété provient de l'incorporation de cations hydratés (Na, Ca, etc.) permettant de compenser les déficits de charges permanents. Ce phénomène n'existe plus si la charge de l'argile est trop forte (ex. : micas : charge totale de l'argile de -1 parfaitement contrebalancé par les cations déshydratés (K)) ou nulle (ex. : pyrophyllite, talc : charge totale de l'argile de 0, aucun cation interfoliaire). Les espèces expansibles sont celles dont la charge varie de 0,3 à 0,8 ce qui comprend la sous-classe des smectites ainsi que les vermiculites. C'est l'eau incorporée via les cations hydratés qui permet le gonflement de l'édifice cristallin. Le gonflement est d'autant plus important que l'humidité est élevée. À un état parfaitement sec, une smectite n'aura aucune molécule d'eau, la distance feuillet + interfolaire = 10 Å, comme une pyrophyllite. La distance feuillet + interfolaire d'une smectite peut ainsi aller de 10 Å à 18 Å.
Les cations compensant les charges permanentes et variables de l'argile restent, pour la plupart, échangeables dans l'environnement. chaque argile a ainsi une CEC propre témoignant de leur appartenance à une des grandes familles de minéraux argileux. À titre indicatif, les smectites ont une capacité d'échange bien plus grande que les kaolinites, car, pour ces dernières, leur capacité d'échange est uniquement dictée par les charges variables
 Différence de structure entre un feuillet octaédrique dioctaédrique et trioctaédrique.
Différence de structure entre un feuillet octaédrique dioctaédrique et trioctaédrique. Structure atomiques d'une argile TOT trioctaédrique.
Structure atomiques d'une argile TOT trioctaédrique. Structure des feuillets d'une argile TOT trioctaédrique.
Structure des feuillets d'une argile TOT trioctaédrique. Vue du feuillet tétraédrique arrangé en mailles pseudo-hexagonales.
Vue du feuillet tétraédrique arrangé en mailles pseudo-hexagonales. Vue d'un empilement de 10 feuillets.
Vue d'un empilement de 10 feuillets.
Classification des minéraux argileux
On différencie les argiles par leur type de combinaison d'empilement des feuillets tétraédriques et octaédriques, le cation de la couche octaédrique, la charge de l'argile et le type de matériel interfoliaire[3] - [4].
Les minéraux argileux se répartissent en plusieurs grandes familles :
- Les minéraux argileux dits 1:1 ou TO : Ces derniers sont constitués d'un feuillet tétraédrique surplombant une couche octaédrique. Ils présentent typiquement une taille de 7 Å (TO+interfoliaire). En fonction de la nature du feuillet octaédrique, on distingue les argiles TO à feuillet dioctaédrique (feuillet de type brucite, Mg(OH)2 ) et les argiles TO à feuillet trioctaédrique (feuillet de type gibbsite, Al(OH)3).
- Les minéraux argileux dits 2:1 ou TOT : Ces derniers sont constitués de deux feuillets tétraédriques encadrant une couche octaédrique. Ils présentent en fonction de l'espèce une taille allant de 10 Å à 18 Å (TOT+interfoliaire). Comme pour les argiles TO, on distingue les argiles TOT à feuillet dioctaédrique et les argiles TOT à feuillet trioctaédrique.
- Les minéraux argileux dits 2:1:1 ou TOT:O : Ces derniers sont constitués de deux feuillets tétraédriques encadrant une couche octaédrique, l'espace interfoliaire est rempli par un feuillet octaédrique. Ce feuillet interfoliaire octaédrique possède la même structure que la brucite, on parle dans ce cas de feuillet brucitique. Les argiles 2:1:1 présentent typiquement une taille de 14 Å (TOT+O). Ce groupe est constitué par le grand groupe des chlorites. On les classe également selon l'aspect dioctaédrique ou trioctaédrique du feuillet octaédrique et du feuillet brucitique.
Tableau récapitulatif des argiles
Nomenclature utilisée : Te = Nombre de cations Si tétraédriques par maille, Oc = charge de l'octaèdre par maille, les parenthèses indiquent le cation octaédrique.
Explication du classement : exemple d'une montmorillonite de charge 0.6 (avec sodium interfoliaire) : (Na)0,6(Al3.4, Mg0.6)Si8O20(OH)4· nH2O : La couche tétraédrique est entièrement Si ; on a donc Te=8Si, à l'inverse l'octaèdre montre (par définition) une substitution Al↔Mg on a donc le bilan des charges positives (dans cet exemple) = 3.4×3+0.6×2 = 11.4 ; or la charge parfaite de l'octaèdre d'une argile TOT est de 12. On se retrouve alors dans le cas Oc<12/12. Attention, il n'est pas rare de trouver les formules par demi-maille des argiles, la montmorillonite de l'exemple devient alors (Na)0,3(Al1.7, Mg0.3)Si4O10(OH)2· nH2O
| dioctaédrique | dioctaédrique | trioctaédrique | trioctaédrique |
| Te/Si = 4
Oc = 12/12 |
Te/Si = 4
Oc = 12/12 |
Te/Si = 4
Oc = 12/12 |
Te/Si < 4
Oc > 12/12 |
| Espacement stable | Espacement variable | Espacement stable | Espacement stable |
| Kaolinite (Al), Nacrite (Al), Dickite (Al) | Halloysite (Al) | Antigorite (Mg), Chrysotile (Mg), Lizardite (Mg, Al) | Cronstedtite (Fe2+, Fe3+), Berthiérine (Al, Fe2+), Amésite (Al, Mg) |
| Te/Si = 8 | Te/Si = 8 | Te/Si < 8 | Te/Si < 8 | Te/Si < 8 |
| Oc = 12/12 | Oc < 12/12 | Oc = 12/12 | Oc > 12/12 | Oc = 12/12 |
| Espacement stable | Espacement variable | Espacement variable | Espacement variable | Espacement stable |
| Pyrophyllite (Al) | Smectites : Montmorillonite* (Al) | Smectites : Beïdellite (Al, Fe), Nontronite (Fe3+) | Vermiculite*** (Al) | Muscovite (Al, K), Illite** (Al, K), Séricite (Al, K), Damouzite (Al, K), Paragonite (Al, Na), Glauconite (Al, Fe), Céladonite (Al, Fe) |
- Le terme « smectite » souvent utilisé de manière abusive représente l'ensemble des espèces TOZ, gonflantes, ayant une charge comprise entre -0.2 et -0.6.
- Quand Te/Si < 8 cela implique que les cations Si4+ de la couche tétraédrique sont substitués, généralement par des cations de valence inférieure (Al3+, Fe3+...), et donc cela implique l'existence d'une charge négative à la surface du feuillet (avec des cations de compensation qui sont souvent des alcalins comme Na+).
- De même, quand Oc <12/12, cela implique que les cations de la couche octaédrique (généralement Al3+ ou Fe3+) sont substitués, généralement par des cations de valence inférieure (Mg2+...), et donc cela implique également l'existence d'une charge négative à la surface du feuillet.
| * La montmorillonite, dont une forme, qui a pour formule Si4O10Al5/3Mg1/3Na1/3(OH)2, est connue sous l'appellation de « terre de Sommières » utilisée comme détachant ou comme bentonite employée en génie civil en raison de ses propriétés colloïdales (plastifiant dans les mortiers). À la différence de l'halloysite, plusieurs couches d'eau peuvent prendre place entre deux feuillets de montmorillonite et par conséquent la séparation entre deux feuillets peut aller de 0,96 nm à la séparation complète. ** L'illite (1 nm), de formule KAl2(AlSi3O10)(OH)2, possède une charge de -0.75 à -0.9. Elle peut servir à la fabrication des objets en terre cuite. La structure des illites est proche de celle des micas mais en diffère par le degré de substitution Si/Al (inférieur dans l'illite), la présence de potassium (inférieure dans l'illite) et pour un certain degré de désordre dans l'empilement des feuillets. | ||||
| Te/Si = 8 | Te/Si = 8 | Te/Si < 8 | Te/Si < 8 | Te/Si < 8 |
| Oc = 12/12 | Oc < 12/12 | Oc = 12/12 | Oc < 12/12 | Oc = 12/12 |
| Espacement stable | Espacement variable | Espacement variable | Espacement variable | Espacement stable |
| Talc (Mg), Minnésotaïte (Mg, Fe2+) | Smectites : Stevensite (Mg), Hectorite (Mg, Li) | Smectites : Saponite (Mg), Bowlingite (Mg, Fe2+), Sauconite (Mg, Zn) |
Vermiculite (Ni2+), Batavite (Mg) |
Phlogopite (Mg), Illite (Mg, Fe, K), Biotite (Mg, Fe, K), Lépidolite (Mg, Fe, K), Ledikite (Mg, Fe, K) |
| Feuillet TOT | Dioctaédrique | Dioctaédrique | Trioctaédrique | Trioctaédrique |
| Feuillet 'brucitique' O interfoliaire | Dioctaédrique | Trioctaédrique | Dioctaédrique | Trioctaédrique |
| Donbassite | Cookéite, Sudoïte | Franklinfurnacéite | Diabantite, Penninite, Chamosite, Brunsvigite, Clinochlore, Thuringite, Ripidolite, Shéridanite | |
- Le groupe Tri-Tri est le plus répandu sur terre. Les groupes Di-Tri et Di-Di sont plus rares. Le groupe Tri-Di reste encore inconnu, aucun minéral de ce type n'a encore été découvert.
Caractérisation des argiles
Diffraction des rayons X
Une des techniques utilisées pour reconnaître les argiles est l'analyse par diffraction de rayons X. Cette technique nécessite une préparation spécifique de l'échantillon. Chacune des méthodes de préparation permet d'obtenir des informations différentes sur la structure du minéral.
La préparation désorientée se fait, comme son nom l'indique, à partir d'une poudre compacte dont les constituants auront été désorientés. Plusieurs méthodes sont utilisées : la poudre arasée, le « side loading », le « back loading » ou encore le « spray-dried ». La désorientation « parfaite » d'une poudre reste une technique délicate, pouvant être fortement influencée par les éventuelles orientations préférentielles induites par certains minéraux. La poudre désorientée reste la méthode de préparation majoritairement utilisée pour l'identification des phases dans un échantillon minéral. Cette dernière permet d'obtenir l'ensemble des plans de diffraction des phases constituantes. Les argiles, quant à elles, sont plus difficilement différentiables par cette technique, car leurs plans cristallographiques sont pour beaucoup identiques d'une famille à l'autre. Les diffractogrammes montrent alors des pics superposés rendant la lecture et l'identification des phases plus complexes. Cependant, bien que présentant certains inconvénients (pour les phyllosilicates) la vision globale des plans de diffractions permet d'atteindre des paramètres tels que le taux de remplissage de la couche octaédrique, etc.
Une variante de la préparation désorientée consiste à placer la poudre dans un capillaire. Cette technique donne des résultats semblables, mais permet de travailler avec des quantités de matières bien inférieures.
La préparation de lames orientées est une méthode mise en place pour discerner les différents phyllosilicates d'un échantillon. Elle consiste à laisser sédimenter un échantillon pendant un laps de temps (loi de Stokes) donné afin d'en récupérer uniquement la fraction <2 µm, considérée comme étant la fraction renfermant la phase argileuse « pure ». Cette fraction en solution est ensuite déposée sur une lame de verre, puis séchée. Lors du séchage les particules lamellaires d'argiles vont toutes s'orienter selon leur plan cristallographique (001) (à l'image d'une pile de papier tombant à terre, toutes les pages finissent grande face vers le sol). Lorsque l'on soumet cette lame à la diffraction, on n'obtient donc que les raies 00l (c'est-à-dire 001, 002, etc.). Ces raies sont caractéristiques des grandes familles de minéraux argileux.
Dans certains cas, les pics de diffractions sont fatalement superposés. Pour différencier les argiles, on effectue alors divers traitements visant à modifier l'espace inter-feuillets : chauffage, acidification, remplacement du cation interfoliaire… En regardant l'évolution des pics de diffraction aux faibles angles selon le traitement, on peut reconnaître l'argile.
Outre en géochimie, cette technique est également utilisée par la police scientifique pour essayer de déterminer l'origine des traces de terre qui peuvent constituer un indice lors d'une enquête.
Essai au bleu de méthylène
Pour reconnaître les différents types d'argile on peut pratiquer un essai au bleu de méthylène. En dosant la concentration de bleu de méthylène après un contact avec une argile, on en déduit indirectement la CEC de cette dernière. Ce qui permet de classer globalement le minéral.
Couleurs
Les particules d'argile ne sont nullement responsables de la couleur du sol. La couleur rouge, orange, jaune, vert, bleu d'un sol (argileux ou non) est due à l'état du fer dans le sol (Fe3+ dans les trois premiers cas et Fe2+ dans les deux derniers). Lorsque le sol est d'une couleur tendant vers le blanc, c'est que cet élément a été dissous et évacué hors du profil.
Par ailleurs, argile (nom masculin) est le nom d'une couleur d'un gris neutre très pâle tirant sur le blanc.
Chimie
Dans l'eau, les particules d'argile se comportent comme des gouttes d'huile dans la vinaigrette : elles se regroupent et forment des « micelles » en suspension : on dit que l'argile est à l'état « dispersé ». La présence de sels minéraux dissous portant des charges positives (Ca, Mg, K, Na, NH4, Fe, Mn, Cr, Ti, Al, Ba, Sr…) provoque la liaison des micelles entre elles : l'argile est floculée. Cette propriété des argiles va leur permettre d'être liquides à l'état dispersé, pâteuses dans la boue et solides dans un sol sec. L'argile est un colloïde qui flocule avec des cations.
Notes et références
Notes
- On exclut ici les zéolithes car leurs structures d'assemblage restent tridimensionnelles quelles que soient leurs tailles et leurs propriétés.
- L'illite se forme en zone tempérée, la kaolinite dans les milieux tropicaux. Il existe des argiles d'altération et des argiles résiduelles.
Références
- La classification des minéraux choisie est celle de Strunz, à l'exception des polymorphes de la silice, qui sont classés parmi les silicates.
- « Identification macroscopique des minéraux et roches »(Archive.org • Wikiwix • Archive.is • Google • Que faire ?)
- (fr+en) Alain Meunier, Argiles, Springer, , 472 p. (ISBN 3-540-21667-7, lire en ligne).
- (en) Rossman F. Giese et Carel J. Van Oss, Colloid and surface properties clays and related minerals, Dekker, , 312 p. (ISBN 0-8247-9527-X).

