Méthacrylonitrile
Le méthacrylonitrile est un composé chimique de formule CH2=C(CH3)C≡N. C'est le nitrile de l'acide méthacrylique CH2=C(CH3)COOH. Il se présente sous la forme d'un liquide incolore très inflammable, à l'odeur âcre, susceptible de former des mélanges explosifs avec l'air. Il tend à polymériser sous l'effet de la chaleur et est distribué stabilisé au 4-méthoxyphénol à 50 ppm. C'est un précurseur ou un intermédiaire d'homopolymères de polyméthacrylonitrile et de copolymères de type acrylonitrile/butadiène/styrène, ainsi que de divers acides, amides, amines et esters.
| Méthacrylonitrile | |
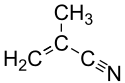
| |
| Structure du méthacrylonitrile | |
| Identification | |
|---|---|
| Nom UICPA | 2-méthylprop-2-ènenitrile |
| No CAS | |
| No ECHA | 100.004.380 |
| No CE | 204-817-5 |
| PubChem | 31368 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore très inflammable à l'odeur piquante susceptible de former des mélanges explosifs avec l'air[1] |
| Propriétés chimiques | |
| Formule | CH2=C(CH3)C≡N |
| Masse molaire[2] | 67,089 2 ± 0,003 8 g/mol C 71,61 %, H 7,51 %, N 20,88 %, |
| Propriétés physiques | |
| T° fusion | −36 °C[1] |
| T° ébullition | 90 °C[1] |
| Solubilité | 25,7 g/L[1] à 20 °C |
| Masse volumique | 0,8 g/cm3[1] à 20 °C |
| T° d'auto-inflammation | 465 °C[1] |
| Point d’éclair | −1 °C[1] |
| Limites d’explosivité dans l’air | entre 1,7 % (47 g/m3) et 13,2 % en volume (370 g/m3)[1] |
| Pression de vapeur saturante | 104 hPa[1] à 30 °C |
| Précautions | |
| SGH[1] | |
   Danger |
|
| Transport[1] | |
| Écotoxicologie | |
| DL50 | 120 mg/kg[1] (souris, oral) |
| LogP | 0,68[1] (octanol/eau) |
| Unités du SI et CNTP, sauf indication contraire. | |
Le méthacrylonitrile peut être produit par déshydratation du méthacrylamide CH2=C(CH3)CONH2 ou à partir d'ammoniac NH3 et d'oxyde d'isobutylène (CH3)2CCH2O[3]. Il est produit industriellement en faisant réagir de l'acide méthacrylique ou du méthacrylate de méthyle CH2=C(CH3)COOCH3 avec de l'ammoniac dans une réaction catalytique en phase gazeuse à des températures de 250 à 500 °C ; l'oxyde d'aluminium Al2O3 peut être utilisé comme catalyseur. Le méthacrylonitrile peut également être produit par ammoxydation à partir d'isobutylène CH2=C(CH3)2[4] :
- CH2=C(CH3)2 + NH3 + 3⁄2 O2 ⟶ CH2=C(CH3)C≡N + 3 H2O.
Le méthacrylonitrile peut polymériser dans le tétrahydrofurane (THF) avec du polyéthylène glycol disodique.
Notes et références
- Entrée « Methacrylonitrile » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 18 avril 2022 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Susan Budavari, The Merck index : an encyclopedia of chemicals, drugs, and biologicals, 12e éd., Merck, 1996, p. 1015. (ISBN 978-0911910124)
- (en) Koichi Nagai, « New developments in the production of methyl methacrylate », Applied Catalysis A: General, vol. 221, nos 1-2, , p. 367-377 (DOI 10.1016/S0926-860X(01)00810-9, lire en ligne)

