Méthacrylate de 2-éthylhexyle
Le méthacrylate de 2-éthylhexyle est un composé chimique de formule CH2=C(CH3)COOCH2CH(C2H5)CH2CH2CH2CH3. C'est l'ester d'acide méthacrylique CH2=C(CH3)COOH et de 2-éthylhexanol CH3CH2CH2CH2CH(C2H5)CH2OH. Il se présente comme un liquide combustible, incolore, peu volatil, pratiquement insoluble dans l'eau, à l'odeur douceâtre, et dont les vapeurs sont susceptibles de former des mélanges explosifs avec l'air au-dessus du point d'éclair. Il tend à polymériser et doit être conservé à moins de 35 °C dans de l'air et non sous atmosphère inerte, la présence d'oxygène étant nécessaire à sa stabilisation. Le 4-méthoxyphénol (MeHQ) à 60 ± 20 ppm est l'inhibiteur de polymérisation standard[4].
| Méthacrylate de 2-éthylhexyle | |
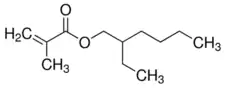
| |
| Structure du méthacrylate de 2-éthylhexyle | |
| Identification | |
|---|---|
| Nom UICPA | 2-méthylprop-2-énoate de 2-éthylhexyle |
| Synonymes |
2-EHMA |
| No CAS | |
| No ECHA | 100.010.645 |
| No CE | 211-708-6 |
| No RTECS | OZ4630000 |
| PubChem | 12713 |
| SMILES | |
| InChI | |
| Apparence | liquide combustible incolore peu volatil pratiquement insoluble dans l'eau à l'odeur douceâtre et dont les vapeurs sont susceptibles de former des mélanges explosifs avec l'air au-dessus du point d'éclair[1] |
| Propriétés chimiques | |
| Formule | CH2=C(CH3)COOC8H17 |
| Masse molaire[2] | 198,301 9 ± 0,011 7 g/mol C 72,68 %, H 11,18 %, O 16,14 %, |
| Propriétés physiques | |
| T° fusion | < −50 °C[1] |
| T° ébullition | 227,6 °C[1] |
| Solubilité | 0,003 1 g/L[1] à 20 °C |
| Masse volumique | 0,88 g/cm3[1] à 20 °C |
| T° d'auto-inflammation | 380 °C[1] |
| Point d’éclair | 92 °C[1] |
| Limites d’explosivité dans l’air | à partir de 0,6 % en volume[1] |
| Pression de vapeur saturante | 0,065 hPa[1] à 20 °C |
| Viscosité dynamique | 2,12 mm2/s[1] à 20 °C |
| Précautions | |
| SGH[1] | |
 Attention |
|
| NFPA 704[3] | |
| Écotoxicologie | |
| LogP | 4,54[1] (octanol/eau) |
| Unités du SI et CNTP, sauf indication contraire. | |
Il peut être synthétisé par oxydation catalytique de l'isobutylène CH2=C(CH3)2 et estérification ultérieure avec le 2-éthylhexanol, ou par réaction de l'acétone CH3)2C=O avec de le cyanure d'hydrogène HCN et estérification ultérieure dans l'acide sulfurique H2SO4 avec le 2-éthylhexanol[5].
Le méthacrylate de 2-éthylhexyle forme des homopolymères et des copolymères. Ces derniers peuvent être préparés notamment avec l'acide méthacrylique CH2=C(CH3)COOH et ses sels, ses amides et ses esters, ainsi qu'avec les méthacrylates, l'acrylonitrile CH2=CHC≡N, les esters d'acide maléique HOOCCH=CHCOOH, l'acétate de vinyle CH3COOCH=CH2, le chlorure de vinyle CH2=CHCl, le 1,1-dichloroéthylène CH2=CCl2, le styrène CH2=CHC6H5, le butadiène CH2=CHCH=CH2, des polyesters insaturés et des huiles siccatives. C'est également une matière première très utile pour les synthèses chimiques, car il subit facilement des réactions d'addition avec une grande variété de composés organiques et inorganiques[4].
Notes et références
- Entrée « 2-Ethylhexyl methacrylate » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 17 avril 2022 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- « Fiche du composé 2-Ethylhexyl methacrylate, 98%, stab. with 4-methoxyphenol », sur Alfa Aesar (consulté le ).
- (en) « 2-Ethylhexyl Methacrylate F (2-EHMA F) » [PDF], sur https://www.basf.com/, BASF, (consulté le ).
- (en) Eula Bingham, Barbara Cohrssen et Charles H. Powell, Patty's Toxicology, 5e éd., vol. 6, John Wiley & Sons, New York, 2001, p. 599. (ISBN 978-0471319436)
