Isosorbide
L’isosorbide est un composé hétérocyclique obtenu à partir de la double réaction de déshydratation du sorbitol, lui-même issu de la réaction d’hydrogénation du glucose.
| Isosorbide | |
| |
| Identification | |
|---|---|
| Nom UICPA | (3R,3aR,6S,6aR)-hexahydrofuro[3,2-b]furan-3,6-diol |
| Synonymes |
1,4:3,6-dianhydro-D-sorbitol |
| No CAS | |
| No ECHA | 100.010.449 |
| No CE | 211-492-3 |
| PubChem | 12597 |
| SMILES | |
| InChI | |
| Apparence | écaille blanche, très hygroscopique |
| Propriétés chimiques | |
| Formule | C6H10O4 [Isomères] |
| Masse molaire[1] | 146,141 2 ± 0,006 7 g/mol C 49,31 %, H 6,9 %, O 43,79 %, |
| Propriétés physiques | |
| T° fusion | 62,5 °C[2] |
| T° ébullition | 160 °C à 10 mmHg |
| Solubilité | dans l'eau (>850 g·l-1), les alcools et les cétones |
| Masse volumique | 1,30 g·cm-3 à 65 °C |
| Point d’éclair | >180 °C |
| Viscosité dynamique | 30 mPa s à 100 °C |
| Unités du SI et CNTP, sauf indication contraire. | |
L’isosorbide est un diol issu des agro-ressources, non toxique, biodégradable et stable thermiquement.
L’isosorbide est un monomère qui peut être inséré dans des chaînes macromoléculaires de type polymères (polycarbonates, polyuréthanes, polyesters…). Il est également utilisé pour la synthèse de dérivés tels que les diesters, diéthers, dinitrates…
L’isosorbide est considéré comme synthon donnant accès à une nouvelle plateforme chimique d’intérêt puisqu’il est issu du végétal et permet d’obtenir de nombreux dérivés aux propriétés égales voire supérieures à leurs homologues de la pétrochimie.
Origine
Les premières recherches sur l’isosorbide ont été effectuées en 1946 par H.G. Fletcher, R.C. Hockett, R. Montgomerry et L.F. Wiggins[3]. Plusieurs articles paraissent dans le Journal de la Société Chimique Américaine notamment l’article « Structure of Isosorbide, a cristalline dianhydrosorbitol » écrit par H.G. Fletcher et R.C. Hockett[4]. En 1986, un article paraît dans Stärke no 38 par G. Flèche et M. Huchette intitulé « Isosorbide : Preparation, Properties and Chemistry[5] », cet article fait toujours référence. En 1992, en relation avec le Laboratoire des Matériaux Macromoléculaires du Pr Pascault de l’INSA de Lyon, Roquette Frères[6] finança une thèse de doctorat sur les propriétés de l’isosorbide dans l’élaboration de polymères fonctionnels. Ce diol isosorbide est désormais une des pièces maîtresses du programme BioHub[7], programme de recherche lancé en 2006 et soutenu par OSEO (Agence française pour l’innovation). Dans ce programme de chimie durable, l’isosorbide est étudié comme monomère d’origine renouvelable pour de nouveaux polymères et dérivés.
Propriétés physico-chimiques
Propriétés chimiques
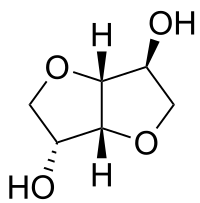
La molécule d’isosorbide est constituée de deux cycles tétrahydrofuranes fusionnés et de deux groupements alcools substitués en position 2 et 5 respectivement en exo et en endo (voir figure de droite). Sa formule brute est C6H10O4 et il a deux isomères : l’isomannide et l’isoidide. Ces trois isomères diffèrent par la configuration relative de leurs groupes hydroxyles. L’isosorbide est le diol le plus étudié car il est le plus accessible. La chiralité de l’isosorbide influe sur sa réactivité. En effet, le groupement hydroxyle endo en position 5 peut former une liaison hydrogène avec l’oxygène du cycle adjacent (voir figure de gauche). Cette liaison intra-moléculaire tend à accroître la nucléophilie de l’oxygène O-5 et donc sa réactivité. À l’inverse, l’encombrement stérique provoqué par cette même liaison tend à diminuer la réactivité. Ainsi, les conditions expérimentales qui tendront à diminuer la force de la liaison hydrogène favoriseront plutôt des réactions en position 2. Inversement, les conditions ne perturbant pas la liaison intra-moléculaire favoriseront la sélectivité en position 5[8].
Propriétés physiques
L’isosorbide est un solide blanc soluble dans l’eau, les alcools et les cétones et presque insoluble dans les hydrocarbures, les éthers et les esters.
L’isosorbide est très hygroscopique, c'est-à-dire qu’il a tendance à absorber l’humidité environnementale par absorption ou par adsorption.
L’isosorbide est non-toxique et stable à la chaleur. Cette molécule ne se décompose qu’à partir de 270 °C en l’absence d’oxygène.
Autres propriétés
L’intérêt de l’isosorbide dans les polymères s’explique par la rigidité[9] apportée par les deux cycles de l’isosorbide qui provoque une augmentation de la température de transition vitreuse (T°g). Cette augmentation engendre une amélioration des propriétés mécaniques du polymère. Il est nécessaire d’utiliser un isosorbide de haute pureté pour ce type d’application (brevet Du Pont[10]).
Producteurs (en quantités industrielles)
Historiquement, l’isosorbide est produit en petites quantités pour les domaines de la pharmacie et de la cosmétique. Roquette a démarré en à Lestrem (France) une nouvelle unité industrielle d’isosorbide d’une capacité de plusieurs milliers de tonnes par an pour les marchés actuels et les marchés en développement. En , l’ASEA (Autorité Européenne de Sécurité des Aliments) a donné un avis positif pour l’utilisation de l’isosorbide en tant que monomère pour le polytéréphtalate d'éthylène (PET) à usage alimentaire[11].
Marchés actuels
Isosorbide
L’isosorbide est un composé à propriété diurétique employé en pharmacie. Il est utilisé au Japon pour traiter la maladie de Menière[12]. Cette maladie touche l’oreille interne et provoque des vertiges, des acouphènes et une baisse d’audition.
Mononitrate et dinitrate d'isosorbide
Le mononitrate et le dinitrate d'isosorbide sont des substances utilisées en pharmacie comme vasodilatateur. La vasodilatation permet de dilater les vaisseaux sanguins et donc d’augmenter le débit sanguin vers le cœur. Ils sont utilisés dans le traitement préventif des crises d’angine de poitrine, dans le traitement de l’insuffisance cardiaque ou pour les fissures anales.
Marchés en développement
Polyéthylène isosorbide téréphtalate
Le polytéréphtalate d'éthylène (PET) est obtenu à partir d’acide téréphtalique et d’éthylène glycol. Le polyéthylène isosorbide téréphtalate est, quant à lui, obtenu par réaction de l’acide téréphtalique avec l’éthylène glycol et l’isosorbide. Dans l’application pour des bouteilles en PET, l’ajout d’isosorbide permet d’augmenter la température de transition vitreuse du PET et donc d’élargir son spectre d’utilisation à d’autres applications comme le remplissage à chaud de bouteilles (jus de fruits, thé…)[13].
Polycarbonates
Les polycarbonates sont issus de la réaction de polycondensation du bisphénol A[14] et d’un carbonate ; l’isosorbide peut substituer le Bisphénol A[15] pour permettre notamment de réduire le phénomène de biréfringence et d’apporter des propriétés physico-chimiques et mécaniques améliorées.
Autres polymères à base d'Isosorbide
L’isosorbide peut entrer dans la composition de nombreux polymères tels que les résines polyesters (polyisosorbidesuccinates), les polyuréthanes[9] et les Polysulfones[16]… L’isosorbide peut aussi être utilisé comme allongeur de chaîne dans certains types de polyuréthanes et remplacer certains diols comme le butanediol. De par sa nature, diol et cyclique, l’isosorbide peut entrer dans la composition de nombreux polyesters ou copolyesters, pour l'élaboration de matériaux de hautes performances. Le domaine d'applications concerne les composites, revêtements, poudres, articles transparents résistants à la température…
Diesters d'isosorbide
Les diesters d’isosorbide sont obtenus par la double réaction d’estérification de l’isosorbide avec des acides gras de longues chaînes. Ils possèdent d’excellentes propriétés plastifiantes pour le PVC et représentent une nouvelle génération de plastifiants biosourcés pour les PVC flexibles. Aujourd’hui, les principaux plastifiants du PVC sont issus de la famille des phtalates. Le développement de ces diesters d'isosorbide est inclus dans le programme d’innovation ouverte BioHub[7] et est l’un des lauréats du Prix Pierre Potier[17] 2009 : « Chimie pour un développement durable ». Les diesters d'isosorbide sont susceptibles d'être utilisés en remplacement des phtalates, époxydes ou phosphates.
Diméthylisosorbide
Le diméthylisosorbide (DMI), obtenu par méthylation de l’isosorbide, possède d’excellentes propriétés co-solvantes et hydrotropes. Pour le moment, il est essentiellement utilisé dans des produits cosmétiques et pharmaceutiques (autobronzant, lotion pour la peau, crèmes anti acnéiques,…). Le diméthylisosorbide est fabriqué par les sociétés suivantes : Croda[18] (ArlasolveTM DMI[19]), Dottikon[20] …
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) « Isosorbide », sur ChemIDplus, consulté le 2 juillet 2010
- MM. MONTGOMERRY et WIGGINS, Journal of Chemical Society. 390 (1946)
- Article de MM. HOCKETT et FLETCHER ; « Structure of Isosorbide, a cristalline dianhydrosorbitol » ; Journal of the American Chemical Society (1946), 68927-30
- Article de MM. FLECHE et HUCHETTE ; « Isosorbide : Preparation, Properties and Chemistry » ; Stärke no 38)
- .
- .
- [Rapport bibliographique : « Voies d’accès aux monoesters d’isosorbide et à des motifs hydrophiles de type polyisosorbide » par E. BUHAN, J.M. AUBRY, V. MOLINIER (ENSCL) et T. FERON (Roquette Frères).].
- [« Isosorbide, un diol vert pour la chimie du polyester et du polyuréthane » par Pr Pascault, Ingénierie des Matériaux Polymères (IMP), UMR CNRS #5223 Laboratoire des Matériaux Macromoléculaires, INSA Lyon].
- [Brevet Du Pont WO 00/41985].
- [Communiqué de presse Roquette « NOUVELLE PRODUCTION INDUSTRIELLE D’ISOSORBIDE »].
- .
- J.C. Bersot et al., « Efficiency Increase of Poly (ethylene terephthalate‐co‐isosorbide terephthalate) Synthesis using Bimetallic Catalytic Systems », Macromol. Chem. Phys., vol. 212, no 19, , p. 2114-2120 (DOI 10.1002/macp.201100146)
- .
- .
- (Publication de Chatti).
- .
- .
- .
- .