Impact écologique de la pêche
L'impact écologique de la pêche est l'ensemble des effets de la pêche sur la faune et sur les sites d'exploitation des ressources, impliquant notamment la surpêche, la dynamique et gestion des pêcheries, ou encore les prises accessoires. Au cours du XXe siècle, la pêche a pris beaucoup d'ampleur, la demande mondiale en poissons et crustacés se faisant de plus en plus forte. Cela a mené à une surexploitation de certaines espèces, qui continue encore de nos jours, faute de solution idéale. Il est en effet difficile de concilier intérêts économiques et conservation des espèces.
Cette surpêche a des conséquences écologiques qui dépendent beaucoup des populations, des écosystèmes et des communautés étudiés.
Il est difficile de bien estimer les conséquences de la pêche. Les recherches scientifiques sur le sujet ont débuté bien après l'exploitation par l'homme des ressources marines. Il y a donc peu de données qui correspondent aux écosystèmes totalement inexploités et auxquelles on pourrait comparer les données actuelles. Il est tout de même possible, à partir de modèles et d'observations, de prévoir certains effets sur les espèces et leur écologie.
Diminution de la biomasse
Il est assez intuitif de penser que la biomasse diminue lorsque la population est exploitée. La mortalité même qui résulte de l'exploitation mène à une diminution de biomasse. C'est ce que l'on remarque chez l'espèce de patelles Cymbula oculus, où la biomasse diminue de 30 à 90 % chez les populations exploitées par rapport à celles dans les aires marines protégées[1]. Cependant, on observe un effet ajouté lorsqu'il s'agit de pêche sélective. En effet, il existe une relation entre le poids (et donc la taille) et la biomasse, et la pente du rapport poids/biomasse d'une population exploitée n'est pas la même que celle prédite par le modèle que l'on retrouve dans les populations non exploitées[2].
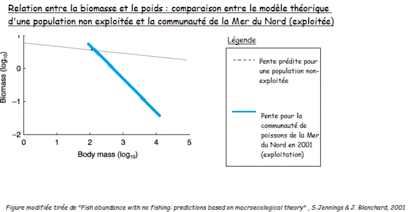
La figure ci-dessus montre que pour une population non exploitée, la biomasse varie peu en fonction du poids. En situation d'exploitation, la biomasse est plus importante quand le poids moyen des individus de la population est bas. Les populations d'individus de petite taille sont en effet moins menacées par la pêche, leurs biomasses restent donc relativement importantes.
Diminution de la fécondité
La fécondité moyenne diminue dans les populations exploitées, comparée à celle des populations de mêmes espèces vivant dans des zones marines protégées.

En effet, pour plusieurs espèces la fécondité est liée exponentiellement à la taille de l'individu[3]. Plus celle-ci est grande, plus la fécondité augmente. Mais la fécondité relative (fécondité par gramme) augmente aussi avec l'âge et le poids[4]. Il existe d'autre part une corrélation positive entre la taille et la qualité de la ponte avec l’âge et la taille de la mère[4]. Par exemple, on a remarqué que chez les Sebastes menalops plus âgés, la production des larves est de meilleure qualité que celle des plus jeunes et de plus petite taille[4]. Les individus les plus gros ont donc une meilleure fécondité, relativement à leur taille.
Une fois que les individus les plus gros sont pêchés, il ne reste que ceux qui présentent une fécondité relative inférieure. Et comme les individus plus petits sont sélectionnés positivement par la pression de pêche, à long terme on peut avoir des conséquences sur ce trait, comme une fécondité qui augmente chez les petits individus ou alors la fécondité moyenne de la population qui diminue.
Évolution et survie de la progéniture
La pêche sélective affecte sur différents niveaux la progéniture des espèces marines.
Une ponte de bonne qualité et de grande taille aboutit à un meilleur taux de croissance et une meilleure probabilité de survie de la larve. Les larves de poissons ne sont donc pas toutes de même qualité[3]. Ainsi, il a été prouvé que les femelles plus âgés produisent des larves avec un taux de survie plus grand que les plus jeunes[4] - [5].
Les larves des Sebastes Melanops les plus âgées grandissent trois fois plus vite et survivent plus de deux fois mieux à la famine que les larves produites par les jeunes femelles[5]. Cette survie améliorée chez les larves est due au fait que les poissons plus âgés présentent plus de réserves métaboliques. Les gros adultes peuvent investir plus d’énergie dans chaque progéniture. Les plus grosses femelles sont aussi plus expérimentés et réussissent mieux la ponte. Lorsqu’une femelle réussit mieux la ponte elle peut agrandir la période de ponte.
En provoquant une diminution de la taille des individus, la pêche sélective cause une réduction exponentielle du nombre de larves produites ainsi qu'une diminution de la période de reproduction et des chances des larves de rencontrer des conditions favorables à leur survie[3]. Ces larves ont donc une probabilité de survie amoindrie.
De plus, chez certaines espèces, les individus âgés jouent un rôle « d'apprentissage » auprès des plus jeunes, qui apprennent à pondre en les suivant. Via ces interactions, ils participent aussi à améliorer le succès reproductif de la génération suivante[3].
En retirant les adultes les plus gros cela génère donc une perturbation dans le processus reproductif de l’ensemble de la population.
Étant donné ces conséquences sur la progéniture et d’autres effets causés par les femelles, la suppression des femelles les plus grosses et les plus âgées affecte la taille, la croissance et la survie de la larve pour de nombreuses espèces de poissons[4].
Conséquences écologiques
Les activités de pêche ont des effets directs sur les écosystèmes marins, en effet elles sont responsables d’une augmentation de la mortalité des espèces ciblées et des espèces non ciblées (aussi appelées, espèces non commerciales ou prises accessoires). La pêche est aussi responsable de la perturbation des habitats marins[6].
Modifications du sex-ratio
La pêche affecte le sex-ratio de certaines espèces. Il existe plusieurs cas de figure, selon le mode de développement de l'espèce.

Certains organismes aquatiques sont séquentiellement hermaphrodites, ils passent la première partie de leur vie en étant mâles (resp. femelles) et deviennent ensuite femelles (resp. mâles) lorsqu’ils sont plus gros et plus âgés. Les individus pêchés étant les plus âgés, chez ces espèces seul un des deux sexes sera pêché, créant un déséquilibre dans le sex-ratio. Dans ces cas-là, il est prédit une ré-équilibration du sex-ratio via un changement de sexe plus jeune et à une taille plus petite, chez les individus sélectionnés positivement[7]. C'est ce que l'on observe chez C. cristiceps, dont l'âge de changement de sexe est plus faible dans les zones exploitées que dans les zones protégées[8].
Les espèces qui présentent un dimorphisme sexuel comme c'est le cas chez le homard ou le crabe, verront leurs sex-ratios affectés. En effet, chez ces espèces les mâles sont plus gros que les femelles. Cela induit donc, lorsque la population est exploitée, un sex-ratio biaisé en faveur des femelles. Il est possible que cela affecte le potentiel reproductif de la population[9].
Il existe enfin un cas où les espèces ne se différencient pas au même moment selon le sexe. Chez les anguilles, les mâles se différencient plus jeunes et donc ont une taille plus petite que les femelles. Cela a encore une fois pour conséquence un sex-ratio biaisé, ne correspondant pas à celui d'une population non exploitée[4].
Pour conclure, si la taille de changement de sexe n'est pas modifiée, le sex-ratio biaisé conduit à une limitation du potentiel reproductif de la population et donc à un déclin[9].
Baisse de l’abondance des populations : un constat.
Les taux de déclin parmi les populations de poissons les plus touchées par la pêche ont augmenté durant la dernière moitié du XXe siècle où des réductions de plus de 80 % des effectifs par rapport aux niveaux historiques enregistrés (à défaut des "vrais" niveaux, les activités de pêche étant largement antérieures aux premiers relevés d’abondance) étaient courantes. Cela s'est particulièrement observé parmi les grands prédateurs, par exemple la morue de l’Atlantique et les requins (des régions côtières et océaniques)[10]. Dans le golfe du Mexique, 2 espèces de requins les plus attrapées ont vu leurs populations décliner de 99 % pour Carcharhinus longimanus et de 90 % pour C. falciformis depuis les années 1950[11].
D'autres études ont également montré que l’abondance de l’épifaune sédentaire (animaux tels que les anémones, les coraux, les éponges) ainsi que leur diversité diminuaient avec la pêche[12].
Effets directs sur l’abondance : la surpêche de recrutement
L’espérance de recrutement, soit le nombre de juvéniles qui remplacent chaque année les morts naturelles et les individus capturés, est déterminée par la biomasse de reproducteurs. La pêche, en réduisant le stock des individus reproducteurs, entraîne une baisse du recrutement et par voie de conséquences, un déclin du stock exploitable dans les années à venir : c’est la surpêche de recrutement[13].
La surexploitation amplifie la variabilité de l’abondance du stock. Cette variabilité est due à des succès de recrutement différents selon les conditions environnementales et les altérations anthropiques (pollution, dégradations physiques des habitats, changement climatique). Ainsi il est difficile d’attribuer avec certitude à la pêche l’effondrement de certains stocks, ne sachant pas si cette baisse d’abondance résulte uniquement de mauvaises conditions environnementales[13].
Beaucoup de cas d’éradications de populations sont associés à l’activité de pêche[14].
En se basant sur les valeurs historiques enregistrées d’abondances de populations de poissons, on observe un déclin d’abondance des populations de poissons marins exploitées de 35 % en moyenne entre 1978 et 2003. En 2003 le taux d’abondance de ces populations était de moins de 70 % du maximum enregistré. Une forte accélération de ce déclin est principalement observée pour les espèces de prédateurs supérieurs après 1992[10].
Effets positifs de la pêche sur les espèces d’oiseaux de mer
Lors des activités de pêche, le rejet de déchets (poissons morts, viscères) et des prises accessoires fournissent un apport nutritif supplémentaire à des espèces charognards et à beaucoup d’oiseaux de mer. Cet apport supplémentaire a permis l’explosion de plusieurs de ces populations (albatros, pétrels, goélands et labbes). En effet cette nourriture supplémentaire leur permet d’augmenter leur taux de survie et ainsi améliore leur reproduction.
Ces populations ne pourraient ainsi pas maintenir leurs populations à de tels niveaux d’abondance sans les rejets de la pêche[6].
Effets sur l’habitat
L’ensemble des matériels de pêche, qu’ils soient trainés en pleine eau ou sur les fonds (chaluts pélagiques ou de fonds) ou statiques (casiers, filets statiques) ont un impact sur le milieu et sur les individus avec lesquels ils entrent en contact. Cependant les conséquences varient sur une échelle temporelle et selon le matériel utilisé[15] - [6] - [16].
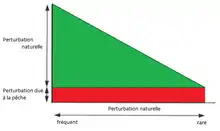
L’impact relatif de la pêche sur les habitats et sur la structure des communautés benthiques est déterminé par l’ampleur des perturbations naturelles. L'importance relative de l’impact de la pêche dépend des degrés de perturbations naturelles auxquelles l'habitat est soumis. Plus le niveau de perturbations naturelles est faible et plus l’impact de la pêche sur les habitats est élevé[6]. Voir figure ci-contre.
L’un des effets physiques des engins de pêche sur le plancher océanique les plus visibles est l’homogénéisation du substrat qui se produit par sa détérioration physique (grattage, récurage) et la mise en suspension de sédiments[6] - [12] - [15].
Aussi, les effets directs de la pêche tendent à augmenter avec la profondeur et la stabilité du substrat (zones correspondant à peu de perturbations naturelles). Cependant dans des zones où des habitats complexes se sont développés à de faibles profondeurs, comme c'est le cas des récifs coralliens, les effets directs de la pêche sont notés. Les structures biogéniques de ces habitats sont brisées. Cela aboutit à d’importantes conséquences sur la capacité de ces habitats à maintenir leurs populations[6] - [12].
Les palangres, les filets maillants et les casiers ont tous des effets sur les habitats du plancher océanique. Cependant les dommages les plus considérables sont dus au chalutage de fond. En haute mer, comme dans les eaux peu profondes (environnements côtiers) le chalutage peut altérer les propriétés physiques des sédiments de surface, à la fois en mélangeant les sédiments mous et en causant l’érosion des couches supérieures, exposant ainsi les sédiments les plus vieux et les plus denses[6] - [16].
Après le passage du chalut, les panaches de sédiments ainsi formés vont de 2 à 4 m de haut et de 120 à 150 m de large selon la taille du chalut. En haute mer, dans les environnements à faible courants, ces panaches peuvent se disperser très lentement sur de très grandes distances[16] entrainant la mort des organismes sessiles qu'ils recouvrent.
De plus au niveau des sédiments meubles, le passage des engins de pêche entraîne le relargage des éléments toxiques et contaminants présents dans la couche sédimentaire[12].
Effets sur les communautés benthiques
La pêche a des conséquences sur la structure complexe des habitats benthiques et peut influer sur la composition en espèces, sur l’abondance, sur la composition en âges et en tailles, sur les taux de croissance et sur d’autres paramètres biologiques dans les écosystèmes benthiques[6] - [12] - [16].
Les interactions directes des matériels de pêche avec la faune épibenthique, qui produisent des dommages physiques, peuvent être classées en 3 catégories :
- « blunt impact »: le mouvement d’un objet vaste à travers le benthos. (ex : les panneaux de chalut, le maillage, le cul de chalut)
- « Line shear » : le mouvement d’un objet étroit à travers le benthos (fune de chalut, brides les plus fines, palangre)
- « hooking » : interactions directes des ancres avec le benthos (c’est-à-dire accrocher les animaux)
Le « blunt impact » produit généralement le délogement ou l’écrasement des individus de formes érigées, particulièrement les plus larges, qui sont fixés au plancher océanique tels que les coraux, les éponges et les Crinoïdes. Ces organismes peuvent également être cisaillés (« line shear »), subir le « hooking » ou bien se retrouver empêtrés dans les palangres[16].
De nombreuses études ont montré de fortes différences dans la biodiversité de la faune benthique, particulièrement dans les communautés dépendantes des coraux, entre zones soumises à la pêche et celles où la pêche n’est pas présente[6] - [12] - [16].
Les impacts indirects sur l’épifaune peuvent émaner des panaches de sédiments formés lors du passage du chalut ou des palangres. Lorsque ces sédiments se redéposent, ils peuvent alors recouvrir certaines espèces sessiles et ainsi empêcher leur expansion et la reconstitution des colonies[16].
La pêche a aussi des impacts sur l’endofaune, une étude a montré que 11 à 40 % des variations dans la structure de ces communautés étaient imputables à l’activité de pêche[16].
La destruction des structures physiques de l’habitat et la réduction de leur diversité conduisent directement et indirectement à des pertes de richesse spécifique et à une exposition accrue à la prédation à cause de la perte des abris. En effet les structures complexes des habitats benthiques sont autant de refuges pour les larves des espèces commercialisées ou non[12].
Sur le plan fonctionnel, les communautés benthiques dominées par des filtreurs suspensivores à grande longévité sont remplacées par des communautés dominées par des espèces de petite taille, mobiles, déposivores ou nécrophages[15] - [16].
Impacts sur le réseau trophique

Comme expliqué ci-dessus, la pêche affecte le milieu en réduisant l’abondance de différentes espèces. Les espèces de grandes tailles sont majoritairement les premières espèces pêchées car leurs tailles les rendent plus vulnérables. Ce constat joue en faveur des espèces de petites tailles qui sont non seulement moins vulnérables face à la pêche mais aussi dans l’organisation des interactions proies-prédateurs liées au réseau trophique.
Dans le réseau trophique, les espèces de grandes tailles sont souvent piscivores et consomment des petits poissons carnivores. La diminution du nombre de grands prédateurs induit donc l’augmentation des petits poissons. Ce changement suppose donc que les pêcheurs sont voués à ne capturer que des espèces de plus en plus bas dans la chaine trophique (Fishing down the food web (en))[17].
Cependant la pêche ne réduit pas toujours la chaine trophique.
Il n’est pas exact de penser que la suppression d’une espèce ou la prolifération d’une autre a systématiquement un impact visible sur la chaine trophique : l’impact de cette suppression dépend de la complexité du réseau[18].
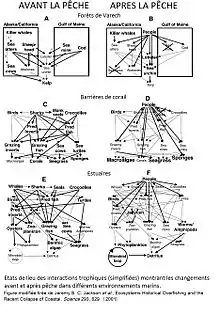
On remarque que la pêche ciblée de prédateurs dans les eaux de lac permet l’augmentation de l’abondance de leurs proies. Ces prédateurs sont souvent des espèces clefs. La surpêche de ces derniers peut engendrer un grand déséquilibre dans la chaine trophique. Les espèces de ces milieux sont alors soumises à un fort risque d’extinction A l’inverse, grâce à la pêche, certaines espèces voient tous leurs prédateurs disparaître[19].
Par exemple, en Alaska, l’oursin est un grand prédateur des laminaires (et la plupart des algues charnues). Cependant, la population d’oursins a vu son abondance augmenter fortement due à une prédation réduite causée par la chasse de son prédateur (la loutre). Ce phénomène autorise alors les oursins à proliférer et à brouter toutes les algues en détruisant la couverture d’algues des récifs coralliens. Ce processus est très visible et connu sous le nom de : fond désertifié d’oursins[15].
D’autre part, dans des écosystèmes marins tels que les océans ou estuaires, la pêche ciblée a peu d’impact sur les populations marines. Cela s’explique par des phénomènes de « compensation » comme une diminution de la prédation qui profite à une autre. En effet, il peut y avoir des phénomènes d’échange de statut : une proie qui disparaît peut être remplacée par une autre différente. Il existe également d’autres phénomènes comme le cannibalisme vu comme un changement dans le régime alimentaire[18].
La pêche a donc des impacts directs sur l’abondance et sur les traits d’histoire de vie des prédateurs mais aussi des effets dits en cascade au sein de la chaine trophique.
Perte de matériel de pêche
Selon un rapport de Greenpeace, 640 000 tonnes de matériel de pêche : filets, lignes, gilets de sauvetage ou cordes sont perdus chaque année. Cela représente 10 % de la contamination du milieu marin par les plastiques et 70 % des déchets de plus de 20 cm[20].
Perspectives d'amélioration
Dynamique des pêcheries
Considérant la dynamique des populations, il conviendrait de maintenir un stock constant et ne pêcher qu’une fraction (n) de poissons calculée et après le renouvellement de la population.
À l’échelle de la population, le stock représente une unité de gestion en pêche : cela signifie que l’ensemble des individus de la même espèce sont dans une localisation précise, et qu’ils n’interagissent pas avec les autres individus de la même espèce vivant en dehors.
Le stock d’une population non structurée en âge est soumis à une certaine mortalité (naturelle et liée à la pêche) et à un facteur de croissance.
D’après l’équation de la croissance logistique de Verhulst, on écrit[21]:
dN/dt= rN(1-N/K) – F
Avec :
- F : Effet de pêche,
- N : Effectif,
- r : Taux d’accroissement intrinsèque de la population,
- K : Capacité de charge (Natalité/Ressources)
À partir de cette équation, il est judicieux de chercher à évaluer la quantité de poissons à prélever par la pêche et ainsi appliquer une politique de quotas. Ceux-ci sont calculés, définissant une fonction de mortalité liée à la pêche et ils doivent être respectés. Ces quotas sont calculés pour atteindre le maximum du stock (c’est-à-dire au MSY = Maximum Subtainable Yield) parce que les enjeux financiers appliquent une forte pression lors de l’évaluation de ces derniers.
De plus, ce MSY est difficile à évaluer puisqu’il dépend de paramètres démographiques et des taux vitaux (r et K) soumis à de la stochasticité (environnementale et démographique).
La gestion par quotas n’est pas une solution d’exploitation durable sauf si on se situe bien en dessous du MSY. Cependant, les quotas sont difficiles à estimer, étant souvent accompagnés d’effet de tricherie par les pêcheurs[21]. Ils sont peu applicables. Le risque d’effondrement des populations de poissons pêchées est alors augmenté avec cette gestion.
Une autre façon d’envisager la gestion de la pêche est la gestion par effort constant. L’idée est d’estimer la mortalité par la pêche comme fonction de la taille du stock, c’est-à-dire que la mortalité dépend de l’efficacité de capturabilité (q), de l’effort collectif dans la pêche (E : nombre de bateaux, temps de pêche) et de la taille du stock (N) :
Rendement de la pêche[21] :
F(N)= qEN
Avec :
- q : Efficacité capturabilité
- E : Effort collectif
- N : Taille du stock
Ce modèle a pour avantage d’ajuster les quotas jusqu’au MSY de façon moins risquée.
Cependant, il est peu réalisable pour un gestionnaire de maintenir un effort constant.
Les quotas sont difficiles à estimer. Il est compliqué d’envisager un effort constant car ce dernier est dur à contrôler. Une pêcherie en libre accès laisse les bénéfices dépendre uniquement de l’effort et donc permet la maximisation du profit individuel. Ceci n’étant pas une solution économiquement stable, cela pose des problèmes de conservation.
Bases de solutions envisageables
Soit un état des lieux de la pêche en quelques chiffres[22]: Ce tableau représente la quantité moyenne (en kilogramme) de poissons consommés par habitant et par année. On observe une croissance importante entre 1960 et 2015 (plus de 10 kg en moyenne à l'échelle mondiale), sans oublier que la population augmente constamment. En 2014 : la pêche de capture et l’aquaculture représentaient respectivement 93,4 M de tonnes (81,5 en mer et 11,9 en eaux continentales) et 73,8 M de tonnes.
| Années | 1960 | 1970 | 1980 | 1990 | 2006 | 2013 | 2014-2015 |
| Quantité de poisson
par individu (en kg/personne/an) |
9.9 | 11,5 | 12.5 | 14.4 | 16,7 | 19.7 | > 20 |
Ces chiffres en croissante augmentation s’expliquent par une demande croissante mondiale, des progrès technologiques (capacité de capture des navires) ainsi que l’apport de subventions.
Face à cela, il se produit un déclin de la biodiversité marine. La surexploitation a entrainé la perte de quarante espèces de poissons en Méditerranée[23], de mollusques et d’autres espèces marines tels que les requins et raies qui sont aujourd’hui en danger d’extinction. Cet effet est aussi dû à l’utilisation de filets illégaux comme la technique de filet dérivant et de bateaux de pêche (4,6 M en 2014 [22]) qui ne permettent pas de limiter la capture d’espèces non ciblées (tortues, oiseaux, dauphins).
De plus, là encore, ces techniques de capture ont des impacts sur les fonds marins, détruisant un écosystème primordial et conduisant à la perte d’autres espèces qui ne peuvent plus se nourrir voire se reproduire.
Les solutions envisageables:
- Quotas individuels transférables (ITQs)[24] :
Dans ce cas précis, le gouvernement détient la ressource, il détient les quotas totaux en fonction de la taille du stock. Le gouvernement les redistribue en vendant aux pêcheurs un quota de capture (en kg ou en tonnes). Il y a donc plusieurs avantages : Les pêcheurs sont sûrs d’obtenir un revenu proportionnel aux quotas achetés. Ce fonctionnement réduit la course aux captures. Le bénéfice est individuel, mais l’intérêt est collectif car les pêcheurs doivent bien gérer leurs stocks pour que le TAC augmente. Le risque d’effondrement est également moins probable. On peut cependant y voir des inconvénients : les quotas doivent être bien évalués. Pour cela, il est nécessaire de faire de nombreux contrôles pour vérifier que chaque pêcheur respecte son quota. De plus, la prise du marché de la pêche par de gros investisseurs peut réduire la création d’emplois et aussi la redistribution des richesses pour les pêcheurs.
- Fermeture des pêcheries[25] :
Elle permet de réduire l’effort de pêche pour limiter le risque de surexploitation. Néanmoins, le fait de diminuer l’effort laisse les bénéfices augmenter et pousse de nouveaux pêcheurs à investir. On observe donc l’effort ré-augmenter. Cette augmentation contraint les gestionnaires à augmenter les durées de fermeture, ce qui entraine une augmentation de la capturabilité des poissons (traduite par un investissement dans les moyens d’exploitation). La fermeture des pêcheries conduit alors à une surcapacité de la pêcherie (par exemple pour le thon rouge en Méditerranée). Ce dernier point a comme conséquence, chez certains pêcheur, l’investissement dans de lourds équipements de pointe et ne permet pas de réduire efficacement la surexploitation.
- Aquaculture[26] :
C’est l’élevage d’animaux et de la culture d’algues (en eaux douces ou eaux de mer) dont la production permet une satisfaction des besoins alimentaires mais aussi l’apport de produits de haute valeur (demande croissante des marchés des pays développés). On peut distinguer deux grandes catégories de production : la pisciculture (bar, dorade, saumon, turbot..) et la conchyliculture (prépondérante en milieu marin). La conchyliculture est l’exploitation des mollusques bivalves (huitres, moules). Elle représente presque intégralement l’aquaculture française[27].
Autre exemple : le saumon. Le principe consiste à prélever les œufs des femelles que l’on fait ensuite éclore (Ecloserie) généralement à la fin de l’hiver. Les juvéniles sont ensuite triés par taille et envoyés à l’étang de grossissement. Si le saumon s'élève facilement, ce n’est pas le cas de tous les grands poissons marins. Le thon rouge, par exemple, refuse de se reproduire en captivité. Il nécessite beaucoup d’espace. Il est aussi plus exigeant dans les soins et l’apport alimentaire que le saumon.
L’avantage de l’aquaculture est qu’elle permet de répondre à une demande constante. Elle est très prisée par des pays comme le Japon et la Chine où la consommation de poissons et crustacés est ancrée dans la culture.
Les inconvénients :
Elle génère la destruction d’habitats, comme les mangroves dans les zones côtières humides, causée par les installations piscicoles et le rejet de leurs déchets. En effet, l’installation d’une station nécessite un emplacement dans une zone abritée et peu peuplée (meilleure surveillance et protection des intempéries). Elle nécessite la gestion des pathologies : l’apparition de viroses, bactéries ou parasitoses ont des effets dramatiques.
Elle pollue les eaux : la salinisation (due à des cultures nécessitant de l’eau de mer), la diminution du niveau des nappes phréatiques sont observés. Cette pollution amène à l'abandon de ces bassins tous les dix ans. Le fait que les anciens bassins soient inutilisables à cause de la salinité des sols trop élevée constitue un problème majeur.
- Les aires marines protégées[28]
Une aire marine protégée est une zone spécifique délimitée en mer. Ces aires sont de plus en plus employées afin de protéger les poissons de la surpêche. Les réserves marines ont pour avantage d’améliorer l'abondance des espèces. Cependant, leur effet sur l’abondance des poissons est variable. C’est majoritairement l’abondance des espèces ciblées par la pêche qui augmente significativement.
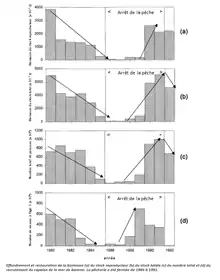
En effet, la biomasse du stock reproducteur des poissons ciblés est croissante et permet une exportation des larves de ces poissons dans les zones non protégées voisines. L’objectif est double pour ces aires marines. Elles visent d’une part à protéger les espèces de l’exploitation excessive mais aussi à protéger les habitats sensibles et les espèces non exploitées, indirectement touchées pas les impacts de la surpêche[29] - [28].
Par exemple, la protection des coraux est un enjeu majeur pour ces aires. L’efficacité des aires marines est liée à l’intensité de l’exploitation autour de la réserve et de la composition de la communauté de poissons au sein de l’habitat (ses caractéristiques)[28] - [29].
Les espèces qui présentent un habitat plutôt restreint répondent bien aux objectifs de conservation. Les zones où les mouvements de poissons sont importants et où la pêche est développée (souvent les régions tempérées), sont moins adéquates pour l’installation d’une aire protégée. Les réserves marines ont donc pour avantages la gestion durable d’un milieu naturel, la protection de la biodiversité et la protection d’habitats rares. Cependant, la mise en place de ces aires nécessite une bonne connaissance des caractéristiques intrinsèques aux espèces mais aussi des caractéristiques des pratiques de la pêche souvent difficiles à évaluer[28] - [29].
- Filets suivis par satellite : des filets suivis par satellite sont expérimentés en 2020. Ils doivent limiter la perte de matériel de pêche en mer[30].
Articles connexes
- Pêche (halieutique)
- Biologie marine
- Biodiversité marine
- Crise de l'anchois
- Effondrement de la pêcherie de morue de Terre-Neuve
- Histoire de la pêche
- Impact évolutif de la pêche
- Maille (halieutique)
- Partage du poisson
- Pêche durable
- Pêche sélective
- Politique de pêche
- Prise accessoire
- Rendement équilibré maximal
- Surpêche
Notes et références
- G. M Branch et F Odendaal, « The effects of marine protected areas on the population dynamics of a South African limpet, Cymbula oculus, relative to the influence of wave action », Biological Conservation, vol. 114, , p. 255–269 (DOI 10.1016/S0006-3207(03)00045-4, lire en ligne, consulté le )
- (en) Simon Jennings et Julia L. Blanchard, « Fish abundance with no fishing: predictions based on macroecological theory », Journal of Animal Ecology, vol. 73, , p. 632–642 (ISSN 1365-2656, DOI 10.1111/j.0021-8790.2004.00839.x, lire en ligne, consulté le )
- C BIRKELAND et P DAYTON, « The importance in fishery management of leaving the big ones », Trends in Ecology & Evolution, vol. 20, , p. 356–358 (ISSN 0169-5347, DOI 10.1016/j.tree.2005.03.015, lire en ligne, consulté le )
- (en) Phillip B. Fenberg et Kaustuv Roy, « Ecological and evolutionary consequences of size-selective harvesting: how much do we know? », Molecular Ecology, vol. 17, , p. 209–220 (ISSN 1365-294X, DOI 10.1111/j.1365-294X.2007.03522.x, lire en ligne, consulté le )
- (en) Steven A. Berkeley, Colin Chapman et Susan M. Sogard, « Maternal Age as a Determinant of Larval Growth and Survival in a Marine Fish, Sebastes Melanops », Ecology, vol. 85, , p. 1258–1264 (ISSN 1939-9170, DOI 10.1890/03-0706, lire en ligne, consulté le )
- (en) Simon Jennings,Michel J . Kaiser, The Effects of Fishing on Marine Ecosystems, Advances in Marine Biology VOL . 34, (ISBN 0-12-026134-0), p. 203-314
- (en) E. L. Charnov, R. L. Los-den Hartogh, W. T. Jones et J. van den Assem, « Sex ratio evolution in a variable environment », Nature, vol. 289, , p. 27–33 (DOI 10.1038/289027a0, lire en ligne, consulté le )
- Colin D. Buxton, « Life-history changes in exploited reef fishes on the east coast of South Africa », ResearchGate, vol. 36, (ISSN 0378-1909, DOI 10.1007/BF00005979, lire en ligne, consulté le )
- T Sato et S Goshima, « Impacts of male-only fishing and sperm limitation in manipulated populations of an unfished crab, Hapalogaster dentata », Marine Ecology Progress Series, vol. 313, , p. 193–204 (ISSN 0171-8630, DOI 10.3354/meps313193, lire en ligne, consulté le )
- (en) Jeffrey A. Hutchings et Julia K. Baum, « Measuring marine fish biodiversity: temporal changes in abundance, life history and demography », Philosophical Transactions of the Royal Society of London B: Biological Sciences, vol. 360, , p. 315–338 (ISSN 0962-8436 et 1471-2970, DOI 10.1098/rstb.2004.1586, lire en ligne, consulté le )
- (en) Ransom A. Myers, C. Andrea Ottensmeyer, Extinction Risk in Marine Species, Washington DC (USA), in Norse, E.A. and L.B. Crowder, eds. Marine Conservation Biology: The Science of Maintaining the Sea's Biodiversity. Island Press, (lire en ligne), p. 126-156
- Simon F. Thrush et Paul K. Dayton, « Disturbance to Marine Benthic Habitats by Trawling and Dredging: Implications for Marine Biodiversity », Annual Review of Ecology and Systematics, vol. 33, , p. 449–473 (lire en ligne, consulté le )
- Académie des sciences, rapport sur la science et la technologie no 17, Exploitation et surexploitation des ressources vivantes, Paris, Editions Tec & Doc, , 503 p. (ISBN 2-7430-0645-5), p. 18-19 Chap 1
- Académie des sciences, rapports sur la science et la technologie no 17, Exploitation et surexploitation des ressources marines vivantes, Paris, Editions Tec & Doc, , 503 p. (ISBN 2-7430-0645-5), p. 291 Chap 8
- Académie des sciences, rapports sur la science et la technologie N°17, Exploitation et surexploitation des ressources marines vivantes, Paris, Editions Tec & Doc, , 503 p. (ISBN 2-7430-0645-5), p. 297-299 Chap 8
- (en) Malcolm R. Clark, Franziska Althaus, Thomas A. Schlacher et Alan Williams, « The impacts of deep-sea fisheries on benthic communities: a review », ICES Journal of Marine Science: Journal du Conseil, vol. 73, , i51–i69 (ISSN 1054-3139 et 1095-9289, DOI 10.1093/icesjms/fsv123, lire en ligne, consulté le )
- (en) Daniel Pauly, Villy Christensen, Johanne Dalsgaard et Rainer Froese, « Fishing Down Marine Food Webs », Science, vol. 279, no 5352, , p. 860–863 (ISSN 0036-8075 et 1095-9203, PMID 9452385, DOI 10.1126/science.279.5352.860, lire en ligne, consulté le )
- Jeremy B. C. Jackson, Michael X. Kirby, Wolfgang H. Berger et Karen A. Bjorndal, « Historical Overfishing and the Recent Collapse of Coastal Ecosystems », Science, vol. 293, , p. 629–638 (lire en ligne, consulté le )
- (en) M. J. Tegner et P. K. Dayton, « Ecosystem effects of fishing in kelp forest communities », ICES Journal of Marine Science: Journal du Conseil, vol. 57, , p. 579–589 (ISSN 1054-3139 et 1095-9289, DOI 10.1006/jmsc.2000.0715, lire en ligne, consulté le )
- Céline Deluzarche, « 640.000 tonnes de matériel de pêche sont abandonnées en mer chaque année », sur futura-sciences.com, .
- (en) M. Begon, C.R. Townsend, J.L. Harper, Ecology , from individuals to ecosystems, Wiley- Blackwell (ISBN 978-1-4051-1117-1), p. 732
- « la situation mondiale des pêches et de l'aquaculture », sur fao.org
- « Encore beaucoup de poissons dans la Méditerranée ? Plus pour très longtemps », sur iucn.org
- (en) Christopher Costello, Steven D. Gaines et John Lynham, « Can Catch Shares Prevent Fisheries Collapse? », Science, vol. 321, , p. 1678–1681 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.1159478, lire en ligne, consulté le )
- (en) J. G. Hiddink, T. Hutton, S. Jennings et M. J. Kaiser, « Predicting the effects of area closures and fishing effort restrictions on the production, biomass, and species richness of benthic invertebrate communities », ICES Journal of Marine Science: Journal du Conseil, vol. 63, , p. 822–830 (ISSN 1054-3139 et 1095-9289, DOI 10.1016/j.icesjms.2006.02.006, lire en ligne, consulté le )
- (en) Rosamond L. Naylor, Rebecca J. Goldburg, Jurgenne H. Primavera et Nils Kautsky, « Effect of aquaculture on world fish supplies », Nature, vol. 405, , p. 1017–1024 (ISSN 0028-0836, DOI 10.1038/35016500, lire en ligne, consulté le )
- Académie des Sciences, rapports sur la science et la technologie N°17, Exploitation et surexploitation des ressources marines vivantes, Paris, Editions Tec & Doc, , 503 p. (ISBN 2-7430-0645-5), p. 265-285 Chap 7
- (en) I. M. Côté, I. Mosqueira et J. D. Reynolds, « Effects of marine reserve characteristics on the protection of fish populations: a meta-analysis », Journal of Fish Biology, vol. 59, , p. 178–189 (ISSN 1095-8649, DOI 10.1111/j.1095-8649.2001.tb01385.x, lire en ligne, consulté le )
- (en) Simon Jennings, « Patterns and Prediction of population recovery in marine reserves », Fish Biology and Fisheries, vol. 10, , p. 209–231 (ISSN 1095-8649, DOI 10.1023/A:1016619102955)
- June Raclet, « Var : premiers essais concluants pour les filets de pêche connectés », sur France 3 Régions, .