Glycolonitrile
Le glycolonitrile, également appelé hydroxyacétonitrile, cyanométhanol et nitrile glycolique, est un composé chimique de formule N≡C–CH2OH. Il s'agit d'un composé organique huileux incolore toxique et très soluble dans l'eau ainsi que dans l'éther diéthylique. C'est la plus simple des cyanhydrines, formée par addition de cyanure d'hydrogène HCN sur du formaldéhyde HCHO en milieu acide en présence d'une base[3] - [4] - [5]. Il polymérise facilement en milieu basique, de sorte qu'on le distribue en solution aqueuse acide concentrée à environ 50 à 70 %. Le produit de polymérisation étant une amine, au caractère basique, il s'ensuit que cette polymérisation est autocatalysée. Il se décompose facilement en formaldéhyde et cyanure d'hydrogène, ce qui en fait une substance extrêmement dangereuse. Le glycolonitrile est considéré comme une molécule importante de la chimie prébiotique[6] et a été détecté en 2019 dans le milieu interstellaire[7], à proximité d'IRAS 16293–2422B (en), dans la constellation d'Ophiuchus.
| Glycolonitrile | |
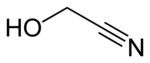
| |
| Structure du glycolonitrile | |
| Identification | |
|---|---|
| Nom UICPA | glycolonitrile |
| Synonymes |
2-hydroxyacétonitrile, |
| No CAS | |
| No ECHA | 100.003.155 |
| No CE | 203-469-1 |
| No RTECS | AM0350000 |
| PubChem | 7857 |
| ChEBI | 137685 |
| SMILES | |
| InChI | |
| Apparence | liquide huileux incolore[1] |
| Propriétés chimiques | |
| Formule | N≡C–CH2OH |
| Masse molaire[2] | 57,051 3 ± 0,002 3 g/mol C 42,11 %, H 5,3 %, N 24,55 %, O 28,04 %, |
| Propriétés physiques | |
| T° fusion | < −72 °C[1] |
| T° ébullition | 119 °C[1] à 2,4 kPa |
| Solubilité | très soluble dans l'eau[1] |
| Masse volumique | 1,1 g·cm-3[1] à 20 °C |
| Point d’éclair | 69 °C[1] |
| Pression de vapeur saturante | 100 Pa à 20 °C, 150 Pa à 30 °C, 300 Pa à 50 °C[1] |
| Précautions | |
| SGH[1] | |
 Danger |
|
| Transport[1] | |
| Écotoxicologie | |
| DL50 | 8 mg·kg-1 (souris, oral)[1] |
| Unités du SI et CNTP, sauf indication contraire. | |
Le glycolynitrile peut être obtenu en laboratoire avec un rendement de 76 à 80 % en faisant réagir des quantités équimolaires de cyanure de potassium KCN et de formaldéhyde HCHO en solution aqueuse après addition d'acide sulfurique H2SO4 dilué pour libérer du cyanure d'hydrogène HCN après extraction à l'éther diéthylique Et2O suivie d'une distillation sous vide[4].
Le glycolonitrile peut réagir avec l'ammoniac NH3 pour donner de l'aminoacétonitrile H2N–CH2–C≡N, ce dernier pouvant être hydrolysé pour donner de la glycine H2N–CH2–COOH :
- NH3 + HOCH2–C≡N ⟶ H2N–CH2–C≡N + H2O ;
- H2N–CH2–C≡N + 2 H2O ⟶ H2NCH2COOH + NH3.
L'EDTA, un chélateur important dans l'industrie, est produit à partir de glycolonitrile et d'éthylènediamine H2N–CH2–CH2–NH2, par hydrolyse du tétranitrile intermédiaire. L'acide nitrilotriacétique N(CH2COOH)3 est produit de manière semblable[5].
Notes et références
- Entrée « Hydroxyacetonitrile » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 11 mai 2019 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Louis Henri, « Sur le nitrile gycolique et la synthèse directe de l'acide glycolique », Comptes rendus hebdomadaires des séances de l'Académie des sciences, vol. 110, , p. 759 (lire en ligne)
- (en) Roger Gaudry, C. F. H. Allen et J. A. VanAllan, « Glycolonitrile », Organic syntheses, vol. 27, , p. 41 (DOI 10.15227/orgsyn.027.0041, lire en ligne)
- (en) Peter Pollak, Gérard Romeder, Ferdinand Hagedorn et Heinz‐Peter Gelbke, « Nitriles », Ullmann's Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a17_363, lire en ligne)
- (en) H. James CleavesII, « The prebiotic geochemistry of formaldehyde », Precambrian Research, vol. 164, nos 4-4, , p. 111-118 (DOI 10.1016/j.precamres.2008.04.002, Bibcode 2008PreR..164..111C, lire en ligne)
- (en) S. Zeng, D. Quénard, I. Jiménez-Serra, J. Martín-Pintado, V. M. Rivilla, L. Testi et R. Martín-Doménech, « First detection of the pre-biotic molecule glycolonitrile (HOCH2CN) in the interstellar medium », Monthly Notices of the Royal Astronomical Society: Letters, vol. 484, no 1, , L43–L48 (PMID 190102576, DOI 10.1093/mnrasl/slz002, Bibcode 2019MNRAS.484L..43Z, lire en ligne)
