Chlorure d'hexamminecobalt(III)
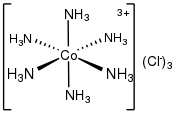
Le chlorure d'hexamminecobalt(III) est un sel de complexe métallique de formule chimique [Co(NH3)6]Cl3. Il s'agit d'un solide cristallisé inodore de couleur orange brunâtre et peu soluble dans l'eau. L'ébullition dans l'eau produit de l'hydroxyde de cobalt(II) Co(OH)2[3], tandis que des températures supérieures à 215 °C conduisent à sa décomposition avec libération d'ammoniac NH3[4]. Le cation [Co(NH3)6]3+ est un archétype de « complexe de Werner », du nom du chimiste suisse Alfred Werner pionnier de la chimie de coordination, formé de six ligands ammine NH3 liés à un centre cobalt à l'état d'oxydation +3.
| Chlorure d'hexamminecobalt(III) | |
| |
| Structure du chlorure d'hexamminecobalt(III) | |
| Identification | |
|---|---|
| Synonymes |
chlorure d'hexaamminecobalt(III) |
| No CAS | |
| No ECHA | 100.030.991 |
| No CE | 234-103-9 |
| PubChem | 159295 |
| ChEBI | 63021 |
| SMILES | |
| InChI | |
| Apparence | solide brun orangé[1] |
| Propriétés chimiques | |
| Formule | H18Cl3CoN6 |
| Masse molaire[2] | 267,475 ± 0,008 g/mol H 6,78 %, Cl 39,76 %, Co 22,03 %, N 31,42 %, |
| Propriétés physiques | |
| T° fusion | 217 °C[1] |
| Masse volumique | 1,7 g/cm3[1] |
| Propriétés biochimiques | |
| pH isoélectrique | 4 à 6[1] à 25 °C |
| Précautions | |
| SGH[1] | |
 Danger |
|
| NFPA 704[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Historiquement, les sels d'hexammine de cobalt(III) étaient décrits comme luteo (latin pour « jaune »), dénomination tombée en désuétude dans la mesure où la chimie moderne considère la couleur comme moins déterminante que la structure moléculaire pour caractériser une substance ; d'autres ammines de cobalt étaient également nommées en fonction de leur couleur, comme purpureo (« pourpre ») pour les complexes pentaammine, et praseo (« vert ») et violeo (« violet ») pour deux complexes tétraammine isomères[5].
Chloride.jpg.webp) Co(NH3)6Cl3 dans un verre de montre.
Co(NH3)6Cl3 dans un verre de montre.
Structure
Le cation [Co(NH3)6]3+ est diamagnétique, avec un centre Co(III) octaédrique 3d6 bas spin. Il respecte la règle des 18 électrons et est considéré comme un exemple classique de complexe métallique inerte. Son inertie chimique est telle que [Co(NH3)6]Cl3 peut être recristallisé tel quel dans l'acide chlorhydrique concentré : les ligands ammine NH3 sont si étroitement liés aux centres Co(III) qu'ils ne se dissocient pas pour permettre leur protonation en ammonium NH4+. En revanche, les ammines labiles telles que le chlorure d'hexaamminenickel(II) [Ni(NH3)6]Cl2 réagissent facilement avec les acides, reflétant la labilité des liaisons Ni(II)–NH3. Par chauffage, l'hexamminecobalt(III) commence à perdre certains de ses ligands ammine, ce qui conduit à un oxydant plus fort.
Les ions chlorure du [Co(NH3)6]Cl3 peuvent être échangés avec divers autres anions tels que nitrate, bromure, iodure ou sulfamate pour donner le dérivé [Co(NH3)6]X3 correspondant. Ces sels sont orange ou jaune vif et présentent divers degrés de solubilité dans l'eau. Les ions chlorure peuvent également être échangés avec des anions plus complexes tels que l'hexathiocyanatochromate(III) [Cr(SCN)6]3−, donnant un composé rose [Co(NH3)6][Cr(SCN)6], ou avec l'ion ferricyanure [Fe(CN)6]3−, donnant le sel [Co(NH3)6][Fe(CH)6].
Synthèse
On peut obtenir du [Co(NH3)6]Cl3 en traitant de l'hexahydrate de chlorure de cobalt(II) CoCl2·6H2O avec de l'ammoniac NH3 et du chlorure d'ammonium NH4Cl, puis en procédant à une oxydation ; les oxydants susceptibles d'être employés sont le peroxyde d'hydrogène H2O2 ou l'oxygène O2 en présence d'un catalyseur au charbon[6] :
Ce sel semble avoir été signalé pour la première fois en 1852 par Edmond Frémy[7]. Le sel d'acétate peut être préparé par oxydation aérobie de l'acétate de cobalt(II) (en) Co(CH3CO2)2, de l'acétate d'ammonium NH4CH3CO2 et de l'ammoniac NH3 dans du méthanol[8]. Ce sel d'acétate est très soluble dans l'eau à raison de 1,9 mol/L à 20 °C, contre 0,26 mol/L pour le trichlorure.
Applications
Le cation [Co(NH3)6]3+intervient dans certaines méthodes de biologie structurale — en particulier pour l'ADN ou l'ARN, pour lesquels les ions positifs stabilisent la structure tertiaire de l'ossature ose-phosphate — pour aider à résoudre leur structure tridimensionnelle par cristallographie aux rayons X[9] ou par résonance magnétique nucléaire[10]. Dans les systèmes biologiques, les contre-ions sont plus probablement Mg2+, mais les atomes de cobalt (ou parfois d'iridium, comme pour la structure PDB 2GIS) permettent d'utiliser la technique de diffusion anormale des rayons X (en) pour résoudre le problème de la phase (en) et produire une carte de la densité électronique de la structure[11].
Le cation [Co(NH3)6]3+ est un exemple inhabituel de complexe de métal trivalent ayant une certaine solubilité dans l'eau et est utile pour les applications d'écrantage de charge telles que la stabilisation de complexes fortement chargés négativement, par exemple les interactions avec et entre les acides nucléiques.
Notes et références
- « Fiche du composé Hexaamminecobalt(III) chloride, 99% », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (de) Georg Brauer, Handbuch der Präparativen Anorganischen Chemie, 3e édition, vol. 3, Ferdinand Enke, Stuttgart, 1981, p. 1675. (ISBN 3-432-87823-0)
- (en) Dale L. Perry, Handbook of Inorganic Compounds, Second Edition, Taylor & Francis, 2011, p. 191. (ISBN 1-4398-1462-7)
- (en) James E. Huheey, Inorganic Chemistry, 3e éd., Harper & Row, 1983, p. 360. (ISBN 978-0063503526)
- (en) Jannik Bjerrum, James P. McReynolds, Alfred L. Oppegard et R. W. Parry, « Hexamminecobalt(III) Salts », Inorganic Syntheses, vol. 2, , p. 216-221 (DOI 10.1002/9780470132333.ch69, lire en ligne).
- Edmond Frémy, « Recherches sur le cobalt », Annales de chimie et de physique, vol. 3, no 35, , p. 257-312 (lire en ligne).
- (en) Robert D. Lindholm et Daniel E. Bause, « Complexes of Cobalt Containing Ammonia or Ethylenl Diamine: Hexaamminecobalt(III) Salts », Inorganic Syntheses, vol. 18, , p. 67-69 (DOI 10.1002/9780470132494.ch14, lire en ligne).
- (en) B. Ramakrishnan, C. Sekharudu, B. Pan et M. Sundaralingam, « Near-atomic resolution crystal structure of an A-DNA decamer d(CCCGATCGGG): cobalt hexammine interaction with A-DNA », Acta Crystallographica Section D, vol. 59, no 1, , p. 67-72 (PMID 12499541, DOI 10.1107/S0907444902018917, lire en ligne).
- (en) Simon Rüdisser et Ignacio Tinoco Jr, « Solution structure of Cobalt(III)Hexammine complexed to the GAAA tetraloop, and metal-ion binding to G·A mismatches », Journal of Molecular Biology, vol. 295, no 5, , p. 1211-1223 (PMID 10653698, DOI 10.1006/jmbi.1999.3421, lire en ligne).
- (en) Alexander McPherson, Introduction to Macromolecular Crystallography, John Wiley & Sons, 2002. (ISBN 0-471-25122-4)
