Ferricyanure
Le ferricyanure est un anion de formule chimique [Fe(CN)6]3− dont le sel le plus courant est le ferricyanure de potassium K3Fe(CN)6, un solide cristallin rouge utilisé comme oxydant en chimie organique[2].
| Ferricyanure | |
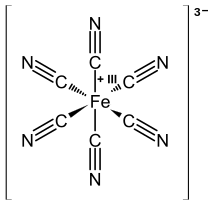  Structure de l'anion ferricyanure |
|
| Identification | |
|---|---|
| Nom UICPA | hexacyanure de fer(3+) |
| No CAS | |
| PubChem | 439210 |
| ChEBI | 5020 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C6N6Fe3+ |
| Masse molaire[1] | 211,949 ± 0,008 g/mol C 34 %, Fe 26,35 %, N 39,65 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
L'anion ferricyanure se compose d'un centre ferrique Fe3+ coordonné à six ligands cyanure CN− selon une géométrie moléculaire octaédrique. Ce complexe appartient au groupe de symétrie Oh. Le fer est facilement réduit en ferrocyanure [Fe(CN)6]4−, qui est un complexe ferreux Fe2+. Cette réaction d'oxydoréduction est réversible et ne nécessite pas la rupture de liaisons Fe–C.
- [Fe(CN)6]3− + e− ⇌ [Fe(CN)6]4−.
Ce couple redox est un standard en électrochimie.
Les ferricyanures sont bien moins toxiques que les autres cyanures, comme le cyanure de potassium KCN, en raison de la force de la liaison fer–cyanure : les ligands cyanure sont étroitement liés au fer et ne sont pas libérés facilement. Les ferricyanures réagissent cependant avec les acides minéraux en libérant du cyanure d'hydrogène, très toxique.
La réaction des ferricyanures avec les sels ferreux donne le bleu de Prusse, un pigment brillant de longue durée, utilisé autrefois dans les cyanotypes et les blueprints.
Les anions ferrocyanure et ferricyanure ne traversent pas la membrane plasmique. C'est la raison pour laquelle ils ont été utilisés en biochimie comme sondes pour accepteurs d'électrons extracellulaires dans les études relatives aux réactions d'oxydoréduction des cellules : la formation de ferrocyanure lors de l'introduction de ferricyanure peut ainsi être le signe de la présence de composés réducteurs ou d'une activité de transport des électrons à travers la membrane cellulaire.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Ernst Gail, Stephen Gos, Rupprecht Kulzer, Jürgen Lorösch, Andreas Rubo, Manfred Sauer, Raf Kellens, Jay Reddy, Norbert Steier et Wolfgang Hasenpusch, « Cyano Compounds, Inorganic », Ullmann's Encyclopedia of Industrial Chemistry, (lire en ligne) DOI 10.1002/14356007.a08_159.pub3