Ammine
En chimie de coordination, les ammines sont des complexes métalliques contenant au moins un ligand ammoniac NH3. Le terme « ammine » est orthographié avec deux « m » pour des raisons historiques, mais les ligands porteurs de groupes alkyle ou aryle sont orthographiés avec un seul « m » ; il est par ailleurs fréquent de rencontrer les deux formes dans la littérature, souvent avec un seul « m » même en l'absence de chaîne carbonée. Presque tous les ions métalliques se lient à l'ammoniac comme ligand, mais les exemples d'ammines les plus courants sont à base de chrome(III), de cobalt(III), de nickel(II) et de cuivre(II), ainsi que de plusieurs métaux du groupe du platine[1], comme le ruthénium et le tungstène.
ruthénium(II), généralement écrit avec un seul « m ».
Les ammines ont joué un rôle important dans le développement de la chimie de coordination, notamment dans la détermination de la stéréochimie et de la structure de ces composés. Elles peuvent être préparées facilement, et le rapport métal/azote peut être déterminé par analyse élémentaire. C'est en étudiant principalement des ammines que le chimiste suisse Alfred Werner a développé sa compréhension de la structure des composés de coordination qui lui a valu le prix Nobel de chimie en 1913[2] - [3]. L'une des premières ammines décrites a été le sel vert de Magnus [Pt(NH3)4][PtCl4], qui contient le cation tétraammine de platine [Pt(NH3)4]2+[4].
Liaisons et structure
L'ammoniac est une base de Lewis et un donneur σ « pur ». Comme la molécule NH3 est compacte, elle est sujette à des effets stériques négligeables. Ces éléments simplifient l'interprétation des résultats structuraux et spectroscopiques. La longueur de la liaison M–N de complexes [M(NH3)6]n+ a été étudiée par cristallographie aux rayons X[5].
| M | n+ | Distance M–N | Configuration électronique d | Particularités |
|---|---|---|---|---|
| Co | 3+ | 193,6 pm | t2g6 | Les trications bas spin sont de petite taille. |
| Co | 2+ | 211,4 pm | t2g5 eg2 | Charge réduite et population des orbitales eg. |
| Ru | 3+ | 210,4 pm | t2g5 | Trication bas spin de plus grande taille que Co3+. |
| Ru | 2+ | 214,4 pm | t2g6 | Dication bas spin. |
Exemples
On connaît des ammines homoleptiques de nombreux métaux de transition, le plus souvent de formule générale [M(NH3)6]n+, avec n = 2, 3, voire 4[6].
Métaux du groupe du platine
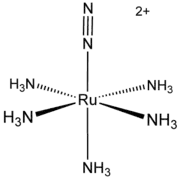
Les métaux du groupe du platine forment diverses ammines. Le cation pentaamine(diazote)ruthénium(II) et le complexe de Creutz-Taube [(Ru(NH3)5)2(C4H4N2)]5+ ont été particulièrement étudiés ou ont eu une importance historique particulière. Le cisplatine cis-PtCl2(NH3)2 est un anticancéreux important en chimiothérapie. Le pentaamminechlororhodium [RhCl(NH3)5]2+ intervient sous forme de dichlorure dans la purification du rhodium de ses minerais.
Cobalt(III) et chrome(III)
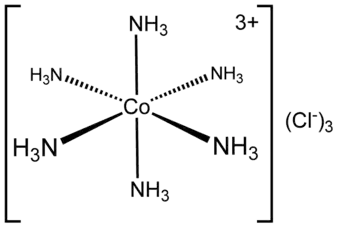
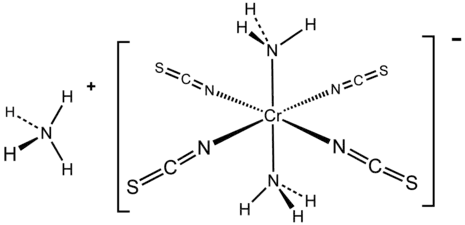
Les ammines de chrome(III) et de cobalt(III) revêtent une importance historique. Ces deux familles d'ammines sont cinétiquement relativement inertes, ce qui permet la séparation de leurs isomères[7]. Ainsi, le chlorure de tétraamminedichlorochrome(III) [Cr(NH3)4Cl2]Cl a une forme cis de couleur violette et une forme trans de couleur verte. En revanche, le chlorure d'hexamminecobalt(III) [Co(NH3)6]Cl3 n'a qu'un seul isomère. Le sel de Reinecke NH4[Cr(NCS)4(NH3)2] a été décrit pour la première fois en 1863[8].
Nickel(II), zinc(II), cuivre(II)
Le zinc(II) forme une tétrammine incolore de formule [Zn(NH3)4]2+[9]. Comme la plupart des complexes de zinc, la tétrammine présente une géométrie tétraédrique. L'hexammine de nickel(II) [Ni(NH3)6]2+ est violette et celle de cuivre(II) est bleu foncé.
Cuivre(I), argent(I) et or(I)
Le cuivre(I) ne forme avec l'ammoniac que des complexes labiles, dont le cation [Cu(NH3)3]+ de géométrie plane trigonale[10]. L'argent(I) donne la diammine [Ag(NH3)2]+ avec une géométrie de coordination linéaire[11]. C'est le complexe qui se forme lorsque le chlorure d'argent AgCl, généralement insoluble, se dissout dans l'ammoniaque. C'est également ce complexe qui est la substance active du réactif de Tollens Ag(NH3)2OH. Le chlorure d'or(I) AuCl forme une espèce avec six molécules d'ammoniac, mais la cristallographie aux rayons X révèle que seules deux molécules d'ammoniac sont des ligands d'un complexe avec l'or[12].
Réactions
Échange de ligands et réactions d'oxydoréduction
L'ammoniac étant un ligand plus fort que l'eau dans la série spectrochimique, les ammines sont plus stables que les complexes aqua correspondants. Elles sont également moins oxydantes que les complexes aqua correspondants pour des raisons similaires, ce qu'on observe à travers la stabilité du cation [Co(NH3)6]3+ en solution aqueuse, tandis que le cation [Co(H2O)6]3+ n'existe pas en solution aqueuse car il oxyderait l'eau.
Réactions acido-basiques
Une fois complexé à un ion métallique, l'ammoniac n'est plus basique. Ceci est illustré par la stabilité de certains complexes métal-ammine dans des solutions acides fortes. Lorsque la liaison M–NH3 est faible, le ligand ammine se dissocie, et il s'ensuit une protonation. Cela s'observe par le fait que les acides réagissent avec [Ni(NH3)6]2+ mais pas avec [Co(NH3)6]3+.
Les ligands ammine sont plus acides que l'ammoniac (pKa ~ 33). Pour les complexes fortement cationiques tels que [Pt(NH3)6]4+, on peut obtenir la base conjuguée. La déprotonation d'halogénures d'ammines de cobalt(III) tels que [CoCl(NH3)5]2+ labilise la liaison Co–Cl par mécanisme SN1CB (en). La déprotonation peut être combinée à l'oxydation, ce qui permet de convertir une ammine en complexe de nitrosyle (en)[13] :
Applications
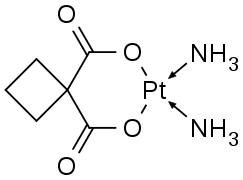
On connaît de nombreuses applications aux ammines. La plus connue est le cisplatine cis-PtCl2(NH3)2, anticancéreux utilisé en chimiothérapie[14]. Diverses autres ammines de métaux du groupe du platine ont été évaluées pour cet usage.
Plusieurs procédés de séparation des différents métaux du groupe du platine de leurs minerais reposent sur la précipation de [RhCl(NH3)5]Cl2. Certains procédés permettent de purifier le palladium en jouant sur des équilibres impliquant les complexes [Pd(NH3)4]Cl2, PdCl2(NH3)2 et Pt(NH3)4[PdCl4].
Lors du traitement de la cellulose, l'ammine de cuivre appelée réactif de Schweizer [Cu(NH3)4(H2O)2](OH)2 est parfois utilisée pour solubiliser le polymère. On obtient ce réactif en traitant une solution aqueuse de cations de cuivre(II) avec de l'ammoniac ; il se forme un précipité bleu clair qui se redissout par addition d'un excès d'ammoniac :
Le fluorure de diammine d'argent [Ag(NH3)2]F est un médicament topique qui peut être utilisé pour traiter et prévenir les caries dentaires et soulager l'hypersensibilité dentinaire[15].
Notes et références
- (en) A. von Zelewsky, Stereochemistry of Coordination Compounds, John Wiley, 1995. (ISBN 0-471-95599-X)
- (en) Alfred Werner, « On the constitution and configuration of higher-order compounds » [PDF], sur https://www.nobelprize.org/, (consulté le ).
- (en) « The Nobel Prize in Chemistry 1913 », sur https://www.nobelprize.org/ (consulté le ).
- (en) Masao Atoji, James W. Richardson et R. E. Rundle, « On the Crystal Structures of the Magnus Salts, Pt(NH3)4PtCl4 », Journal of the American Chemical Society, vol. 79, no 12, , p. 3017-3020 (DOI 10.1021/ja01569a009, lire en ligne)
- (en) Neil J. Hair et James K. Beattie, « Structure of hexaaquairon(III) nitrate trihydrate. Comparison of iron(II) and iron(III) bond lengths in high-spin octahedral environments », Inorganic Chemistry, vol. 16, no 2, , p. 245-250 (DOI 10.1021/ic50168a006, lire en ligne)
- (de) Ralf Eßmann, Guido Kreiner, Anke Niemann, Dirk Rechenbach, Axel Schmieding, Thomas Sichla, Uwe Zachwieja et Herbert Jacobs, « Isotype Strukturen einiger Hexaamminmetall(II)-halogenide von 3d-Metallen: [V(NH3)6]I2, [Cr(NH3)6]I2, [Mn(NH3)6]Cl2, [Fe(NH3)6]Cl2, [Fe(NH3)6]Br2, [Co(NH3)6]Br2 und [Ni(NH3)6]Cl2 », Zeitschrift für anorganische und algemeine Chemie, vol. 622, no 7, , p. 1161-1166 (DOI 10.1002/zaac.19966220709, lire en ligne)
- (en) F. Basolo et R. G. Pearson, Mechanisms of Inorganic Reactions, John Wiley and Son, New York, 1967. (ISBN 0-471-05545-X)
- (de) A. Reinecke, « Ueber Rhodanchromammonium-Verbindungen », Justus Liebigs Annalen der Chemie, vol. 126, no 1, , p. 113-118 (DOI 10.1002/jlac.18631260116, lire en ligne)
- (en) R. Eßmann, « Influence of coordination on N–H⋯X− hydrogen bonds. Part 1. [Zn(NH3)4]Br2 and [Zn(NH3)4]I2 », Journal of Molecular Structure, vol. 356, no 3, , p. 201-206 (DOI 10.1016/0022-2860(95)08957-W, Bibcode 1995JMoSt.356..201E, lire en ligne)
- (en) Kersti B. Nilsson et Ingmar Persson, « The coordination chemistry of copper(I) in liquid ammonia, trialkyl and triphenyl phosphite, and tri-n-butylphosphine solution », Dalton Transactions, no 9, , p. 1312-1319 (PMID 15252623, DOI 10.1039/B400888J, lire en ligne)
- (en) Kersti B. Nilsson, Ingmar Persson et Vadim G. Kessler, « Coordination Chemistry of the Solvated AgI and AuI Ions in Liquid and Aqueous Ammonia, Trialkyl and Triphenyl Phosphite, and Tri-n-butylphosphine Solutions », Inorganic Chemistry, vol. 45, no 17, , p. 6912-6921 (PMID 16903749, DOI 10.1021/ic060175v, lire en ligne)
- (en) Lavinia M. Scherf, Sebastian A. Baer, Florian Kraus, Salem M. Bawaked et Hubert Schmidbaur, « Implications of the Crystal Structure of the Ammonia Solvate [Au(NH3)2]Cl·4NH3 », Inorganic Chemistry, vol. 52, no 4, , p. 2157-2161 (PMID 23379897, DOI 10.1021/ic302550q, lire en ligne)
- (en) Peter L. Dunn, Brian J. Cook, Samantha I. Johnson, Aaron M. Appel et R. Morris Bullock, « Oxidation of Ammonia with Molecular Complexes », Journal of the American Chemical Society, vol. 142, no 42, , p. 17845-17858 (PMID 32977718, DOI 10.1021/jacs.0c08269, S2CID 221938378, lire en ligne)
- (en) S. J. Lippard et J. M. Berg, Principles of Bioinorganic Chemistry, University Science Books, Mill Valley, 1994. (ISBN 0-935702-73-3)
- (en) A. Rosenblatt, T.C.M. Stamford et R. Niederman, « Silver Diamine Fluoride: A Caries “Silver-Fluoride Bullet” », Journal of Dental Research, vol. 88, no 2, , p. 116-125 (PMID 19278981, DOI 10.1177/0022034508329406, S2CID 30730306, lire en ligne)

Cl2.png.webp)