Chlorure de pentaamine(diazote)ruthénium(II)
Le chlorure de pentaamine(diazote)ruthénium(II)[alpha 1] est un complexe de formule chimique [Ru(NH3)5(N2)]Cl2. Il se présente sous la forme d'un solide blanchâtre dont les solutions sont jaunes. Il a un intérêt historique comme premier complexe de diazote lié à un atome métallique. [Ru(NH3)5(N2)]2+[2] - [3]. [Ru(NH3)5(N2)]2+ adopte une géométrie moléculaire octaédrique de symétrie C4v[4].
| Chlorure de pentaamine(diazote)ruthénium(II) | |
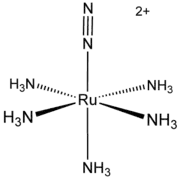
| |
| Structure du cation pentaamine(diazote)ruthénium(II) | |
| Identification | |
|---|---|
| Synonymes |
chlorure de pentaammine(diazote)ruthénium(II) |
| No CAS | |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | H15Cl2N7Ru |
| Masse molaire[1] | 285,14 ± 0,03 g/mol H 5,3 %, Cl 24,87 %, N 34,39 %, Ru 35,45 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
Le chlorure de pentaamine(diazote)ruthénium(II) est produit en solution aqueuse à partir de chlorure de pentaaminechlororuthénium(III) [Ru(NH3)5Cl]Cl2, d'azoture de sodium NaN3 et d'acide méthylsulfonique CH3SO3H[5] :
- [Ru(NH3)5Cl]Cl2 + NaN3 ⟶ [Ru(NH3)5N2]Cl2 + ...
S'il doit être formé in situ, il peut être obtenu plus simplement à partir de chlorure de ruthénium(III) RuCl3 et d'hydrate d'hydrazine N2H4·H2O[5] :
Ce complexe de diazote est stable en solution aqueuse et a un taux d'échange de ligand relativement faible avec l'eau. Comme il s'agit d'un complexe d6, la liaison Ru–N est stabilisée par rétrocoordination π, cession d'électrons d'orbitale d aux orbitales π* antiliantes[6].
Le ligand diazote n'est pas réduit par le borohydrure de sodium NaBH4 en solution aqueuse[7]. Presque toutes les réactions connues pour ce composé sont des réactions de déplacement. Les halogénures de pentaamine(halogène)ruthénium(II) peuvent être produits en traitant le [Ru(NH3)5N2]2+ avec des sources d'halogénures[5] :
Le [Ru(NH3)5N2]2+ forme également le complexe symétrique [(NH3)5Ru–NN–Ru(NH3)5]4+[8] - [9].
Notes et références
- Ce composé est plus souvent écrit avec un seul « m » dans la littérature bien qu'il s'agisse d'une ammine et devrait donc être orthographié « chlorure de pentaammine(diazote)ruthénium(II) », avec deux « m ».
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) A. D. Allen et C. V. Senoff, « Nitrogenopentammineruthenium(II) complexes », Chemical Communications (London), no 24, , p. 621-622 (DOI 10.1039/c19650000621, lire en ligne)
- (en) Caesar V. Senoff, « The discovery of [Ru(NH3)5N2]2+: A case of serendipity and the scientific method », Journal of Chemical Education, vol. 67, no 5, , p. 368 (DOI 10.1021/ed067p368, Bibcode 1990JChEd..67..368S, lire en ligne)
- (en) J. E. Fergusson, J. L. Love et Ward T. Robinson, « Crystal and molecular structure of dinitrogenpentaammineosmium(II) chloride, [Os(NH3)5N2]Cl2, and related ruthenium complexes », Inorganic Chemistry, vol. 11, no 7, , p. 1662-1666 (DOI 10.1021/ic50113a042, lire en ligne)
- (en) A. D. Allen, F. Bottomley, R. O. Harris, V. P. Reinsalu, C. V. Senoff et David W. Badger, « Pentaammine(nitrogen)ruthenium(II) Salts and Other Ammines of Ruthenium », Inorganic Syntheses, vol. 12, (DOI 10.1002/9780470132432.ch1, lire en ligne)
- (en) H. Taube, « Chemistry of ruthenium(II) and osmium(II) ammines », Pure and Applied Chemistry, vol. 51, , p. 901-912 (DOI 10.1351/pac197951040901, lire en ligne)
- (en) J. Chatt, R. L. Richards, J. E. Fergusson et J. L. Love, « The reduction of nitrogen complexes », Chemical Communications (London), no 23, , p. 1522-1523 (DOI 10.1039/c19680001522, lire en ligne)
- (en) D. F. Harrison, E. Weissbergerand et H. Taube, « Binuclear Ion Containing Nitrogen as a Bridging Group », Science, vol. 159, no 3812, , p. 320-322 (PMID 5634502, DOI 10.1126/science.159.3812.320, JSTOR 1722595, Bibcode 1968Sci...159..320H, lire en ligne)
- (en) J. Chatt, « Molecular nitrogen as a ligand », Pure and Applied Chemistry, vol. 24, no 2, , p. 425-442 (DOI 10.1351/pac197024020425, lire en ligne)