Sel vert de Magnus
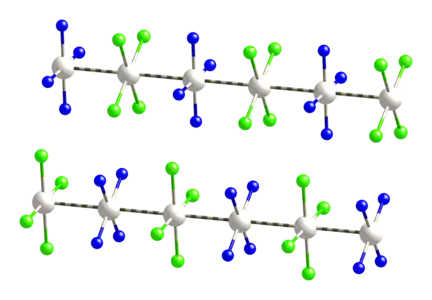
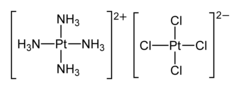
Le sel vert de Magnus est un composé chimique de formule [Pt(NH3)4][PtCl4]. Il s'agit d'un sel formé d'un cation tétraammineplatine(II) [Pt(NH3)4]2+, une ammine homoleptique de platine(II), et d'un anion tétrachloroplatinate(II) [PtCl4]2−. Ces deux ions ont, comme de nombreux complexes de platine(II), une géométrie plane carrée et forment des chaînes dans lesquelles ils alternent en conformation décalée, les atomes de platine étant séparés de 325 pm[3] :
| Sel vert de Magnus | |
| |
| Ions constitutifs du sel vert de Magnus | |
| Identification | |
|---|---|
| Nom UICPA | tétrachloroplatinate(II) de tétraammineplatine(II) |
| No CAS | |
| No ECHA | 100.034.078 |
| No CE | 237-501-0 |
| PubChem | 102601645 |
| SMILES | |
| InChI | |
| Apparence | solide vert[1] |
| Propriétés chimiques | |
| Formule | H12Cl4N4Pt2 |
| Masse molaire[2] | 600,102 ± 0,028 g/mol H 2,02 %, Cl 23,63 %, N 9,34 %, Pt 65,01 %, |
| Propriétés physiques | |
| T° fusion | 320 °C[1] |
| Masse volumique | 4 g/cm3[1] à 20 °C |
| Précautions | |
| SGH[1] | |
   Danger |
|
| NFPA 704[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Comme son nom l'indique, ce solide est de couleur vert foncé, ce qui est inhabituel pour les composés du platine. Il doit son nom à sa découverte dans les années 1830 par le chimiste prussien Heinrich Gustav Magnus. Il a des propriétés semiconductrices. On peut l'obtenir en faisant réagir directement des solutions contenant les ions qui le constituent, ce qui donne un précipité vert foncé[4] :
- [Pt(NH3)4]2+ + [PtCl4]2− ⟶ [Pt(NH3)4][PtCl4]↓.
Dans certains conditions, cette réaction donne un polymorphe rose, connu sous le nom de « sel rose de Magnus », dans lequel les ions plans de platine ne sont pas empilés[5]. Il est possible d'obtenir un analogue soluble dans l'eau du sel vert de Magnus en remplaçant les ligands ammoniac NH3 par des ligands aminoalcane linéaires ou ramifiés, comme l'éthylhexylamine CH3CH2CH2CH2CH(CH2CH3)CH2NH2, qui donne un solide violet[6] - [7].
Notes et références
- « Fiche du composé Tetraammineplatinum(II) tetrachloroplatinate(II) », sur Alfa Aesar (consulté le ).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Masao Atoji, James W. Richardson et R. E. Rundle, « On the Crystal Structures of the Magnus Salts, Pt(NH3)4PtCl4 », Journal of the American Chemical Society, vol. 79, no 12, , p. 3017-3020 (DOI 10.1021/ja01569a009, lire en ligne)
- (en) R. N. Keller, Therald Moeller et J. V. Quagliano, « Tetrammineplatinum(II) Chloride: (Tetrammineplatinous Chloride) », Inorganic Syntheses, vol. 2, , p. 250-253 (DOI 10.1002/9780470132333.ch80, lire en ligne)
- (en) Bryan E. G. Lucier, Karen E. Johnston, Wenqian Xu, Jonathan C. Hanson, Sanjaya D. Senanayake, Siyu Yao, Megan W. Bourassa, Monika Srebro, Jochen Autschbach et Robert W. Schurko, « Unravelling the Structure of Magnus’ Pink Salt », Journal of the American Chemical Society, vol. 136, no 4, , p. 1333-1351 (PMID 24437378, DOI 10.1021/ja4076277, lire en ligne)
-
(en) Walter Caseri, « Derivatives of Magnus green salt: From intractable materials to solution-processed transistors », Platinum metals review, vol. 48, no 3, , p. 91-100 (DOI 10.1595/147106704X1504, lire en ligne
 )
) - (en) Juliane Bremi, Walter Caseri et Paul Smith, « A new compound derived from Magnus' green salt: solid state structure and evidence for platinum chains in solution », Journal of Materials Chemistry, vol. 11, no 10, , p. 2593-2596 (DOI 10.1039/B104675F, S2CID 95456246, lire en ligne)