Arséniate
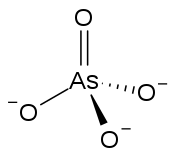
En chimie inorganique, un arséniate est un sel d'acide arsénique H3AsO4, contenant l'ion arséniate AsO43−, de façon analogue aux phosphates PO43− par rapport à l'acide phosphorique H3PO4. C'est un poison violent pour les êtres vivants, en bloquant notamment la formation d'ATP par la glycolyse.
| Arséniate | |
| |
| Structure de l'ion arséniate. | |
| Identification | |
|---|---|
| Nom UICPA | arsorate |
| Synonymes |
tétraoxoarséniate(V) |
| No CAS | |
| PubChem | 27401 |
| ChEBI | 29125 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | AsO4 |
| Masse molaire[1] | 138,919 2 ± 0,001 2 g/mol As 53,93 %, O 46,07 %, |
| Unités du SI et CNTP, sauf indication contraire. | |
C'est la forme la plus fréquente de l'arsenic dans le sol. Confondu avec les phosphates qui sont un nutriment des plantes, il peut pénétrer les racines et contaminer les végétaux. Mais plusieurs espèces ou souches de plantes y ont développé une certaine résistance[2], dont la Houlque laineuse[3] - [4] - [5] - [6] - [7], ou encore Deschampsia cespitosa (L.) Beauv[8] et Agrostis capillaris[8].
En minéralogie
Les arséniates sont des minéraux rares, toxiques sous certaines formes (certains contiennent de plus du plomb outre l'arsenic qu'ils contiennent tous).
On les trouve surtout dans la zone d'oxydation des gisements métallifères. Ils s'y forment aux dépens des sulfures, sulfo-arséniures et des arséniures.
On en compte une vingtaine d'espèces.
La forme générale est AsO43− avec d'autres éléments pour compenser les trois charges négatives.
Exemples :
En biologie
Réduction en arsénite
Le potentiel redox standard du couple As(III)/As(V) est de +560 mV, ce qui fait que dans les conditions réductrices du cytoplasme, les ions arséniates sont progressivement convertis en arsénite. L'arsénite réagit fortement avec les fonctions thiols. Ceci conduit à l'inactivation de l'acide lipoïque qui est le cofacteur de la pyruvate déshydrogénase et de la 2-oxoglutarate déshydrogénase impliquées dans le cycle de Krebs. Un grand nombre d'enzymes contenant des cystéines dans leur site actif sont également inhibées irréversiblement en présence d'arsénite. C'est le principal mécanisme de toxicité cellulaire de l'arsenic[9].
Empoisonnement de la glycolyse
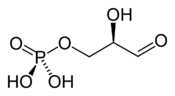
Les composés de l'arsenic sont très toxiques pour les organismes vivants terrestres dans la mesure où ils se comportent en analogues chimiques des composés biologiques phosphorés sans avoir exactement les mêmes propriétés thermodynamiques. En particulier, les composés arséniés sont sensiblement moins stables que leurs homologues phosphorés. Ainsi, l'anion hydrogénoarséniate HAsO42− peut prendre la place d'un hydrogénophosphate HPO42− (couramment appelé phosphate inorganique abrégé en Pi) à la septième étape de la glycolyse conduisant normalement à la formation de 1,3-bisphosphoglycérate par la glycéraldéhyde phosphate déshydrogénase :
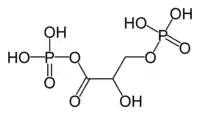
Le 1-arsénio-3-phosphoglycérate, qui se forme par incorporation d'arséniate au lieu de phosphate, est bien moins stable que le 1,3-bisphosphoglycérate et s'hydrolyse avant d'avoir pu former l'ATP à l'étape suivante de la glycolyse, catalysée par la phosphoglycérate kinase :
C'est la raison pour laquelle l'ion arséniate conduit rapidement à la mort cellulaire, en privant la cellule de son ATP, c'est-à-dire de son énergie métabolique, dont la glycolyse est la source principale.
Cas de la bactérie GFAJ-1 du lac Mono
Cependant, une équipe de biologistes de la NASA a publié en décembre 2010 la découverte dans le lac Mono, en Californie, d'une bactérie (GFAJ-1) susceptible de se développer dans un environnement où le phosphore a été remplacé par de l'arsenic[10] : les bactéries cultivées dans un tel milieu se développent à raison de 60 % de la vitesse normale de croissance en présence de phosphore, et atteignent des tailles 50 % plus élevées, en rapport semble-t-il avec la présence de grandes vacuoles[11].
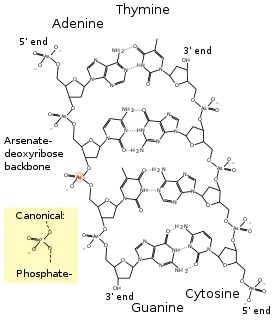
La distribution de l'arsenic 73 radioactif dans les fragments de ces bactéries laisse penser que l'arsenic aurait été incorporé dans les lipides, les protéines et les acides nucléiques[12] — a priori dans l'armature de désoxyribose phosphate portant les bases nucléiques dans les doubles-brins d'ADN constituant leur matériel génétique. Il reste cependant à isoler et caractériser les composés arséniés indirectement détectés par cette expérience afin de vérifier s'ils sont biologiquement actifs, de préciser jusqu'à quel point l'arsenic a pu remplacer le phosphore dans la biochimie de ces organismes, et, le cas échéant, d'étudier comment ces bactéries compenseraient, au niveau de leur biologie cellulaire et moléculaire, la stabilité inférieure des composés arséniés par rapport à leurs homologues phosphorés.
Dès la publication originale, cette interprétation de l'incorporation de l'arséniate dans les composés biologiques a suscité un important scepticisme dans la communauté scientifique[13], pour un ensemble de raisons à la fois fondamentales évoquées ci-dessus et d'autres plus techniques : l'arséniate est réduit en arsénite dans le cytoplasme, les esters d'arséniate sont très instables, les contrôles expérimentaux de l'article original étaient critiquables et certaines preuves indirectes.
Deux ans plus tard, plusieurs groupes ont invalidé les propositions initiales des équipes de la NASA. GFAJ-1 n'incorpore pas d'arsenic dans l'ADN ou dans d'autres composés biologiques, même en présence de concentrations élevées d'arséniate dans le milieu de culture. Au contraire, il s'avère que ce micro-organisme a développé des capacités de résistance élevées à l'arsenic et est capable de récupérer les traces de phosphate résiduel pour assurer sa croissance[14].
Articles connexes
Liens externes
- (fr)
Bibliographie
Références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) A.A. Meharg, « Integrated tolerance mechanisms: constitutive and adaptive plant responses to elevated metal concentrations in the environment », Plant, Cell & Environment, vol. 17, no 9, , p. 989–993 (DOI 10.1111/j.1365-3040.1994.tb02032.x)
- (en) A.A. Meharg, J. Bailey, K. Breadmore et M.R. Macnair, « Biomass allocation, phosphorus nutrition and vesicular-arbuscular mycorrhizal infection in clones of Yorkshire Fog, Holcus lanatus L. (Poaceae) that differ in their phosphate uptake kinetics and tolerance to arsenate », Plant and Soil, vol. 160, no 1, , p. 11–20 (DOI 10.1007/BF00150341)
- (en) A.A. Meharg, Q.J. Cumbes et M.R. Macnair, « The genetics of arsenate tolerance in Yorkshire fog, Holcus lanatus L. », Heredity, vol. 69, , p. 325–335 (DOI 10.1038/hdy.1992.132)
- (en) A.A. Meharg, Q.J. Cumbes et M.R. Macnair, « Pre-Adaptation of Yorkshire Fog, Holcus lanatus L. (Poaceae) to Arsenate Tolerance », Evolution, vol. 47, no 1, , p. 313–316 (résumé)
- (en) A.A. Meharg et M.R. Macnair, « Suppression of the High Affinity Phosphate Uptake System: A Mechanism of Arsenate Tolerance in Holcus lanatus L. », Journal of Experimental Botany, vol. 43, no 4, , p. 519–524 (DOI 10.1093/jxb/43.4.519)
- (en) A.A. Meharg et M.R. Macnair, « Relationship between plant phosphorus status and the kinetics of arsenate influx in clones ofdeschampsia cespitosa (L.) beauv. that differ in their tolerance to arsenate », Plant and Soil, vol. 162, no 1, , p. 99–106 (DOI 10.1007/BF01416094)
- (en) A.A. Meharg et M.R. Macnair, « The mechanisms of arsenate tolerance in Deschampsia cespitosa (L.) Beauv. and Agrostis capillaris L. », New Phytologist, vol. 119, no 2, , p. 291–297 (DOI 10.1111/j.1469-8137.1991.tb01033.x)
- Sabina C. Grund, Kunibert Hanusch et Hans Uwe Wolf, Ullmann Encyclopedia of Industrial Chemistry, (DOI 10.1002/14356007.a03_113.pub2, lire en ligne), « Arsenic and Arsenic Compounds »
- (en) Felisa Wolfe-Simon, Jodi Switzer Blum, Thomas R. Kulp, Gwyneth W. Gordon, Shelley E. Hoeft, Jennifer Pett-Ridge, John F. Stolz, Samuel M. Webb, Peter K. Weber, Paul C. W. Davies, Ariel D. Anbar et Ronald S. Oremland, « A Bacterium That Can Grow by Using Arsenic Instead of Phosphorus », Science, vol. 332, no 6034, , p. 1163−1166 (DOI 10.1126/science.1197258)
- (en) Felisa Wolfe-Simon, Jodi Switzer Blum, Thomas R. Kulp, Gwyneth W. Gordon, Shelley E. Hoeft, Jennifer Pett-Ridge, John F. Stolz,5 Samuel M. Webb, Peter K. Weber, Paul C. W. Davies, Ariel D. Anbar et Ronald S. Oremland, « Documents de support mis en ligne pour l'article « A Bacterium That Can Grow by Using Arsenic Instead of Phosphorus » »
- (en) Alla Katsnelson, « Arsenic-eating microbe may redefine chemistry of life », Nature, (DOI 10.1038/news.2010.645)
- (en) R.J. Redfield, « Comment on “A Bacterium That Can Grow by Using Arsenic Instead of Phosphorus” », Science, vol. 332, , p. 1149 (PMID 21622706, DOI 10.1126/science.1201482), (en) B. Schoepp-Cothenet, W. Nitschke, L.M. Barge, A. Ponce, M.J. Russell et A.I. Tsapin, « Comment on “A Bacterium That Can Grow by Using Arsenic Instead of Phosphorus” », Science, vol. 332, , p. 1149 (PMID 21622707, DOI 10.1126/science.1201438)
- (en) M.L. Reaves, S. Sinha, J.D. Rabinowitz, L. Kruglyak et R.J. Redfield, « Absence of Detectable Arsenate in DNA from Arsenate-Grown GFAJ-1 Cells », Science, vol. 337, , p. 470-473 (PMID 22773140, DOI 10.1126/science.1219861)

.jpg.webp)
.jpg.webp)