Acide bromoacétique
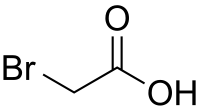
L'acide bromoacétique (ou monobromoacétique) est un composé organique dérivé de l'acide acétique (acide éthanoïque), où l'un des atomes d'hydrogène du groupe méthyle a été substitué par un atome de brome. Ses sels sont appelés bromoacétates.
| Acide bromoacétique | |
| |
| Identification | |
|---|---|
| Nom UICPA | acide bromoéthanoïque |
| No CAS | |
| No ECHA | 100.001.069 |
| No CE | 201-175-8 |
| SMILES | |
| InChI | |
| Apparence | cristaux incolores |
| Propriétés chimiques | |
| Formule | C2H3BrO2 [Isomères] |
| Masse molaire[1] | 138,948 ± 0,003 g/mol C 17,29 %, H 2,18 %, Br 57,51 %, O 23,03 %, |
| pKa | 2,69 |
| Propriétés physiques | |
| T° fusion | 50 °C[2] |
| T° ébullition | 208 °C[2] |
| Solubilité | 93,8 g l−1 (eau, 25 °C)[2] |
| Miscibilité | dans l'eau, l'éthanol et les éthers[3] |
| Masse volumique | 1,93 g cm−3 (20 °C)[2] |
| Point d’éclair | > 112 °C (coupelle fermée)[2] |
| Pression de vapeur saturante | 0,07 mbar (20 °C)[2]
0,17 mbar (30 °C)[2] 0,95 mbar (50 °C) |
| Propriétés optiques | |
| Indice de réfraction | 1,4804 (50 °C)[3] |
| Précautions | |
| SGH | |
    |
|
| NFPA 704 | |
| Directive 67/548/EEC | |
| Transport | |
| Écotoxicologie | |
| DL50 | 100 mg kg−1 (souris, oral)[4] 66 mg kg−1 (souris, i.p.)[5] |
| LogP | 0,41[2] |
| Composés apparentés | |
| Autres composés | |
| Unités du SI et CNTP, sauf indication contraire. | |
Propriétés
L'acide bromoacétique se présente sous la forme de cristaux incolores ayant une odeur âcre, qui fondent vers 50 °C et se dissolvent facilement dans l'eau, l'éthanol, l'éther diéthylique et dans d'autres solvants organiques. Sa solution aqueuse est fortement acide, beaucoup plus acide que l'acide acétique (pKa de 2,69 contre 4,76 pour ce dernier), car l'anion bromoacétate ainsi formé est stabilisé par l'atome de brome, électronégatif, et qui permet ainsi de mieux délocaliser la charge négative dans la molécule.
Synthèse
L'acide bromoacétique peut être synthétisé par bromation de l'acide acétique[6]
Il peut aussi être obtenu par réaction de l'acide chloroacétique avec la bromure de potassium, par réaction de substitution nucléophile :
Utilisations
L'acide bromacétique est un produit de départ pour de nombreuses synthèses, par exemple de pesticides ou de médicaments. Il a été utilisé de façon directe comme conservateur alimentaire, mais cette utilisation est désormais interdite dans la plupart des états.
L'acide bromacétique est un alkylant fort et possède un effet inhibiteur sur les enzymes portant un groupe -SH (thiol), -OH (alcool) ou NH2 (amine) sur leur site actif. Il a autrefois été utilisé pour adoucir le vin français[7]. Un scandale éclata dans les années 1980 en RFA quand fut découverte son utilisation comme conservateur de la bière[8].
Les esters volatils de l'acide bromoacétique sont utilisés comme gaz lacrymogènes ; ils sont irritants pour le système respiratoire et les yeux, et peuvent être nocifs. À des concentrations plus élevées, ils sont corrosifs et peuvent causer des dommages permanents aux yeux.
Notes et références
- (de) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en allemand intitulé « Bromessigsäure » (voir la liste des auteurs).
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée du numéro CAS « 79-08-3 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais) (JavaScript nécessaire).
- (en) William M. Haynes, CRC Handbook of Chemistry and Physics, CRC Press, 2014-2015, 95e éd., 2666 p. (ISBN 978-1-4822-08672), p. 203.
- United States Environmental Protection Agency, Office of Pesticides and Toxic Substances, vol. 8EHQ-0391-1149.
- Journal of the National Cancer Institute, vol. 31, p. 297, 1963.
- Natelson, S. et Gottfried, S., Ethyl Bromoacetate, Org. Synth., coll. « vol. 3 », , p. 381.
- (de) Universität Regensburg: Essigsäure eine „Allerweltssubstanz“.
- (de) Kantonales Amt für Lebensmittelkontrolle St.Gallen.





