Écologie stœchiométrique
L’écologie stœchiométrique est l’étude de l’équilibre des éléments chimiques[1] dans les processus écologiques. Cela signifie qu’elle étudie la façon dont les éléments chimiques (particulièrement le carbone, l’azote et le phosphore) sont transférés au sein d’une chaîne trophique : des producteurs primaires aux consommateurs primaires et secondaires.
Cette approche de l’écologie a émergé au XIXe siècle avec Lotka, Liebig et Redfield et dérive des bilans de masses des réactions chimiques.
L’écologie stœchiométrique repose sur deux principes fondamentaux : la conservation de la matière et l’homéostasie.
Lors d’une réaction chimique, la conservation de la matière entraîne des quantités de matières constantes. En écologie stœchiométrique, l’homéostasie est définie comme la capacité d’un organisme à conserver une composition chimique constante malgré la différence de composition avec son environnement et la variation de la disponibilité de ses ressources[2].
L’écologie stœchiométrique est très utilisée en écologie des communautés pour étudier la réponse des consommateurs à la qualité nutritionnelle de leurs proies, et la compétition des consommateurs pour les ressources. Elle permet également d’étudier l’effet des consommateurs sur la composition nutritionnelle de leurs proies par le recyclage des nutriments. Ces études se basent sur l’analyse des ratios carbone/ nutriments, en tenant compte des nutriments les plus limitants dans la biosphère. Ces ratios sont notés C : Nutriments ou C : N : P au sein des chaînes trophiques[1].
Éléments essentiels
Les êtres vivants sont composés de différents éléments nécessaires à leur croissance. Les proportions varient entre et au sein des espèces en fonction des besoins métaboliques propres à chacun. Trois éléments sont majoritaires dans les organismes : l’azote (N), le phosphore (P) et le carbone (C) ; les deux premiers se retrouvent principalement dans l’ADN et le troisième se trouve dans toutes les molécules organiques (par exemple dans le glucose ou encore le saccharose).
Le carbone
Le carbone, noté C, est présent en grande quantité dans ce qu’on appelle des réservoirs. Les réservoirs sont principalement les océans, les sols ainsi que l’atmosphère où le carbone contribue comme gaz à effet de serre[3]. Le carbone est compris dans un cycle. Tout d’abord, des micro-organismes (comme des champignons, des bactéries), appelés décomposeurs, participent à la reminéralisation des excréments et de la matière organique morte (les feuilles mortes, les cadavres)[3]. Ces minéraux sont absorbés par les plantes par les racines. Les végétaux sont eux-mêmes consommés par les herbivores qui seront à leur tour prédatés par les carnivores. Les décomposeurs, les plantes, les herbivores, les carnivores composent ce qu’on appelle une chaîne trophique. À chacun de ses niveaux, de la matière organique morte est reformée lors de la mort des individus ce qui va ainsi fermer le cycle[3]. Il y a aussi un cycle court reliant les organismes à l’atmosphère : c’est la respiration (rejet de CO2 et apport d’O2) et la photosynthèse chez les organismes chlorophylliens (rejet d’O2 et apport de CO2)[3]. Il y a un échange de carbone entre l’atmosphère, le sol et l’océan[3]. À savoir que si la déposition de carbone dans le sol est supérieur à son taux de dégradation, une partie de ce dépôt va être enlevé au flux de matière pour pouvoir former de la tourbe. Celle-ci est composée de carbone inaccessible pendant des millions d’années[3].
L'azote
L’azote, noté N, dont les réservoirs sont la biomasse vivante, la matière organique morte et l’atmosphère, est un facteur limitant du sol[3]. En effet, il est le principal composant de l’atmosphère (à environ 78 %) sous sa forme N2. Cependant, il n’est pas directement utilisable pour une grande partie des organismes et nécessite d’être transformé en nitrate ou ammonium[3]. Le cycle de l’azote est ainsi dirigé par les micro-organismes[3]. Tout d’abord, des micro-organismes, comme les Rhizobium ou les Cyanobactéries, vont prélever l’azote se trouvant dans l’atmosphère et le transformer en ammoniaque (NH4+) dans les sols[3]. Ensuite la nitrification a lieu : l’ammoniaque se transforme en nitrite (NO2−) grâce à l’action d’enzymes assimilatrices. Le nitrite va à son tour être transformé en nitrate (NO3−). Le nitrate, se situant dans le sol, peut alors être assimilé par les plantes puis par les niveaux trophiques supérieurs via l’herbivorie et la prédation[3]. Comme le carbone, l’azote peut revenir dans le cycle à travers les excréments et la mort des organismes des différents niveaux trophiques. Les décomposeurs vont ensuite reminéraliser cette matière organique et reformer de l'ammoniaque. L’azote peut également être relargué dans l’atmosphère à l’aide de bactéries dénitrifiantes qui transforment le nitrate en N2[3]. Le cycle du N n’est pas un cycle fermé : des apports (comme la fertilisation) et des sorties (comme l’érosion et le lessivage) peuvent le modifier.
Le phosphore
Le phosphore, noté P, est présent dans l’environnement sous forme de phosphate. Ce dernier étant soluble, le réservoir principal du phosphore est l’hydrosphère[3]. De plus, le phosphate suit un cycle marin. Il va transiter d’un niveau trophique à un autre par la prédation, les fèces et la matière organique morte puis par leur recyclage via les décomposeurs et l’absorption par les plantes comme les autres cycles traités plus haut. Cependant, si la déposition de phosphate dans les fonds marins est plus grande que sa décomposition alors il va sédimenter jusqu’à arriver au niveau de la lithosphère. Ensuite, après des millions d’années de tectonique des plaques, le phosphate va se retrouver au niveau continental. Suite à l’érosion et au lessivage des sols, le phosphate va redevenir utilisable par la biosphère. Il va ensuite être rapidement réabsorbé (car il y a de la compétition pour cette ressource entre les organismes) par les racines et/ou les mycorhizes des plantes. Le phosphate peut également être transporté jusqu’à la surface par des courants marins ascendants. Ainsi, il devient directement utilisable par la biosphère. Lorsque le phosphate est disponible, le cycle terrestre va pouvoir suivre son cours de la même façon que tous les autres cycles (transition d’un niveau trophique à un autre et recyclage)[3]. Du phosphate va aussi retourner dans l’océan par les écoulements jusqu’aux rivières et les rivières jusqu’à l’océan. Le cycle peut aussi être modifié par des ajouts de phosphore via la fertilisation.
Principes fondamentaux
Variabilité stœchiométrique des substrats
La variation des processus des communautés microbiennes est corrélée aux quantités de carbone et de nutriments disponibles dans la litière et le sol. Les microorganismes du sol tirent leurs ressources des végétaux morts qui composent la litière, de la matière organique et des exsudats[4].
Il existe une variabilité spatio-temporelle de la stœchiométrie des ressources[2] :
- La litière des feuilles : le ratio C :N :P varie en fonction du biome, de l’écosystème, des espèces de plantes. Ce ratio est généralement plus élevé que celui du sol.
- Les racines : le ratio C :N :P baisse exponentiellement avec la latitude et varie avec le biome.
- Le bois : le ratio varie en fonction du type de plante. Il est plus variable chez les gymnospermes que celui des angiospermes ; il en est de même pour les bois tempérés et boréales.
- Les exsudats des racines : affecte la disponibilité en carbone organique, la disponibilité des ressources au niveau de la rhizosphère. Il y a un pic du taux d’exsudat lors de la saison de croissance de la plante.
- La matière organique du sol : varie avec le biome et l’écosystème. Plus le processus de décomposition est avancé moins il y a de variabilité stœchiométrique. Les ratios C : P, C : P et N : P diminuent avec la profondeur du sol.
Les sols organiques ont un ratio C : N plus grand que les sols minéraux.
Les microorganismes ont accès à des substrats à large gamme stœchiométrique beaucoup plus variable que leur composition[5]. Il y cependant une différence de ratio entre les biomes et les écosystèmes.
Mécanismes adaptatifs des communautés microbiennes
La plasticité stœchiométrique est un mécanisme important par lequel les communautés biologiques répondent aux changements de biodisponibilité des ressources. Les microorganismes ajustent leur croissance et l’allocation des ressources[4].
Il existe 4 mécanismes d’adaptation des communautés microbiennes à leur environnement et à un déséquilibre stœchiométrique[2] :
- Ajustement de la production d’enzymes extracellulaires par les microorganismes: afin de maximiser la mobilisation de substrat riche en éléments limitants.
- Après l’absorption du substrat les microorganismes minéralisent et excrètent les éléments en excès.
- Les bactéries diazotrophes et les champignons saprophytes peuvent déclencher un ajout de N et P dans le milieu.
- Changement du ratio C : N : P : pour mieux correspondre à celui de leur substrat. C’est un technique non homéostatique qui permet une réduction du déséquilibre stœchiométrique.
Il y a deux méthodes :
- Les éléments en excès sont stockés. Si le milieu est riche en P et C, le P est stocké sous forme de polyphosphates et le C en lipides et glycanes.
- Il y a modification de la structure de la communauté microbienne. Il y a changement de stratégie chez les microorganismes en fonction du ratio C :N :P. La stratégie K (durée de vie longue et reproduction rare et tardive) requiert un ratio plus fort que les stratégies r (fort taux de reproduction et forte mortalité).
En fonction des éléments disponibles dans le sol[5], on aura une communauté microbienne différente. Les bactéries sont plus abondantes quand le ratio N:P de la litière est faible, c’est le N qui est limitant. Alors que les champignons sont plus abondants lorsque le ratio N:P est fort, c’est le P qui est limitant. Cela s’explique par une plus grande vitesse de croissance et des besoins en P plus importants du métabolisme bactérien.
La répartition de gram positive et négative chez les bactéries dépend également de la stœchiométrie, quand N :P augmente le rapport de gram positif/gram négatif diminue.
Les communautés microbiennes optimisent l’utilisation des ressources mises à leur disposition.
Loi de Liebig
Cette loi de Von Liebig (1840), aussi appelée loi du minimum, a été prononcée par Carl Sprengel et adaptée par Liebig. Cette loi stipule que la croissance d’un organisme est limitée par l’élément essentiel limité dans le milieu, soit le premier qui vient à manquer.
Modélisation
Des chercheurs ont utilisé ces lois pour modéliser la consommation d’éléments organiques et inorganiques par les décomposeurs. Ils ont ainsi pu étudier les flux de carbone et les contraintes stœchiométriques[6].
Ils ont modélisé stœchiométriquement un réseau de bactérie et de producteur primaire. Ils ont alors cultivé dans un bioréacteur (chemostat) des décomposeurs en présence de deux types de ressources, inorganiques et organique, d’un élément essentiel quelconque, comme l’azote (l’inorganique est lié au carbone organique).
Où :
- Ei : élément sous forme inorganique
- Ev : élément sous forme organique
- Cv : carbone de la ressource organique
- Ed : élément contenu de la biomasse du décomposeurs
- Cd : carbone contenu dans la biomasse du décomposeur
- ɸ : flux
- L : taux de perte de l’écosystème
- c : efficacité de croissance brute
- β : ratio Cd : Ed
- α : ratio Cv : Ev
Le carbone est consommé uniquement en tant que carbone organique, il est consommé par le décomposeur avec un flux ɸv,C et perdu par respiration avec un flux (1-c) ɸv,C, c étant l’efficacité de croissance brute. Il est fourni par LCv0.
L’élément essentiel est consommé par le décomposeur avec les flux Φi et Φv et perdu par le renouvellement LEd, LEi (minéralisation) et LEv, il est à noter que le flux Φi peut aller dans les directions en fonction des propriétés stœchiométriques, c’est le flux d’immobilisation.L’élément est fourni par LEi° et LCv°.
Ces flux sont tous contrôlés par la stœchiométrie.
Ainsi, ils ont pu prédire les contraintes stœchiométriques, l’équilibre des ressources, la tendance des décomposeurs en fonction de leur ratio E:C (extinction, persistance, etc.) et étudier la compétition entre les décomposeurs.
Contraintes stœchiométriques :
| Ressource organique | Cv:Ev=α | La ressource organique
(ex: plante) contient C et E dans un rapport égal à α |
| Décomposeurs | Cd:Ed=β | Au cours de la croissance du décomposeur, le C et le E sont nécessaires dans un rapport égal à β |
Mais le décomposeur a aussi besoin du carbone organique pour produire l’énergie nécessaire à la respiration, un 3e rapport de demande est défini : δ=β/c
Ce rapport est majeur dans le modèle, car il permet de prédire la tendance des décomposeurs.
Contraintes homéostatiques : dCd/dt=β (dEd/dt).
La variation de la quantité de carbone est proportionnelle à la variation de l’élément avec un coefficient de proportionnalité correspondant au rapport β.
Après quelques manipulation algébriques, à l’aide de l’équation de δ et en utilisant la contrainte homéostatique, il apparaît que les flux ɸv,C et Φi sont proportionnels :
- Φi= (1/δ-1/α)ɸv,C
- Фi peut être négatif, en fonction des valeurs relatives des rapports C: E de la ressource organique et de la demande du décomposeur ( α et δ ), ainsi le flux a deux sens.
Le coefficient de proportionnalité étant la différence entre le rapport C:E de la source organique et celui de la demande du décomposeur, ainsi un des deux flux contrôle l’autre.
La croissance du décomposeur va dépendre du réactif limitant, on distingue deux cas :
- décomposeurs limités en E, dans ce cas le flux limitant est Φi (Φv étant directement lié à ɸv,C) ;
- décomposeurs limités en C, dans ce cas le flux limitant est ɸv,C.
Dans ce cas là, la loi de Liebig, s’applique pour les décomposeurs limités en E. En effet, en raison des contraintes stœchiométriques des ressources organiques et de la demande du décomposeur, la ressource inorganique est une ressource dont les décomposeurs ont besoin uniquement lorsque les ressources organiques sont déficientes en E. Dans ce modèle les ressources organiques et inorganiques sont essentielles, la ressource inorganique ne peut pas être remplacée par une autre ressource par les décomposeurs qui ont absolument besoin d’Ei pour satisfaire leur demande en E. Ainsi la loi de Liebig s’applique, et est définie comme suit : Фi= min{ iEiEd; (1/δ-1/α)vCvEd}
Où :
- i : Taux d'absorption de l'EI des décomposeurs limités en E ;
- v : Taux d'absorption des ressources organiques des décomposeurs limités en E.
En effet, l’élément peut être fourni par la ressource organique et inorganique, alors que le carbone peut être fourni uniquement par la ressource organique.
Il se trouve deux cas :
- iEi < (1/δ-1/α)vCv ; l’élément E est limitant ( Фi= iEdEi)
- iEi > (1/δ-1/α)vCv ; l’élément C est limitant ( Фi= [(α-δ)/δα]vCvEd)
Ainsi, on peut voir que la croissance est bien limitée par une seule ressource, celle qui est en plus faible quantité par rapport aux besoins des organismes.
Les principes stœchiométriques permettent d’établir précisément l’équilibre des ressources, ce qui permet de trouver des valeurs seuils R* :
- Ri*: Ei minimum exigé par le décomposeur pour sa croissance
- Ri*= ((α-δ)l)/αi qui est négativement proportionnel à la demande en E qui est le ratio C:E, effectivement plus la demande en élément augmente, plus la ressource inorganique doit compléter la ressource organique (Ei doit compléter Ev)
- Rv* : Ev minimum exigé par le décomposeur pour sa croissance
- R*= δ(1/v) qui est positivement proportionnel à la demande, plus la teneur en carbone du décomposeur est importante, plus le ratio de demande augmente.
De ces deux équations, peut se déduire un compromis (Trade-Off) entre les deux R* qui est : Ri*=(L/i)-(v/α)iRv*
Ceci correspond à la co-limitation des ressources organiques et inorganiques, ainsi la croissance des décomposeurs dépend des deux ressources. Certes, en cas de limitation de la source organique, la source inorganique peut être utilisée mais jusqu’à un certain seuil. Mais cette croissance dépend aussi de la demande des décomposeurs, qui selon ses valeurs, peut entraîner l’extinction ou la persistance des décomposeurs.
Le fait que les décomposeurs aient la capacité d’utiliser deux types de ressources, permet la coexistence des différents décomposeurs qui ont différents ratios de demande élémentaire, même si à long terme, ils devraient évoluer vers le ratio de demande qui résulte de la co-limitation de la croissance par la ressource inorganique et organique.
Enfin, les décomposeurs seront minéralisateurs uniquement dans des écosystèmes riches en éléments issus de ressources organiques.
Vue stœchiométrique sur les relations entre productivité et biodiversité[1]
La disponibilité en ressources affecte la biodiversité. Et cette diversité influence l’absorption de la biomasse du sol et la conversion en une nouvelle biomasse.
Plus un milieu est riche en ressource avec un ratio équilibré, plus la diversité de la communauté du milieu est importante, les ressources sont mieux exploitées par les différents organismes, ce qui augmente l’efficacité de la transformation des ressources disponibles en production de biomasse (la productivité augmente). À l’inverse lorsque la biodiversité diminue, la productivité diminue également.
La biodiversité modifie la productivité dans un milieu limité en ressources.
La disponibilité en ressources essentielles affecte la biomasse et la diversité des organismes autotrophes. L’efficacité de l’utilisation des ressources dirige la productivité. L’incorporation des éléments stœchiométriques diffère selon les organismes considérés. Le taux d’ingestion et la productivité secondaire aux niveaux trophiques supérieurs dépendent de la richesse, la biomasse et la stœchiométrie du niveau producteur primaire (production de matière organique à partir de matière minérale et d'un apport d'énergie).
- Relation proie/prédateur : On considère l’étude du ratio Carbone/nutriment(X) noté C:X. Ce ratio permet de quantifier les nutriments qui composent un organisme. Plus le ratio est élevé plus la quantité en nutriment est faible. Ce Ratio est affecté par la biodiversité au sein de la chaîne trophique.
Le taux de nutriments dans le sol à un effet de contrôle par les ressources dit bottom up :
Un exemple : lorsque la diversité du phytoplancton augmente, la disponibilité du CO2 diminue, ce qui entraîne la diminution du ratio C :N dans le phytoplancton. il contient alors plus d’azote et est d’une meilleure qualité nutritionnelle pour le zooplancton dont le taux de croissance augmente.
Au contraire, une plus faible diversité du phytoplancton entraîne l’augmentation de la disponibilité du CO2 , et ainsi une augmentation du ratio C :X, ce qui réduit la qualité de la nourriture du zooplancton
Par ailleurs, la diversité des consommateurs affecte le taux de consommation et ainsi la production de biomasse des consommateurs, c’est le contrôle top-down.
Transfert des éléments entre les différents niveaux trophiques
L’étude du transfert des éléments dans la chaîne trophique met en évidence la différence de répartition des éléments entre les différents niveaux. On étudie à la fois le flux de carbone et le flux des éléments.
Diagramme de flux de carbone et de flux d’éléments le long de la chaîne trophique :
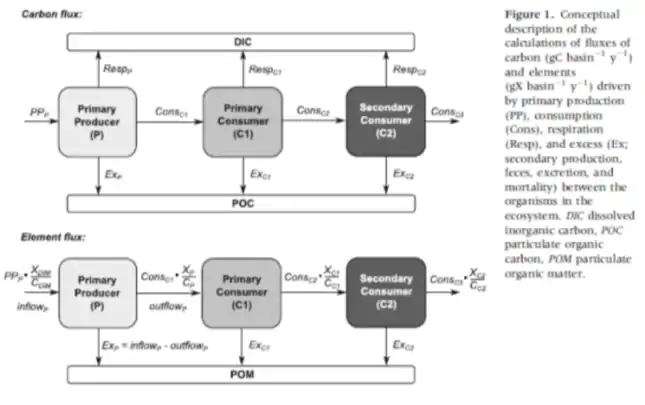
L’afflux de carbone se fait par la production primaire et la consommation, la voie de sortie du carbone se fait par la respiration, le pâturage/prédation, le fèces et l’excrétion de C.
L’étude d’un écosystème côtier a mis à jour certains points de l’écologie stœchiométrique. 5 niveaux trophiques et leurs interactions ont été étudiés. Ces niveaux ont été mis en place en regroupant des organismes avec des fonctions écologiques similaires.
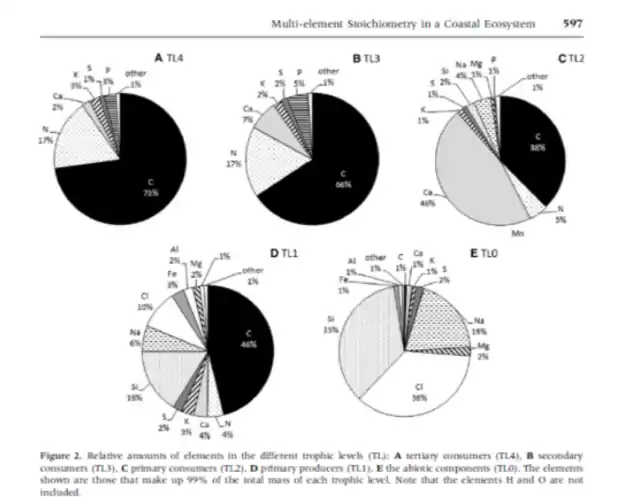
- TL0 : compartiment abiotique : composé majoritairement de Na et Cl (composants majeurs dissous dans l’eau) et Si (abondant dans les minéraux).
- TL1 : producteurs primaires
- TL 2 : consommateurs primaires : haute concentration en N et P ; et en Si, Mn, Fe, Al, Ti, V, and Cd.
- TL3 : consommateurs secondaires
- TL4 : consommateurs tertiaires
Les éléments sont répartis différemment le long de la chaîne trophique.
Dans la plupart des cas, les consommateurs ont des concentrations en éléments proportionnelle à celle de leur nourriture (niveau trophique inférieur). Dans les niveaux trophiques supérieurs, les consommateurs tertiaires et secondaires ont des compositions semblables. Entre les consommateurs secondaires et primaires on a de légères variations, légèrement plus élevée pour ce qui concerne les macro-éléments (N, P, S et K) et légèrement plus faible pour les autres éléments.
Pour la plupart des éléments, plus on monte dans la chaîne trophique, plus leur concentration diminue, sauf pour le N et le P qui sont plus abondants en haut de chaine.
Les différences de concentrations entre les différents niveaux trophiques peuvent s’expliquer par leurs fonctions écologiques respectives.
Lorsque l’on passe du compartiment abiotique aux compartiments biotiques, par photosynthèse ou par les organismes détritivores, on observe une plus grande différence de répartition des éléments. Dans le compartiment abiotique, la régulation se fait par des processus physiques comme la diffusion ou l’adsorption, alors que chez les organismes vivants il y a aussi la régulation active par les processus cellulaires. De même quand on passe des producteurs primaires aux consommateurs primaires on passe d’organismes autotrophes à des organismes hétérotrophes qui ont des besoins très différents en termes de survie, croissance …
Les différences de distribution des éléments observées entre les consommateurs primaires et les consommateurs secondaires sont dues au fait qu’ils n’ont pas la même fonction écologique, on passe d’animaux herbivores à des prédateurs.
Impacts anthropiques
L’activité humaine joue un rôle sur l’écologie stœchiométrique. L’Homme exerce une pression sur la biodiversité que ce soit par la fertilisation, la pollution ou encore le réchauffement climatique.
La fertilisation
Depuis le début du XXe siècle, les sols ont été fertilisés en azote pour augmenter la production agricole. Ceci a entraîné une modification de la stœchiométrie du sol et des plantes[2]. La fertilisation induit une diminution du ratio C : N. Cette diminution traduit un enrichissement du sol et donc des plantes en nutriments. Cependant, augmenter le taux de nutriments dans le sol augmente la probabilité qu’une autre ressource devienne limitante. Par exemple, la fertilisation des sols en azote augmentant la biomasse végétale, la ressource limitante devient alors la lumière. Les seules espèces pouvant ainsi survivre sont celles qui sont les plus compétitives pour la lumière. Les plantes les plus compétitive pour l’absorption de la ressource limitante seront celles qui survivent. Toutes les plantes qui ne sont pas compétitives ne vont pas survivre : c’est l’exclusion compétitive. La fertilisation entraîne donc une diminution de la biodiversité[2].
De plus, la fertilisation entraîne un déséquilibre des ressources ce qui affecte l’homéostasie des plantes[2]. L’apport d’azote augmente le ratio N : P des plantes et les contraint à augmenter leurs mécanismes de régulations afin de conserver une composition chimique constante. La fertilisation représente un coût énergétique important pour les plantes[7]. Toute l’énergie utilisée par les plantes pour réguler leur composition chimique sera alors de l’énergie en moins pour leur croissance et leur reproduction[7].
Cependant, si on a un équilibre dans les ressources, donc si parallèlement à l’ajout d’azote, des facteurs limitants sont ajoutées (de la lumière, du phosphore, de l’eau ou du potassium) , la coexistence entre les différentes espèces sera facilitée, et limitera ainsi la perte de la biodiversité due à la fertilisation[2].
La pollution et le réchauffement climatique
À partir de la seconde moitié du XIXe siècle, l’industrialisation a conduit à d’importants rejets de soufre. Puis, après la seconde guerre mondiale, des rejets azotés dus à une agriculture intensive et au développement des transports terrestres et aériens ont entraîné une forte pollution atmosphérique (ONF)[8]. Par la précipitation, ces dépôts atmosphériques soufrés et azotés ont acidifié et déséquilibré la stœchiométrie du sol[9]. Ces dépôts entraînent une diminution du ratio C :N et donc une amélioration de la qualité des sols. Cependant, cet enrichissement en azote augmente la croissance des plantes et augmente donc leurs besoins en d’autres nutriments. Si ces nutriments ne sont pas accessibles en quantités suffisantes, ils deviennent limitants pour les plantes. Par conséquent, comme pour la fertilisation, la pollution atmosphérique peut aussi aboutir à une exclusion compétitive d’espèces[9].
Les scientifiques ont aussi observé qu’un excès des besoins pour la croissance peut conduire à la déstabilisation des espèces jusqu’à aller à leur déclin[7].
Comme cette déposition d’azote est géographiquement très variable (localisée dans des zones industrielles), cette menace provoque un déséquilibre dans la distribution du ratio N:P dans les écosystèmes naturels[7].
De plus, des conditions climatiques optimales sont mises en parallèle avec les concentrations en azote et phosphore pour ce qui concerne la productivité de la biomasse[7]. Les espèces sont distribués dans leurs intervalles de température et de précipitation optimum, ainsi que là où leur croissance est favorisée donc dans des sols où l’azote est bien présent[7]. La productivité est maximale quand toutes les conditions de survie d’une plante sont validées. Le réchauffement climatique module tous ces paramètres dans un écosystème donné, ce changement est plus rapide que le déplacement des espèces végétales où celui-ci n’est possible que par la reproduction. Cette menace risque de provoquer un déclin important de populations.
Notes et références
- H. Hillebrand, J. M. Cowles, A. Lewandowska, D.B. Van de Waal, C. Plum, Think ratio ! A stoechiometric view on biodiversity-ecosystem functionning research, Basic and Applied Ecology no 15, 2014, p. 465-474
- (en) Mooshammer, « Stoichiometric imbalances between terrestrial decomposer communities and their resources: mechanisms and implications of microbial adaptations to their resources », Frontier Microbiology,
- Wolfgang Nentwig, Sven Bacher et Roland Brandl (trad. de l'allemand), Écologie : manuel de synthèse, Paris, Vuibert, , 368 p. (ISBN 978-2-7117-7183-7), p228 à p246
- (en) Nicolas Fanin, Nathalie Fromin, Sandra Barantal et Stephan Hättenschwiler, « Stoechiometric plasticity of microbial communities is similar between litter and soil in a tropical rainforest », Scientific reports, (lire en ligne, consulté le ).
- An experimental test of the hypothesis of non-homeostatic consumer stoichiometry in a plant litter–microbe system de Nicolas Fanin, Nathalie Fromin,Bruno Buatois et Stephan Hattenschwiler Ecology Letters (2013) 16: 764–772 doi: 10.1111/ele.12108
- Stoichiometric Constraints on Resource Use, Competitive Interactions, and Elemental Cycling in Microbial Decomposers, par Mehdi Cherif et Michel Loreau, The American Naturalist, Vol. 169, no 6, juin 2007, p. 709-724, The University of Chicago Press for The American Society of Naturalists Stable .
- (en) Jordi Sardans, « Foliar and soil concentrations and stoichiometry of nitrogen and phosphorous across European Pinus sylvestris forests : relationships with climate, N deposition and tree growth », Functional Ecology,
- « L’évolution des dépôts atmosphériques », sur Office National des forêts (consulté le )
- Marion Boutin. Impacts des dépôts atmosphériques azotés sur la biodiversité et le fonctionnement des pelouses subalpines pyrénéennes. Sciences de la Terre. Université Paul Sabatier - Toulouse III, 2015. Français. <NNT : 2015TOU30185>. <tel-01357681>