Fluorure d'hydrogène
Le fluorure d'hydrogène est un gaz incolore de formule chimique HF (un atome d'hydrogène (H) et un atome de fluor (F)). Il a une odeur piquante, il est très corrosif et très facilement liquéfiable.
| Fluorure d'hydrogène | |
  Molécule de fluorure d'hydrogène |
|
| Identification | |
|---|---|
| Nom UICPA | acide fluorhydrique Fluorure d'hydrogène |
| No CAS | |
| No ECHA | 100.028.759 |
| No CE | 231-634-8 |
| Apparence | gaz incolore ou liquide incolore, d'odeur acre[1]. |
| Propriétés chimiques | |
| Formule | HF [Isomères] |
| Masse molaire[2] | 20,006 34 ± 7,0E−5 g/mol H 5,04 %, F 94,96 %, |
| Moment dipolaire | 1,826 178 D [3] |
| Diamètre moléculaire | 0,290 nm [4] |
| Propriétés physiques | |
| T° fusion | −83 °C[1] |
| T° ébullition | 20 °C[1] |
| Solubilité | dans l'eau : très bonne[1] |
| Paramètre de solubilité δ | 33,0 J1/2·cm-3/2 (≤20 °C)[4] |
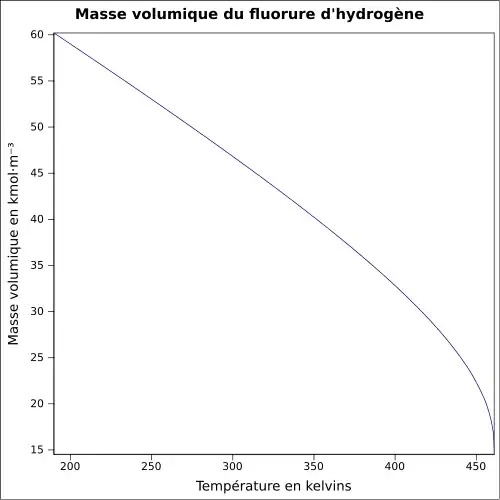
| Masse volumique | 1,0 g·cm-3[1]
|
| T° d'auto-inflammation | ininflammable |
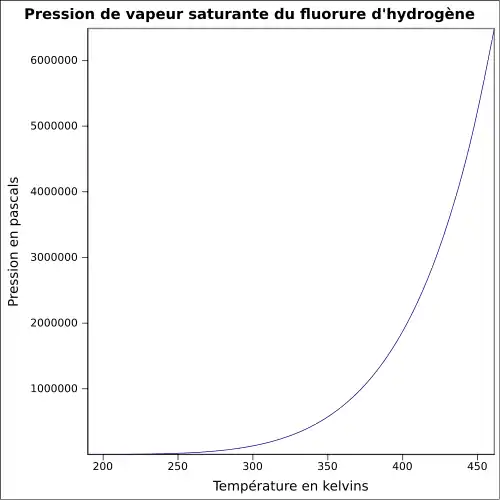
| Pression de vapeur saturante | à 25 °C : 122 kPa[1]
|
| Point critique | 64,8 bar, 187,85 °C[6] |
| Thermochimie | |
| S0gaz, 1 bar | 173,7 J·K-1·mol-1[7] |
| ΔfH0gaz | −271,1 kJ·mol-1[7] |
| ΔfH0liquide | −299,8 kJ·mol-1[7] |
| ΔfusH° | 4,6 kJ·mol-1[7] |
| ΔvapH° | 7,5 kJ·mol-1[7] |
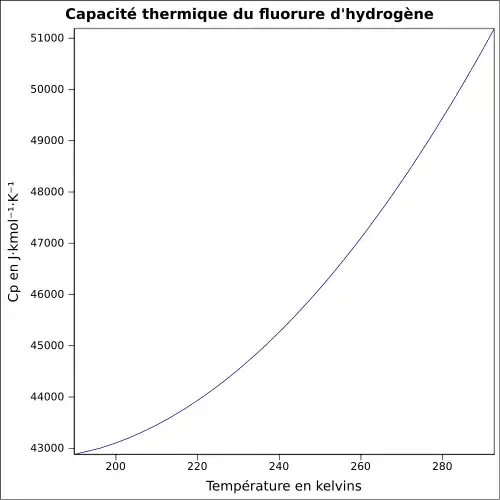
| Cp | 51,7 J·K-1·mol-1(liq)[7] 29,1 J·K-1·mol-1(gaz)[7]
|
| Propriétés électroniques | |
| 1re énergie d'ionisation | 16,044 ± 0,003 eV (gaz)[8] |
| Propriétés optiques | |
| Indice de réfraction | 1,340 [4] |
| Précautions | |
| SGH[9] | |
  Danger |
|
| SIMDUT[10] | |
  D1A, D2A, E, |
|
| NFPA 704 | |
| Transport | |
| Inhalation | Très toxique |
| Peau | Très corrosif, Très toxique |
| Yeux | Très corrosif |
| Ingestion | Très toxique |
| Écotoxicologie | |
| Seuil de l’odorat | bas : 0,04 ppm[12] |
| Unités du SI et CNTP, sauf indication contraire. | |
Théoriquement, le fluorure d'hydrogène devrait être un gaz difficilement liquéfiable or il est liquide à température ambiante. Cette anomalie est due au fait que le fluorure d'hydrogène se présente sous forme dimérisée (HF)2.
Chimie
La molécule de fluorure d’hydrogène HF est une molécule diatomique constituée d’un atome d’hydrogène H et d'un atome de fluor F, liés par une liaison simple. Le fluor étant nettement plus électronégatif que l’hydrogène, la liaison est très polarisée. En conséquence, la molécule porte un moment dipolaire important, avec une charge partielle négative δ- portée par l’atome de fluor et une charge partielle positive δ+ portée par l’atome d’hydrogène. Le fluorure d’hydrogène est donc une molécule polaire. Elle est très soluble dans l’eau et dans les solvants polaires. La dissolution du fluorure d'hydrogène dans l'eau est une réaction exothermique violente qui doit être réalisée avec précaution, car des projections peuvent avoir lieu.
En solution aqueuse le fluorure d'hydrogène forme l'acide fluorhydrique, acide faible en solution diluée mais fort en solution concentrée.
Préparation
Le fluorure d'hydrogène est synthétisé à partir de fluorure de calcium mélangé à de l'acide sulfurique.
- CaF2 + H2SO4 → CaSO4 + 2 HF
Les vapeurs obtenues par cette réaction sont un mélange de fluorure d'hydrogène, d'acide sulfurique et d'autres produits en faible quantité. Le fluorure d'hydrogène peut être isolé par distillation.
Il peut aussi être synthétisé par oxydation de l'eau par le difluor, avec comme intermédiaire l'acide hypofluoreux. Ce dernier, très instable, se décompose spontanément de façon explosive en fluorure d'hydrogène et dioxygène.
Utilisation
Le fluorure d'hydrogène est un précurseur important dans la synthèse de nombreux composés comme les produits pharmaceutiques et les polymères (Teflon). Le fluorure d'hydrogène est aussi très utilisé dans l'industrie pétrolière et dans la composition de superacides.
Le fluorure d'hydrogène est utilisé de façon très importante dans les procédés de microélectronique. Il est utilisé en particulier pour retirer les couches de dioxyde de silicium.
Le fluorure d'hydrogène intervient également dans l'industrie nucléaire, pour convertir le dioxyde d'uranium en tétrafluorure d'uranium[13], produit intermédiaire dans la production d'hexafluorure d'uranium. Ce dernier élément est un produit d'entrée de l'enrichissement de l'uranium.
Sécurité
Le fluorure d'hydrogène est un gaz ininflammable mais il réagit avec la plupart des métaux en présence d'humidité pour former du dihydrogène, un gaz très inflammable. La réaction avec les alcalis peut être très violente.
Le fluorure d'hydrogène est un gaz plus lourd que l'air et il peut s'accumuler sous le sol ou dans des endroits confinés. Il doit être stocké dans un endroit ventilé afin d'éviter des risques. Dans une atmosphère humide, il dégage des vapeurs blanches. L'absorption excessive d'ions fluorure peut provoquer une fluorose aiguë.
Il réagit aussi avec l'eau pour former de l'acide fluorhydrique, un acide très corrosif. Ce produit ne doit pas être rejeté dans l'environnement car il modifie le pH de l'eau.
Liens externes
Voir aussi
Références
- FLUORURE D'HYDROGENE, Fiches internationales de sécurité chimique .
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) David R. Lide, Handbook of chemistry and physics, CRC, , 89e éd., 2736 p. (ISBN 978-1420066791), p. 9-50.
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1).
- (en) Robert H. Perry et Donald W. Green, Perry's Chemical Engineers' Handbook, USA, McGraw-Hill, , 7e éd., 2400 p. (ISBN 0-07-049841-5), p. 2-50.
- « Properties of Various Gases », sur flexwareinc.com (consulté le ).
- Usuel de chimie générale et minérale - M.Bernard - F.Busnot - Dunod - 1984.
- (en) David R. Lide, Handbook of chemistry and physics, Boca Raton, CRC, , 89e éd., 2736 p. (ISBN 978-1-4200-6679-1), p. 10-205.
- Numéro index dans le tableau 3.1 de l'annexe VI du règlement CE no 1272/2008 (16 décembre 2008).
- « Fluorure d'hydrogène » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- Entrée du numéro CAS « 7664-39-3 » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 27 novembre 2008 (JavaScript nécessaire).
- « Hydrogen fluoride », sur hazmap.nlm.nih.gov (consulté le ).
- Areva - Conversion de l'uranium naturel.