Disilane
Le disilane est un composé chimique de formule Si2H6. Ce silane est l'analogue structurel de l'éthane C2H6 mais est bien plus réactif que celui-ci en raison de la faiblesse des liaisons Si–Si par rapport aux liaisons C–C. Il se présente comme un gaz incolore pyrophorique à l'odeur de moisissure. Extrêmement inflammable, il est de manipulation dangereuse car susceptible de former des mélanges explosifs à l'air libre. Sa combustion dans l'oxygène produit du dioxyde de silicium SiO2 et de l'eau H2O. Il s'hydrolyse dans l'eau. Il explose au contact d'halocarbures, d'oxygène, de bases et d'oxydants. Il se décompose au-delà de 300 °C en donnant du silicium et de l'hydrogène H2.
| Disilane | |
  |
|
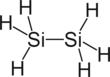
| Structure du disilane | |
| Identification | |
|---|---|
| Synonymes |
silylsilane |
| No CAS | |
| No ECHA | 100.014.970 |
| No CE | 216-466-5 |
| PubChem | 74123 |
| ChEBI | 30597 |
| SMILES | |
| InChI | |
| Apparence | gaz incolore à l'odeur de moisissure[1] |
| Propriétés chimiques | |
| Formule | Si2H6 |
| Masse molaire[2] | 62,218 6 ± 0,001 g/mol H 9,72 %, Si 90,28 %, |
| Propriétés physiques | |
| T° fusion | −132,5 °C[1] |
| T° ébullition | −14,5 °C[1] |
| Masse volumique | 0,686 g/cm3[1] à −25 °C 2,66 kg/m3[1] à 15 °C |
| Pression de vapeur saturante | 3,3 bar à 21 °C[1] |
| Point critique | 150,9 °C et 35,8 bar[1] |
| Point triple | −132,5 °C[1] |
| Précautions | |
| SGH[1] | |
  Danger |
|
| Transport[1] | |
| Unités du SI et CNTP, sauf indication contraire. | |
Le disilane peut être produit par hydrolyse acide du siliciure de magnésium Mg2Si ou par action de décharges électrostatiques sur le silane puis distillation fractionnée du mélange de silanes obtenu[3]. La récupération directe par réduction de l'hexachlorodisilane Si2Cl6 avec de l'aluminohydrure de lithium LiAlH4[4] donne du disilane avec un faible rendement[5] :
Le disilane et le silane se décomposent thermiquement autour de 640 °C en laissant un dépôt de silicium amorphe. Ce procédé de dépôt chimique en phase vapeur est utilisé pour la production d'équipements photovoltaïques[3]. Il est particulièrement employé dans la production de wafers de silicium.
Les diorganosilanes sont produits par réduction de chlorures de silyle, par exemple :
- 2 (CH3)3SiCl + 2 Na ⟶ (CH3)3Si–Si(CH3)3 + 2 NaCl.
Le disilane gazeux peut être utilisé pour contrôler la pression de vapeur de silicium pendant le processus de croissance de graphène par décomposition thermique du carbure de silicium, car la pression de vapeur de silicium influence la qualité du graphène produit[6].
Notes et références
- Entrée « Disilane » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 11 janvier 2021 (JavaScript nécessaire)
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Barry Arkles, « Silicon Compounds, Silanes », Kirk‐Othmer Encyclopedia of Chemical Technology, (DOI 10.1002/0471238961.1909120101181112.a01, lire en ligne)
- (de) Georg Brauer, en collaboration avec Marianne Baudler, Handbuch der Präparativen Anorganischen Chemie, 3e éd. révisée, vol. 1, Ferdinand Enke, Stuttgart 1975, p. 657. (ISBN 3-432-02328-6)
- (en) P. W. Schenk « Silanes », Handbook of Preparative Inorganic Chemistry, 2e éd., vol. 1, G. Brauer, Academic Press, 1963, p. 680.
- (en) Neeraj Mishra, John Boeckl, Nunzio Motta et Francesca Iacopi, « Graphene growth on silicon carbide: A review », Physica Status Solidi a, vol. 213, no 9, , p. 2277-2289 (DOI 10.1002/pssa.201600091, lire en ligne)
