Siliciure de magnésium
Le siliciure de magnésium, Mg2Si, est un composé inorganique composé de magnésium et de silicium. Sous forme de poudre, le siliciure de magnésium a une couleur bleu foncé ou légèrement violette[6].
| Siliciure de magnésium | |||
 __ Mg2+ __ Si4−  |
|||
| Identification | |||
|---|---|---|---|
| No CAS | |||
| No ECHA | 100.041.125 | ||
| No CE | 245-254-5 | ||
| PubChem | 89858 | ||
| SMILES | |||
| InChI | |||
| Apparence | solide cristallin incolore[1] | ||
| Propriétés chimiques | |||
| Formule | Mg2Si [Isomères] |
||
| Masse molaire[2] | 76,695 5 ± 0,001 5 g/mol Mg 63,38 %, Si 36,62 %, |
||
| Propriétés physiques | |||
| T° fusion | 1 085 °C[3] | ||
| Masse volumique | 1,94 g·cm-3[4] | ||
| Précautions | |||
| SGH[1] - [5] | |||
 |
|||
| Transport[5] | |||
|
|||
| Unités du SI et CNTP, sauf indication contraire. | |||
Synthèse
Le siliciure de magnésium peut être formé de la réaction directe des deux éléments en proportion[7] :
Le siliciure de magnésium peut être produit en chauffant du dioxyde de silicium, SiO2, trouvé dans le sable, avec du magnésium en excès. Le processus forme d'abord du silicium métallique et de l'oxyde de magnésium :
Si le magnésium est présent en excès, du siliciure de magnésium Mg2Si est formé :
Ces réactions sont exothermiques[8].
Usage
Le siliciure de magnésium est utilisé pour créer des alliages d'aluminium de la série 6000, contenant jusqu'à environ 1,5% de Mg2Si. Un alliage de ce groupe peut être durci par traitement thermique pour former des zones de Guinier-Preston et un précipité très fin, les deux résultant en une augmentation de la résistance mécanique de l'alliage[9].
C'est aussi un réactif utilisé comme agent réducteur fort[1].
Réactions
On peut considérer que le siliciure de magnésium est composé d'ions Si4−. De ce fait, il réagit avec les acides et réagit même violemment avec l'eau[5]. Ainsi, lorsque du siliciure de magnésium est traité avec de l'acide chlorhydrique, du silane SiH4 et du chlorure de magnésium sont produits :
L'acide sulfurique peut également être utilisé ainsi. Ces réactions de protonolyse sont typiques des siliciures des groupes 1 et 2.
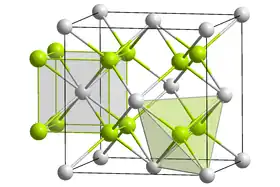
Structure cristalline
Le siliciure de magnésium cristallise dans une structure d'antifluorite[10]. Dans la structure cubique à faces centrées, les atomes de silicium occupent les coins et le centre des faces alors que les atomes de magnésium occupent les huit sites tétraédriques à l'intérieur de la cellule unitaire. Le nombre de coordination des atomes de silicium et de magnésium sont respectivement huit et quatre[11].
Références
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Magnesium silicide » (voir la liste des auteurs).
- PubChem CID 89858
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Nikolaus Reinfried, Modifizierung der Werkstoffe auf Basis von Magnesiumsilicid mit Hilfe der Spark-Plasma-Synthese, 2006, Modèle:URN
- Magnesium Silicide sur americanelements.com.
- Fiche Sigma-Aldrich du composé Magnesium silicide ≥99%, consultée le 29/12/2016. + [PDF] Fiche MSDS
- Georg Brauer, Handbuch der präparativen anorganischen Chemie, 2e ed., p. 916. (ISBN 3-432-87813-3).
- Kevin Hutchings, Classic Chemistry Experiments, Royal Society of Chemistry, 2000, p. 181. (ISBN 0-85404-919-3), page sur Googlebook.
- P. Ehrlich "Métaux alcalino -" dans le Manuel de Préparative Chimie Inorganique, 2e Ed. Édité par G. Brauer, Academic Press, 1963, NY.
- ASM Handbook, 10e Ed., Vol. 1, les Propriétés et la Sélection: Alliages Non-ferreux et les Matériaux, 1990, ASM International, les Matériaux Park, dans l'Ohio.
- antifluorite).
- A. Kato, T. Yagi, N. Fukusako, First-principles studies of intrinsic point defects in magnesium silicide, J. Phys. Condens. Matter, 2009, vol.21(20), p. 205801. DOI 10.1088/0953-8984/21/20/205801,



