Pyruvate phosphate dikinase
La pyruvate, phosphate dikinase est une phosphotransférase qui catalyse la réaction :
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Cette enzyme a été étudiée essentiellement chez les plantes, ainsi que chez certaines bactéries[2].
Le phosphoénolpyruvate formé est un substrat de la phosphoénolpyruvate carboxylase qui permet la fixation du dioxyde de carbone CO2 sous forme d'ion bicarbonate HCO3− dans le cadre de la fixation du carbone en C4.
Structure et mécanisme
La forme active de la pyruvate phosphate dikinase est un homotétramère d'environ 95 kDa[3].
L'enzyme possède deux centres réactionnels distants d'environ 4,5 nm auxquels se lient des substrats différents[4]. Le site de liaison au nucléotide (ATP) se situe du côté N-terminal, qui possède 240 résidus d'acides aminés et une configuration caractéristique des sites de liaison à l'ATP. Le site de liaison au pyruvate et au phosphoénolpyruvate se situe du côté C-terminal, constitué de 340 résidus d'acides aminés, et un repliement en hélices α et tonneau β. Il possède également un domaine central contenant le résidu d'His-455, qui joue un rôle central dans la catalyse de la réaction enzymatique. C'est en effet ce résidu qui joue le rôle d'accepteur et de donneur de groupe phosphoryle[1]. La structure de l'enzyme suggère que le bras de l'His-455 pivote pour transporter le groupe phosphoryle d'une centre réactionnel à l'autre[5]. Le domaine central pivote d'au moins 92° et se translate de 50 pm au cours de ce mouvement[6].
Des études ont montré que les mécanismes de liaison de la pyruvate phosphate dikinase sont semblables à ceux de la D-alanine-D-alanine ligase (en) et de la pyruvate kinase[5]. La pyruvate phosphate dikinase est notamment très semblable à la pyruvate kinase, qui catalyse également la conversion du phosphoénolpyruvate en pyruvate mais sans passer par un intermédiaire enzyme–phosphate[1]. Bien que ces deux enzymes aient des séquences différentes, les résidus clés de la catalyse sont préservés dans les deux enzymes. Des expériences par mutation ponctuelle ont montré que les résidus d'Arg-561, d'Arg-617, de Glu-745, d'Asn-768 et de Cys-831 font partie de ces résidus conservés[1].
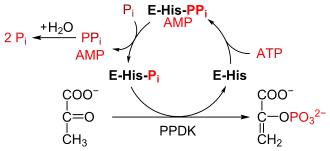
Le mécanisme réactionnel fait intervenir trois réactions réversibles[7] :
- l'enzyme se lie à l'ATP et l'hydrolyse pour libérer l'AMP en donnant un complexe enzyme-pyrophosphate ;
- le complexe enzyme-pyrophosphate réagit avec le phosphate inorganique pour former un complexe enzyme-phosphate en libérant le pyrophosphate inorganique ;
- le complexe enzyme-phosphate réagit avec le pyruvate pour former le phosphoénolpyruvate en régénérant l'enzyme.
La réaction est semblable à celle catalysée par la pyruvate kinase, qui catalyse cependant une réaction irréversible dans l'autre sens[1].
Fonction biologique et évolution
La pyruvate phosphate dikinase intervient dans la voie métabolique de fixation du carbone en C4 en améliorant l'efficacité de la fixation du dioxyde de carbone CO2. Ceci peut être réalisé au moyen d'un ensemble de réactions transportant le CO2 des cellules du mésophylle (situées à l'extérieur des feuilles) aux cellules des gaines périvasculaires, situées à l'intérieur. Cette enzyme convertit le pyruvate en phosphoénolpyruvate, qui réagit avec le CO2 pour produire de l'oxaloacétate. Lorsque le CO2 dans les cellules des gaines périvasculaires, le pyruvate est régénéré et le cycle recommence.
Bien que la réaction catalysée par la pyruvate phosphate dikinase soit réversible, c'est la formation de phosphoénolpyruvate qui est privilégiée dans les conditions biologiques. Ceci est dû au pH basique dans le stroma des chloroplastes, où se déroule la réaction, ainsi qu'à la forte présence d'adénylate kinase et de pyrophosphatase (en). Dans la mesure où ces deux enzymes catalysent des réactions exergoniques impliquant respectivement l'AMP et le pyrophosphate, elles orientent les réactions catalysées par la pyruvate phosphate dikinase vers le PEP. Cependant, la pyruvate phosphate dikinase consomme de l'ATP, ce qui fait que les plantes en C4 sont défavorisées dans les environnements faiblement éclairés, car alors la photosynthèse ne produit pas assez d'ATP.
La pyruvate phosphate dikinase est une enzyme très abondante dans les feuilles des plantes en C4, où elles peuvent représenter jusqu'à 10 % du total des protéines[8]. Des expériences par hybridation ont montré que les différences génétiques entre les différences génétiques entre enzymes de différentes origines sont corrélées au degré de prépondérance de la fixation du carbone en C4 par rapport à la fixation du carbone en C3[9].
La pyruvate phosphate dikinase est présente en petites quantités dans les plantes en C3, et l'histoire de l'évolution suggère qu'elle a pu jouer un rôle dans la glycolyse avant de finalement évoluer en se spécialisant dans la fixation du carbone en C4[8].
Régulation

La pyruvate phosphate dikinase est régulée par la protéine de régulation de la pyruvate phosphate dikinase (en)[3] (PDRP). Sous forte illumination, cette protéine déphosphoryle le résidu de Thr-456 de la pyruvate phosphate dikinase, ce qui a pour effet d'activer l'enzyme[8] ; elle l'inactive par phosphorylation sur ce même résidu à partir de pyrophosphate inorganique. La PDRP est une protéine de régulation particulière en ce qu'elle catalyse à la fois l'activation et l'inactivation de la PPDK à travers deux mécanismes différents[8].
Notes et références
- (en) Osnat Herzberg, Celia C. H. Chen, Sijiu Liu, Aleksandra Tempczyk, Andrew Howard, Min Wei, Dongmei Ye et Debra Dunaway-Mariano, « Pyruvate Site of Pyruvate Phosphate Dikinase: Crystal Structure of the Enzyme−Phosphonopyruvate Complex, and Mutant Analysis », Biochemistry, vol. 41, no 3, , p. 780-787 (PMID 11790099, DOI 10.1021/bi011799+, lire en ligne)
- (en) David J. Pocalyko, Lawrence J. Carroll, Brian M. Martin, Patricia C. Babbitt et Debra Dunaway-Mariano, « Analysis of sequence homologies in plant and bacterial pyruvate phosphate dikinase, enzyme I of the bacterial phospoenolpyruvate:sugar phosphotransferase system and other PEP-utilizing enzymes. Identification of potential catalytic and regulatory motifs », Biochemistry, vol. 29, no 48, , p. 10757-10765 (PMID 2176881, DOI 10.1021/bi00500a006, lire en ligne)
- (en) Chris J. Chastain, Christopher J. Failing, Lumu Manandhar, Margaret A. Zimmerman, Mitchell M. Lakner et Tony H. T. Nguyen, « Functional evolution of C4 pyruvate, orthophosphate dikinase », Journal of Experimental Botany, vol. 62, no 9, , p. 3083-3091 (PMID 21414960, DOI 10.1093/jxb/err058, lire en ligne)
- (en) O. Herzberg, C. C. Chen, G. Kapadia, M. McGuire, L. J. Carroll, S. J. Noh et D. Dunaway-Mariano, « Swiveling-domain mechanism for enzymatic phosphotransfer between remote reaction sites », Proceedings of the National Academy of Sciences of the United States of America, vol. 93, no 7, , p. 2652-2657 (PMID 8610096, PMCID 39685, DOI 10.1073/pnas.93.7.2652, lire en ligne)
- (en) Kap Lim, Randy J. Read, Celia C. H. Chen, Aleksandra Tempczyk, Min Wei, Dongmei Ye, Chun Wu, Debra Dunaway-Mariano et Osnat Herzberg, « Swiveling Domain Mechanism in Pyruvate Phosphate Dikinase », Biochemistry, vol. 46, no 51, , p. 14845-14853 (PMID 18052212, DOI 10.1021/bi701848w, lire en ligne)
- (en) Tsugumi Nakanishi, Toru Nakatsu, Makoto Matsuoka, Kanzo Sakata et Hiroaki Kato, « Crystal Structures of Pyruvate Phosphate Dikinase from Maize Revealed an Alternative Conformation in the Swiveling-Domain Motion », Biochemistry, vol. 44, no 4, , p. 1136-1144 (PMID 15667207, DOI 10.1021/bi0484522, lire en ligne)
- (en) Herbert J. Evans et Harland G. Wood, « The mechanism of the pyruvate, phosphate dikinase reaction », Proceedings of the National Academy of Sciences of the United States of America, vol. 61, no 4, , p. 1448-1453 (PMID 4303480, PMCID 225276, DOI 10.1073/pnas.61.4.1448, JSTOR 58792, Bibcode 1968PNAS...61.1448E, lire en ligne)
- (en) Chris J. Chastain, Jason P. Fries, Julie A. Vogel, Christa L. Randklev, Adam P. Vossen, Sharon K. Dittmer, Erin E. Watkins, Lucas J. Fiedler, Sarah A. Wacker, Katherine C. Meinhover, Gautam Sarath et Raymond Chollet, « Pyruvate,Orthophosphate Dikinase in Leaves and Chloroplasts of C3 Plants Undergoes Light-/Dark-Induced Reversible Phosphorylation », Plant Physiology, vol. 128, no 4, , p. 1368-1378 (PMID 11950985, PMCID 154264, DOI 10.1104/pp.010806, lire en ligne)
- (en) Elke Rosche, Monika Streubel et Peter Westhoff, « Primary structure of the photosynthetic pyruvate orthophosphate dikinase of the C3 plant Flaveria pringlei and expression analysis of pyruvate orthophosphate dikinase sequences in C3, C3–C4 and C4 Flaveria species », Plant Molecular Biology, vol. 26, no 2, , p. 763-769 (PMID 7948930, DOI 10.1007/BF00013761, lire en ligne)
