Propionitrile
Le propionitrile est un composé chimique de formule CH3CH2CN. C'est le plus simple des nitriles aliphatiques. Il se présente sous la forme d'un liquide incolore soluble dans l'eau. Il est utilisé comme solvant et comme précurseur d'autres composés organiques[4].
| Propionitrile | |
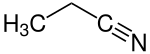 Structure du propionitrile |
|
| Identification | |
|---|---|
| Nom UICPA | propanenitrile |
| Synonymes |
cyanure d'éthyle |
| No CAS | |
| No ECHA | 100.003.151 |
| No CE | 203-464-4 |
| PubChem | 7854 |
| ChEBI | 26307 |
| SMILES | |
| InChI | |
| Apparence | liquide incolore à l'odeur d'éther |
| Propriétés chimiques | |
| Formule | C3H5N [Isomères] |
| Masse molaire[1] | 55,078 5 ± 0,003 g/mol C 65,42 %, H 9,15 %, N 25,43 %, |
| Moment dipolaire | µa=3,85 D, µb=1,23 D |
| Propriétés physiques | |
| T° fusion | −103 °C[2] |
| T° ébullition | 97 °C[2] |
| Solubilité | 103 g·l-1[2] à 20 °C |
| Paramètre de solubilité δ | 21,8 J1/2·cm-3/2 (25 °C)[3] |
| Masse volumique | 0,78 g·cm-3[2] à 20 °C |
| T° d'auto-inflammation | 510 °C[2] |
| Point d’éclair | 2 °C[2] |
| Pression de vapeur saturante | 4,88 kPa[2] à 20 °C |
| Précautions | |
| SGH[2] | |
  Danger |
|
| Transport[2] | |
| Écotoxicologie | |
| DL50 | 39 mg·kg-1 (souris, oral)[2] |
| Unités du SI et CNTP, sauf indication contraire. | |
Production
Le propionitrile est produit industriellement essentiellement par hydrogénation de l'acrylonitrile CH2=CH–CN ainsi que par ammoxydation du propanol C2H5CH2OH (ou du propanal C2H5CHO) :
- CH3CH2CH2OH + O2 + NH3 → CH3CH2CN + 3 H2O.
Le propionitrile est également un sous-produit de l'électrodimérisation de l'acrylonitrile en adiponitrile NC(CH2)4CN.
En laboratoire, il peut être préparé par déshydratation du propanamide CH3CH2CONH2, par réduction catalytique de l'acrylonitrile, ou par distillation de l'hydrogénosulfate d'éthyle CH3CH2OSO3H et du cyanure de potassium KCN.
Le propionitrile est un solvant semblable à l'acétonitrile mais avec une température d'ébullition un peu plus élevée. Il donne de la propylamine CH3CH2CH2NH2 par hydrogénation.
Détection astrophysique
Le propionitrile fait partie des molécules détectées dans le milieu interstellaire[5] - [6] - [7] - [8] - [9] par spectroscopie rotationnelle. Ses trois 13C-isotopologues ont également été observés dans les nuages moléculaires tels Orion IRc2[10].
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Entrée « Propionitrile » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 18 novembre 2012 (JavaScript nécessaire)
- (en) Yitzhak Marcus, The Properties of Solvents, vol. 4, England, John Wiley & Sons Ltd, , 239 p. (ISBN 0-471-98369-1)
- (en) Peter Pollak, Gérard Romeder, Ferdinand Hagedorn et Heinz-Peter Gelbke, « Nitriles », Ullmann's Encyclopedia of Industrial Chemistry, (lire en ligne) DOI 10.1002/14356007.a17_363
- (en) Lucy M. Ziurys, « The chemistry in circumstellar envelopes of evolved stars: Following the origin of the elements to the origin of life », Proceedings of the National Academy of Sciences of the United States of America, vol. 103, no 33, , p. 12274-12279 (lire en ligne) DOI 10.1073/pnas.0602277103
- (en) L. E. B. Johansson, C. Andersson, J. Ellder, P. Friberg, A. Hjalmarson, B. Hoglund, W. M. Irvine, H. Olofsson et G. Rydbeck, « Spectral scan of Orion A and IRC+10216 from 72 to 91 GHz », Astronomy and Astrophysics, vol. 130, no 2, , p. 227-256 (lire en ligne)
- (en) Anthony J. Remijan, J. M. Hollis, F. J. Lovas, D. F. Plusquellic et P. R. Jewell, « Interstellar Isomers: The Importance of Bonding Energy Differences », The Astrophysical Journal, vol. 632, no 1, , p. 333-339 (lire en ligne) DOI 10.1086/432908
- (en) David Fossé, José Cernicharo, Maryvonne Gerin et Pierre Cox, « Molecular Carbon Chains and Rings in TMC-1 », The Astrophysical Journal, vol. 552, no 1, , p. 168-174 (lire en ligne) DOI 10.1086/320471
- « Molecules in the Interstellar Medium or Circumstellar Shells (en date du 11/2012) »
- (en) K. Demyk et al., « Isotopic ethyl cyanide 13CH3CH2CN, CH313CH2CN, and CH3CH213CN: laboratory rotational spectrum and detection in Orion », A&A, vol. 466, no 1, , p. 255

