Phtalazine
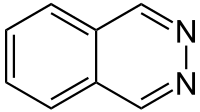
La phtalazine, aussi appelée benzo-orthodiazine ou benzopyridazine, est un composé organique hétérocyclique de formule brute C8H6N2. C'est avec notamment la quinoxaline, la cinnoline et la quinazoline, un diazanaphtalène, c'est-à-dire un composé bicyclique de squelette identique au naphtalène (deux benzènes accolés), mais dans lequel deux atomes de carbone sont remplacés par deux atomes d'azote. Dans le cas de la phtalazine, ce sont les atomes 2 et 3 qui ont été remplacés par des atomes d'azote, ce qui fait que sa structure est celle d'un cycle de pyridazine fusionné avec un cycle de benzène.
| Phtalazine | |
| |
| Identification | |
|---|---|
| Nom UICPA | phtalazine |
| Synonymes |
benzo-orthodiazine, 2,3-benzodiazine, benzo[d]pyridazine |
| No CAS | |
| No ECHA | 100.005.422 |
| No CE | 205-963-2 |
| PubChem | 9207 |
| ChEBI | 36597 |
| SMILES | |
| InChI | |
| Apparence | solide cristallin[1] |
| Propriétés chimiques | |
| Formule | C8H6N2 [Isomères] |
| Masse molaire[2] | 130,146 6 ± 0,007 2 g/mol C 73,83 %, H 4,65 %, N 21,52 %, |
| pKa | 3,39[3] 3,5 à 20 °C[1] |
| Propriétés physiques | |
| T° fusion | 89 à 92 °C[4] |
| T° ébullition | 315 °C[5] 189 °C à 29 mmHg[4] - [1] 175 °C à 17 mmHg[1] Subl. 125 °C à 0,3 mmHg[1] |
| Précautions | |
| SGH[4] | |
 |
|
| Unités du SI et CNTP, sauf indication contraire. | |
Synthèse
Condensation
Historiquement, la phtalazine a été obtenue la première fois par Gabriel et Pinkus par condensation de l'α,α,α'α'-tétrachloro-o-xylène en solution aqueuse d'hydrazine, en chauffant à 150 °C sous pression pendant deux heures[6]. Cette réaction a été depuis optimisée en chauffant le tétrachloro-o-xylène dans une solution de sulfate d'hydrazine dans l'acide sulfurique à 90 %[7]. On remplace parfois le tétrachloro-o-xylène par le tétrabromo-o-xylène.
Il est également possible de préparer la phtalazine par condensation du o-phtalaldéhyde en solution aqueuse de sulfate d'hydrazine[8] - [9].
Synthèse à partir de dérivés de phtalazine
D'autres méthodes incluent des réactions d'oxydoréduction de dérivés de la phtalazine :
- oxydation de la 1-hydrazinophtalazine par l'oxygène dans une solution d'éthanolate[10] ou en la chauffant avec le sulfate de cuivre à pH 8[11] ; oxydation du 1-N'-(p-toluènesulfonyl)-hydrazinophtalazine en la chauffant en milieu basique[12] ;
- réduction catalytique de la 1-chlorphtalazine avec du palladium sur charbon[13], ou réduction organique de la 1,4-dichlorphtalazine par le phosphore et de l'acide iodhydrique[14].
Propriétés
Elle possède des propriétés basiques et forme des iodures de type pyridinium par réaction d'addition avec les iodures d'alkyles.
Réaction
Oxydée par du permanganate de potassium alcalin, la phtalazine donne de l'acide pyridazine dicarboxylique. Le zinc et l'acide chlorhydrique la décomposent avec formation d'orthoxylylène diamine.
Traitée avec de l'oxychlorure de phosphore, elle donne une chlorphtalazine, qui réagit avec le zinc et l'acide chlorhydrique pour donner de l'isoindole (C8H7N), ou avec l'étain et l'acide chlorhydrique pour donner de l'isoindolinone (phtalimidine, numéro CAS ), le deuxième atome d'azote étant éliminé sous forme d'ammoniac.
Notes et références
- (en) Raymond N. Castle, The Chemistry of Heterocyclic Compounds, Condensed Pyridazines Including..., John Wiley & Sons, , 1124 p. (ISBN 978-0-470-18848-4 et 0-470-18848-0, lire en ligne), p. 234
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- Brown, H.C. et al., in Baude, E.A. et Nachod, F.C., Determination of Organic Structures by Physical Methods, Academic Press, New York, 1955.
- Fiche Sigma-Aldrich du composé Phthalazine 98%, consultée le 13 juin 2014.
- (en) « Phtalazine », sur ChemIDplus (consulté le 12 juin 2014)
- S Gabriel, S. Pinkus, Ber., 26, 2210 (1893).
- Chem. Abstr., 66, 95069 (1967)
- A. Mustafa, A.H. Harhash et A.A.S. Saleh, J. Am. Cham. Soc., 82, 2735 (1960)
- R.F. Smith et E.D. Otremba, J. Org. Chem., 22, 879 (1962)
- A. Albert et G. Catterall, J. Chem. Soc., 1967, 1533
- W.L.F. Armarego., J. Appl. Chem., 11, 70 (1961)
- C.M Atkinson et C.J. Sharpe, J. Chem. Soc., 1959, 3040
- C. Furlani, S. Bertola et G. Morpurgo, Ann. Chim., 50, 858 (1960)
- T. Nakajima et A. Pullman, J. Chim. Phys., 55, 793 (1958)
- (en) Cet article est partiellement ou en totalité issu de l’article de Wikipédia en anglais intitulé « Phthalazine » (voir la liste des auteurs).