Oxyde de triméthylamine
L'oxyde de triméthylamine est un composé organique de formule brute N(CH3)3O. Il est une des formes de l'excrétion azotée chez certains animaux.
| Oxyde de triméthylamine | |
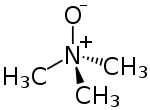
| |
| Structure de l'oxyde de triméthylamine | |
| Identification | |
|---|---|
| Nom UICPA | Oxyde de triméthylamine |
| Synonymes |
TMAO |
| No CAS | |
| No ECHA | 100.013.341 |
| No CE | 214-675-6 |
| PubChem | 1145 |
| FEMA | 4245 |
| InChI | |
| Apparence | solide incolore à jaune, inodore |
| Propriétés chimiques | |
| Formule | C3H9NO [Isomères] |
| Masse molaire[1] | 75,109 7 ± 0,003 5 g/mol C 47,97 %, H 12,08 %, N 18,65 %, O 21,3 %, |
| pKa | 4,65[2] |
| Propriétés physiques | |
| T° fusion | 213 °C |
| Précautions | |
| Directive 67/548/EEC | |
 Xi |
|
| Unités du SI et CNTP, sauf indication contraire. | |
En médecine
La molécule proviendrait du métabolisme de la lécithine (ou phosphatidylcholine) contenue dans les aliments, par le microbiote intestinal[3]. La lécithine se transforme en triméthylamine qui est oxydée par la FM03 : « flavin containing mono-oxygenase isoform 3 ». La FM01 intervient également dans une moindre mesure[4]. L'excrétion en est urinaire[5]. L'expression de la FM03 régule le taux de triméthylamine oxydée[4]. L'autre voie de dégradation de la triméthyamine est la déméthylation mais cette voie reste anecdotique chez l'être humain[6].
Le taux d'oxyde de triméthylamine est corrélé avec le risque de survenue de maladies cardio-vasculaires[7] - [8] - [9] ou la gravité de certaines de ses complications[10], dont la mortalité[11].
Plusieurs mécanismes ont été évoqués, dont l'activation plaquettaire avec la facilitation de la formation de thrombus[12], la dysfonction de l'endothelium vasculaire par l'intermédiaire du stress oxydatif[13], l'activation de l'inflammasome NLRP3[14], l'activation de la caspase 3 avec apoptose des cellules musculaires lisses vasculaires et l'augmentation de l'expression de certains enzymes, dont PERK, ATF5 et CHOP[15]. La molécule stimulerait aussi certains types de macrophages et interviendrait dans la genèse de l'athérome[16]. Ce taux est lui-même modulé par la composition du microbiote intestinal et en particulier par la quantité d'archées[17].
Il peut être aussi atténué par supplémentation en DMB (3,3-diméthyl 1-butanol)[18], ce dernier est présent en quantité variée dans certaines huiles, vinaigres et boissons alcoolisées (vin rouge, vinaigre balsamique, huile d'olive..). Le microbiote intestinal responsable de la production de TMA est alimenté par certains composés (carnitine et choline) présents particulièrement dans les viandes rouges, œufs et produits laitiers[19] - [20]. Le microbiote intestinal des végétaliens peut ainsi rendre négligeable la formation de TMAO même après une ingestion momentanée de carnitine et de viande rouge[21].
En biologie marine
Dans un film documentaire de 2017 [22], le réalisateur japonais Manabu Hirose donne la parole au biologiste marin Paul Yancey à propos de la résistance des animaux marins à la pression de l'eau qui croît avec la profondeur. Paul Yancey[23] - [24] explique par une animation graphique que les animaux marins en dessous de 6 500 mètres de profondeur résistent à la pression de l'eau parce qu'ils présentent de l'oxyde de triméthylamine (TMAO pour trimethylamine oxide en anglais) en grande quantité dans leurs corps, qui empêche que leurs protéines soient écrasées par les molécules d'eau plus la pression augmente. Cette pression peut être d'une tonne par centimètre carré à 10 000 mètres de profondeur dans la Fosse des Mariannes où les chercheurs japonais ont découvert des concombres de mer (holoturies) et des amphipodes.
Notes et références
- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- fiche chemIdplus.
- Tang WHW, Wang Z, Levison BS et al. Intestinal microbial metabolism of phosphatidylcholine and cardiovascular risk, N Engl J Med, 2013;368:1575-1584.
- Bennett BJ, de Aguiar Vallim TQ, Wang Z et al. Trimethylamine-N-oxide, a metabolite associated with atherosclerosis, exhibits complex genetic and dietary regulation, Cell Metab, 2013;17:49-60.
- Bain MA, Fornasini G, Evans AM, Trimethylamine: metabolic, pharmacokinetic and safety aspects, Curr Drug Metab, 2005;6:227-240.
- Al-Waiz M, Mitchell SC, Idle JR, Smith RL, The relative importance of N-oxidation and N-demethylation in the metabolism of trimethylamine in man, Toxicology, 1987;43:117-121.
- "Nbci, 2016:Relationship of Serum Trimethylamine N-Oxide (TMAO) Levels with early Atherosclerosis in Humans"
- "Athérosclérose: le rôle du microbiome intestinal"
- Luigina Guasti, Silvia Galliazzo, Marta Molaro et Eleonora Visconti, « TMAO as a biomarker of cardiovascular events: a systematic review and meta-analysis », Internal and Emergency Medicine, vol. 16, no 1, , p. 201–207 (ISSN 1970-9366, PMID 32779113, DOI 10.1007/s11739-020-02470-5, lire en ligne, consulté le )
- Zhu W, Romano KA, Li L et al. Gut microbes impact stroke severity via the trimethylamine N-oxide pathway, Cell Host Microbe, 2021;29:1199–1208.e5
- Wang M, Li XS, Wang Z et al. Trimethylamine N-oxide is associated with long-term mortality risk: the multi-ethnic study of atherosclerosis, European Heart Journal, 2023;44:1608–1618
- Zhu W, Gregory JC, Org E et al. Gut microbial metabolite TMAO enhances platelet hyperreactivity and thrombosis risk, Cell, 2016;165:111–124
- Li T, Chen Y, Gua C, Li X, Elevated circulating trimethylamine N-oxide levels contribute to endothelial dysfunction in aged rats through vascular inflammation and oxidative stress, Front Physiol, 2017;8:350
- Boini KM, Hussain T, Li PL, Koka S, Trimethylamine-N-oxide instigates NLRP3 inflammasome activation and endothelial dysfunction, Cell Physiol Biochem, 2017;44:152–162
- enson TW, Conrad KA, Li XS et al. Gut microbiota–derived trimethylamine N-oxide contributes to abdominal aortic aneurysm through inflammatory and apoptotic mechanisms, Circulation, 2023;147:1079–1096 B
- Wang Z, Klipfell E, Bennett BJ et al. Gut flora metabolism of phosphatidylcholine promotes cardiovascular disease, Nature, 2011;472:57-63.
- "2014:Archaebiotics: proposed therapeutic use of archaea to prevent trimethylaminuria and cardiovascular disease."
- (en) Zeneng Wang, Adam B. Roberts, Jennifer A. Buffa et Bruce S. Levison, « Non-lethal Inhibition of Gut Microbial Trimethylamine Production for the Treatment of Atherosclerosis », Cell, vol. 163, no 7, , p. 1585–1595 (ISSN 0092-8674 et 1097-4172, PMID 26687352, DOI 10.1016/j.cell.2015.11.055, lire en ligne, consulté le )
- (en) Zeneng Wang, Adam B. Roberts, Jennifer A. Buffa et Bruce S. Levison, « Non-lethal Inhibition of Gut Microbial Trimethylamine Production for the Treatment of Atherosclerosis », Cell, vol. 163, no 7, , p. 1585–1595 (ISSN 0092-8674 et 1097-4172, PMID 26687352, DOI 10.1016/j.cell.2015.11.055, lire en ligne, consulté le ) :
« Specifically, choline, phosphatidylcholine, and carnitine—trimethylamine (TMA)-containing nutrients abundant in foods such as meat, egg yolks, and high-fat dairy products—serve as dietary precursors for TMA N-oxide (TMAO) generation in mice and humans, a metabolite that accelerates atherosclerosis in animal models. »
- Wang Z, Bergeron N, Levison BS et al. Impact of chronic dietary red meat, white meat, or non-meat protein on trimethylamine N-oxide metabolism and renal excretion in healthy men and women, Eur Heart J, 2019;40:583–594
- Robert A. Koeth, Zeneng Wang, Bruce S. Levison et Jennifer A. Buffa, « Intestinal microbiota metabolism of L-carnitine, a nutrient in red meat, promotes atherosclerosis », Nature medicine, vol. 19, no 5, , p. 576–585 (ISSN 1078-8956, PMID 23563705, PMCID 3650111, DOI 10.1038/nm.3145, lire en ligne, consulté le ) :
« The formation of TMAO from ingested L-carnitine is negligible in vegans, and fecal microbiota composition associates with plasma TMAO concentrations »
- « Abysses - La vie dans les profondeurs extrêmes », sur www.arte.fr,
- (en) Paul H. Yancey, « Organic osmolytes as compatible metabolic and counteracting cycloprotectants in high osmolarity and other stresses », The Journal of Experimental Biology, Volume=208, 2005 august, p. 2819-2830 (ISSN 0022-0949, lire en ligne)
- PMID