Microcèbe mignon
Microcebus murinus • Chirogale mignon

Statut CITES
Le Microcèbe mignon (Microcebus murinus) ou Chirogale mignon[1] est une petite espèce de lémurien de Madagascar. Pesant 58 à 67 grammes, il est le plus grand des microcèbes (genre Microcebus), un groupe qui comprend les plus petits primates au monde. L'espèce est connue localement (en malgache) comme tsidy, koitsiky, titilivaha, pondiky et vakiandry. Le Microcèbe mignon, et les autres microcèbes, sont considérés comme des espèces cryptiques, car ils sont presque impossibles à distinguer les uns des autres par l'apparence. Pour cette raison, le Microcèbe mignon était considéré comme la seule espèce de microcèbe pendant des décennies, jusqu'à ce que des études plus récentes ont commencé à faire la distinction entre les espèces.
Comme tous les microcèbes, cette espèce est nocturne et arboricole. Elle est très active, et, si elle se nourrit seul, elle forme des groupes mixtes pour se coucher et se reposer dans des trous d'arbres pendant la journée. Le Microcèbe mignon présente une forme de dormance appelé « torpeur » pendant les mois d'hiver, frais et secs, et dans certains il peut hiberner, ce qui est rare chez les primates. Le Microcèbe mignon vit dans plusieurs types de forêt dans l'ouest et le sud de Madagascar. Son régime alimentaire se compose principalement de fruits, d'insectes, de fleurs et nectar. Dans la nature, ses prédateurs naturels comprennent les hiboux, les serpents, et certains mammifères endémiques. La pression de prédation est plus élevée pour cette espèce que chez d'autres espèces de primates, avec un individu sur quatre attrapé par un prédateur chaque année. Ceci est contrebalancé par son taux de reproduction élevé. La reproduction est saisonnière, et ses vocalisations bien reconnaissables lui permettent d'éviter l'hybridation avec d'autres espèces partageant son aire de répartition. La gestation dure environ 60 jours, et donne généralement naissance à deux jeunes. Ceux-ci sont généralement indépendants au bout de deux mois, et peuvent se reproduire après un an. Le Microcèbe mignon a une durée de vie moyenne de cinq ans, bien que certains individus en captivité ont atteint un âge allant jusqu'à 15 ans.
Bien que menacé par la déforestation, la dégradation de son habitat et la capture d'animaux vivants pour le commerce illégal, il est considéré comme l'un des petits mammifères indigènes de Madagascar les plus abondants. Il peut tolérer des pénuries alimentaires modérées en ralentissant son métabolisme et en tombant en « torpeur », mais les pénuries alimentaires prolongées liées au changement climatique peuvent présenter un risque significatif pour cette espèce.
Anatomie et physiologie

Le Microcèbe mignon a de nombreuses similitudes avec les autres microcèbes, dont une fourrure douce, une longue queue, de longues pattes postérieures, une bande dorsale sur le dos (pas toujours distincte), un museau court, un crâne arrondi, des yeux proéminents[2], et de grandes oreilles membraneuses décollées[3] - [4] - [5]. Il a de grands yeux et un tapetum lucidum qui lui permet d'avoir une bonne vision nocturne[5]. Le pelage dorsal est gris-brun avec des teintes plus ou moins rougeâtres, les flancs sont gris à beige clairs et le pelage ventral présente des taches beige ou beige-blanchâtre terne discrets sur une partie de l'abdomen. Sur le visage arrondi, il y a une tache blanche pâle au-dessus du nez et entre les yeux et certains individus ont des marques orbitales sombres. La fourrure des mains et des pieds est de couleur blanc cassé[3].
Le Microcèbe mignon est un des plus petits primates du monde, mais il est paradoxalement le plus grand des microcèbes[5]. Sa longueur totale est de 25 à 28 cm, avec une longueur de la tête et du corps de 12 à 14 cm et une queue de 13 à 14,5 cm[3]. Le poids moyen pour cette espèce est de 60 g[5], des variations entre 58 et 67 g[3], voire entre 40 et 70 g[5] ont été reportées. Le Microcèbe mignon est plus petit que le plus petit singe au monde, le Ouistiti pygmée, dont le poids varie entre 85 et 140 g[2]. Son poids varie selon la saison, et les animaux des deux sexes peuvent constituer des réserves de graisse représentant jusqu'à 35 % de leur masse corporelle, qui sont situées au niveau de la queue et des pattes arrière, avant la saison sèche et les périodes de dormance[5]. La queue du Microcèbe mignon peut quadrupler de volume pendant la saison des pluies quand il fait ses réserves de graisse. Même en captivité lorsque les contraintes environnementales ne posent pas de problème, le Microcèbe mignon montre des pratiques alimentaires saisonnières, avec une plus grande consommation de protéines au cours de ce qui serait dans la nature leur saison la plus active[6].
Les chercheurs ont identifié des différences dans la morphologie des premières et deuxièmes molaires entre le Microcèbe mignon et le Microcèbe gris-roux. Chez ce dernier, la première molaire inférieure (M1) est carré et les première et deuxième molaires supérieures (M1 et M2) ont des légères indentations vers le milieu du bord postérieur. Le Microcèbe mignon dispose d'une M1 plus allongée et n'a pas d'indentation sur M1 et M2[7]. En termes de dentition général, le Microcèbe mignon partage la même formule dentaire avec tous les autres membres de sa famille, les Cheirogaleidae :. 2.1. 3.32.1.3.3 × 2 = 36[8].
Cette espèce possède 66 chromosomes[9], et son caryotype ressemble fortement à celui des chirogales (genre Cheirogaleus). À l'exception du chromosome X, tous les chromosomes sont acrocentriques (avec le bras court absent ou quasi absent)[10]. La taille du génome est de 3,12 picogrammes (pg)[9].
Écologie
Comme les autres membres de la famille des Cheirogaleidae, le Microcèbe mignon est nocturne et arboricole. Il vit dans les forêts tropicales sèches de basse altitude, les broussailles épineuses semi-arides, les forêts galeries, les fourrés épineux, la forêt du littoral est, les forêts décidues sèches, les forêts caduques semi-humides, les forêts des basses terres de Madagascar, les forêts de transition et les forêts secondaires ou plantées, à chaque fois jusqu'à 800 m d'altitude[3] - [4] - [5]. L'espèce est plus commune dans la forêt secondaire que dans la forêt primaire, particulièrement broussailleuse, dans laquelle il ne peut que se limiter à une niche écologique restreinte verticalement à la zone où l'on trouve des petites branches, des lianes et un feuillage dense[4] - [5] - [11]. Ces lémuriens vivent sur des branches qui mesurent généralement moins de 5 cm de diamètre[11]. Le Microcèbe mignon préfère les niveaux inférieurs de la forêt et les sous-bois, où les branches et la végétation sont denses[5].
Dans la forêt secondaire, on le trouve du niveau du sol jusqu'à une hauteur de 10 m, contre entre 15 et 30 m dans la canopée des forêts primaires[4] - [11]. Des études ont montré que cette espèce pouvait passer jusqu'à 40 % de son temps en dessous de 3 m de hauteur, et même 70 % de son temps durant la saison sèche, quand les plantes ne proposent pas beaucoup de nourriture et que son régime alimentaire est composé d'une bonne part d'insectes[11]. Cette espèce est présente en plus grand nombre dans les forêts épineuses comme celle du parc national d'Andohahela que dans les forêts galeries, préférant les forêts plus sèches du littoral quand le Microcèbe roux préfère les forêts tropicales humides de l'intérieur des terres[4].
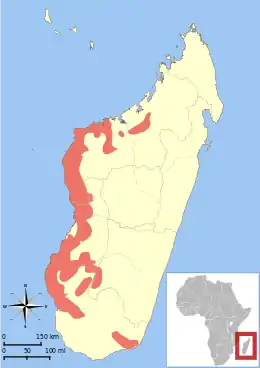
On connait mal les limites exactes de son aire de répartition. On pense qu'elle s'étend de la rivière Onilahy ou du lac Tsimanampetsotsa au sud au parc national d'Ankarafantsika au nord[3] - [5]. Il existe également une population isolée dans la partie sud-est de l'île, près de Tôlanaro et du parc national d'Andohahela, au-dessus de la Mandena Conservation Zone[3] - [5]. Les individus occupent de petits territoires de 1 à 2 ha[5]. Le Microcèbe mignon est sympatrique avec le Microcèbe gris-roux, le Microcèbe brun-doré, le Microcèbe de Mme Berthe et plusieurs autres lémuriens de la famille des Cheirogaleidae[3]. Dans le parc national d'Ankarafantsika, où il vit avec le Microcèbe gris-roux, la densité de sa population est plus importante à des altitudes plus hautes et dans des habitats plus secs, tandis que le Microcèbe gris-roux préfère les zones de basses altitudes et les habitats plus humides[12]. Une autre étude portant sur l'éventuelle cohabitation entre le Microcèbe mignon et le Microcèbe de Mme Berthe a observé que chacune des deux espèces avait sa niche écologique bien particulière, et n'entrait pas en concurrence avec l'autre[13].
Le Microcèbe mignon peut présenter des populations avec une très forte densité d'animaux, pouvant atteindre plusieurs centaines d'animaux par km2[4] - [5] (jusqu'à 167 individus/km2 au parc national d'Ankarafantsika et 712 individus/km2 au parc national de Kirindy Mitea)[4]. Cette abondance n'est pas uniforme et concerne de petits noyaux d'animaux[5]. Cette particularité rend difficile d'estimer précisément la densité de population sur une grande zone à partir de celle observée sur une zone restreinte. La difficulté à observer les animaux pendant certaines périodes de l'année, notamment la saison sèche, complique aussi un peu plus l'évaluation de la population [4].
Alimentation
Les microcèbes sont omnivores, et se nourrissent principalement d'insectes et de fruits. Le Microcèbe mignon peut même descendre au niveau du sol pour attraper des insectes[4], mais il retourne ensuite immédiatement retrouver la protection du feuillage des arbres pour consommer sa prise[11]. Le nectar fait également partie du régime alimentaire de ce microcèbe, ce qui en fait un pollinisateur potentiel pour diverses espèces de plantes locales[5]. Un seul cas de cannibalisme d'un mâle sur une femelle adulte est connu[14].
Prédateurs


Les principaux prédateurs du Microcèbe mignon sont le Hibou malgache (Asio madagascariensis) et la Chouette effraie (Tyto alba)[3] - [11]. Des études menées dans la réserve spéciale de Beza Mahafaly et dans le parc national de Kirindy Mitea ont montré un taux de prédation de l'ordre de 25 % (pourcentage de la population prise par un prédateur chaque année), soit le plus important connu pour un primate. Toutefois, étant donné le fort taux de reproduction de l'espèce, cela n'a pas un impact trop important sur sa population[11]. D'autres oiseaux de proie, comme l'Autour de Henst (Accipiter henstii) et d'autres chouettes se nourrissent de cette espèce. Des serpents, comme Ithycyphus miniatus (un colubridé endémique de l'île) et le Boa arboricole de Madagascar, (Sanzinia madagascariensis), ainsi que divers mammifères comme la Mangouste à queue annelée, la Mangouste à dix raies, le Fossa, et le chien domestique peuvent également s'attaquer à ce microcèbe[5] - [11]. Ces mammifères découvrent souvent les trous dans les arbres servant de nids, et en agrandissent l'ouverture pour y pénétrer et manger les occupant. Cela conduit à une forte pression de sélection sur le choix du nid en fonction du diamètre de l'ouverture et de la profondeur[11].
Du fait de son comportement non grégaire, le Microcèbe mignon, comme d'autres lémuriens nocturnes, se défend face en prédateur en fuyant[11], bien que quelques défenses de groupe ont été observées dans cette espèce, en poussant des cris d'alarme et harcelant un prédateur en groupe pour le faire fuir[15]. Des études sur la réaction du microcèbe à l'odeur de fèces de prédateurs et de non prédateurs en captivité a montré qu'il avait une prédisposition à reconnaître ceux de prédateurs en détectant les métabolites issus de la digestion de la viande. Le Microcèbe mignon en captivité évite également les zones où il reçoit des récompenses, de même qu'il montre une activité plus importante et un comportement de défense lorsque des fèces de prédateur sont présents à cet endroit, mais pas s'il s'agit de l'odeur fécale d'animaux malgaches non prédateurs[16].
Pendant la journée, quand il est le plus vulnérable, le Microcèbe mignon se réfugie dans des trous d'arbres, qui forment parfois des nids. Chaque individu peut utiliser trois à neuf trous différents au sein de son territoire, mais il peut aussi utiliser un même trou pendant jusqu'à cinq jours consécutifs[3] - [5]. Le Microcèbe mignon préfère les arbres creux, mais peut également faire de petites constructions sphériques avec des feuilles. Les nids sont généralement placés dans des trous d'arbres d'un diamètre minimum de 5 cm, avec une médiane de 13 cm[4]. Le Microcèbe mignon passe la plupart de son temps dans de la végétation dense, où il est peu visible et accessible pour les prédateurs.
Comportement
Le Microcèbe mignon est nocturne, dormant pendant la journée dans des trous d'arbres tapissés de feuilles, ou des nids construits avec des feuilles mortes, de la mousse et des brindilles[5]. Il se nourrit généralement seul pendant la nuit, mais dort en groupe le jour, le temps passé à chacune de ses activités dépendant du sexe et de la saison[4]. Les trous d'arbres peuvent être partagés avec jusqu'à 15 autres individus[5], les mâles ayant plutôt tendance à dormir seuls au contraire des femelles qui dorment plus souvent en groupes[3].

Tous les microcèbes sont très actifs la nuit[2], courant sur les branches et faisant des bonds de plus de 3 m[11], en utilisant sa queue comme un balancier[2]. Quand ils évoluent sur les petites branches des buissons et des arbres, ils s'agrippent et se déplacent en utilisant leurs quatre pattes[2] - [11]. Au sol, que ce soit pour attraper des insectes ou traverser de courtes étendues, les microcèbes sautent à la manière des grenouilles[2]. Quand il chasse, le Microcèbe mignon saisit des invertébrés et de petits vertébrés avec sa main avec une grande vivacité[6].
Durant la saison sèche, le Microcèbe mignon est confronté à la difficulté d'exploiter des ressources alimentaires éparses de manière efficace. Les résultats d'une récente étude sur ce sujet ont montré que le Microcèbe mignon ne se déplaçait pas au hasard, mais utilisait des repères spatiaux en l'absence de signaux sensoriels pour effectuer fréquemment le même circuit et passer en revue les différents points où il est possible de trouver de la nourriture en faisant le moins de chemin possible. Le Microcèbe mignon semble se faire une très bonne représentation de l'environnement alentour, lui permettant d'être efficace dans sa recherche de nourriture[17].
Le Microcèbe mignon se nourrit lentement, changeant souvent de direction et de hauteur. Il attrape généralement les insectes au sol[4]. Avant de descendre, il fait bouger son pavillon auriculaire afin de repérer l'emplacement exact de sa proie. Il se jette rapidement sur l'insecte dans la litière de feuilles puis le transporte dans sa bouche avant de le consommer en sécurité parmi les branches[11]. Des études sur des microcèbes mignons en captivité ont montré que la vision avait un rôle majeur pour repérer ses proies, mais que les autres sens jouaient aussi un rôle[18].
Le Microcèbe mignon est omnivore[5], se nourrissant principalement de fruits et d'invertébrés[4] - [11]. Localement les populations s'adaptent aux fruits à leur disposition. À Marosalaza et Mandena, les coléoptères sont le principal insecte chassé, bien que les mites, les mantes, les Fulgoridae, les grillons, les blattes et les araignées sont aussi consommés. Presque la moitié du bol alimentaire est constitué d'insectes, les fruits occupant une fraction légèrement plus importante[11]. Ce lémurien consomme également des fleurs, de la gomme et du nectar d'Euphorbia et de Terminalia, des feuilles d'Uapaca, des sécrétions de larves d'Hemiptera et de petits vertébrés comme des grenouilles arboricoles, des geckos et des caméléons[3] - [4] - [5]. Son régime alimentaire varie suivant la saison et est très divers, et le Microcèbe mignon occupe donc une niche beaucoup plus large que celle du Microcèbe de Mme Berthe. C'est pourquoi il est plus touché par la diminution de la ressource globale en nourriture que par l'occupation d'une même niche lorsque les deux espèces sont sympatriques[19].
Dormance
Comme tous les autres microcèbes, le Microcèbe mignon est connu pour entrer quotidiennement dans de courtes périodes de torpeur, notamment pendant l'hiver austral frais et sec[20] - [21] - [22]. Ce comportement rare chez les primates[23], couplé avec la facilité pour observer cette espèce dans sa vaste aire de répartition[3] et sa présence courante en captivité[24], en font un sujet de choix comme organisme modèle pour étudier ce comportement.

Le Microcèbe mignon est unique parmi les autres microcèbes aussi bien étudiés car il peut prolonger sa torpeur sur une longue période, mais ce comportement n'a été observé que dans une zone précise[22]. L'activité peut varier fortement entre sexes et d'une population à l'autre. Dans la Ampijoroa Forestry Station dans le parc national d'Ankarafantsika, les mâles et les femelles ont une période de torpeur quotidienne plutôt que saisonnière[3] - [21]. Dans la forêt de Kirindy Forest, les deux sexes montrent une période de torpeur quotidienne, mais pendant la saison sèche (d'avril/mai à septembre/octobre), les femelles deviennent complètement inactives pendant plusieurs semaines voire jusqu'à 5 mois pour conserver leur énergie. Les mâles eux sont rarement inactifs pendant plus de quelques jours et deviennent très actifs juste avant que les femelles ne sortent de leur torpeur, établissant leur hiérarchie et leurs territoires pour la saison de reproduction[3] - [5] - [21]. L'utilisation de stratégies d'économie d'énergie différentes pour des conditions environnementales similaires a été observée directement en 2008, fournissant la première confirmation physiologique sur le terrain de ce phénomène[23]. Cette différence de comportement en fonction de la région s'explique elle par le climat local[11], puisque Kirindy est la seule région à l'ouest des montagnes de l'est aux forêts tropicales qui subit des températures très basses en hiver. En entrant dans une période de torpeur prolongée, les femelles réduisent le stress lié à la thermorégulation[22], tandis que les mâles restent plus actifs pour préparer la prochaine saison de reproduction[3]. Aucune différence au niveau de la mortalité n'a été observée entre les femelles en dormance et les mâles actifs[25].
Durant la torpeur, le Microcèbe mignon réduit son métabolisme et sa température corporelle descend au niveau de la température ambiante, jusqu'à un minimum de 7 °C. Durant les mois les plus froids de mai à août, les animaux choisissent un trou d'arbre plus près du sol, où la température ambiante est plus stable. Cela leur permet de rester en torpeur plus longtemps, et de conserver des ressources métaboliques[5]. Une étude a montré que durant la saison de reproduction, mâles et femelles réduisent leurs dépenses énergétiques de 20 % quand ils nichent par deux, et jusqu'à 40 % s'ils nichent par trois. Même en dehors de la saison de reproduction, le gain énergétique maximum est observé quand deux animaux ou plus nichent ensemble[26].
Le Microcèbe mignon vit dans les forêts décidues primaires et secondaires, mais la densité des populations est plus faible dans les forêts secondaires. La variation dans l'abondance de ce microcèbe semble liée à sa capacité à entrer en torpeur durant la saison sèche, notamment pour les femelles. En effet, dans les forêts primaires, ils peuvent rester en torpeur quotidienne ou en hibernation tant que leur température corporelle reste en dessous de 28 °C, mais dans les forêts secondaires où les arbres sont plus grands, les températures sont plus élevées, ce qui limite la capacité des microcèbes à rester longtemps en torpeur. Par ailleurs, le Microcèbe mignon a une masse légèrement plus petite dans les forêts secondaires que dans les forêts primaires, et un taux de survie plus faible. Cela est vraisemblablement lié au fait que les microcèbes les plus petits soient ceux qui entrent le moins aisément en torpeur, et dépensent donc 40 % d'énergie supplémentaire que ceux qui entrent en torpeur[27].
Cette capacité inhabituelle pour un primate d'entrer en dormance, ainsi que la petite taille de l'espèce, ont conduit les chercheurs à émettre l'hypothèse suivant laquelle les premiers lémuriens, et peut-être même les premiers primates, partageaient certains traits avec les microcèbes. En conséquence, le Microcèbe mignon a été une nouvelle fois utilisé comme organisme modèle pour étudier l'évolution des primates et des lémuriens[22]. Par exemple, on pense que les lémuriens ont colonisé Madagascar en dérivant avec de la végétation jusqu'à l'île il y a environ 60 millions d'années selon des études de phylogénie moléculaire[28] - [29]. Avant que l'on ne découvre que les courants océaniques étaient autrefois l'inverse d'aujourd'hui, ce qui conforte cette hypothèse[30], on pensait qu'il était impossible de faire un voyage si long pour un animal qui ne serait pas entré en état de dormance pour survivre au voyage. C'est pourquoi on pensait que les microcèbes, comme le Microcèbe mignon, partageaient la faculté d'entrer en dormance avec les lémuriens primitifs[22].
Systèmes sociaux
Le Microcèbe mignon est décrit comme un animal solitaire mais social[11], se nourrissant seul la nuit mais dormant fréquemment en groupe la journée[4] - [5]. Ce comportement varie suivant le sexe et la région. Les femelles partagent couramment leur nid avec d'autres femelles et leur progéniture, tandis que les mâles dorment seuls ou en couples en dehors de la saison de reproduction[3] - [4] - [5]. Les groupes de femelles partageant le même nid peuvent être stables, et comprendre entre deux et neuf individus, et un mâle peut parfois être trouvé dans un groupe de femelle en dehors de la période de reproduction[2]. Durant la saison de reproduction (de septembre à octobre), les mâles et les femelles peuvent dormir dans le même trou d'arbre[5] - [2]. Des groupes mixtes sont communs à ce moment, un mâle partageant son nid avec trois à sept femelles, ou une femelle partageant son nid avec un à trois mâles[4].
La recherche a montré que les domaines vitaux pour le Microcèbe mignon sont généralement de petite taille, mesurant peut-être moins de 50 m de diamètre[4]. Les mâles circulent en général surtout la nuit et ont des domaines vitaux qui sont deux fois plus grands que ceux des femelles[3] - [4], et qui se chevauchent souvent avec celui d'un autre mâle, et systématiquement avec celui d'au moins une femelle[5] - [2]. Les domaines vitaux sont trois fois plus importants au cours de la saison de reproduction que le reste du temps[3] - [5].
Les domaines vitaux des femelles se chevauchent moins que ceux des mâles, même si des concentrations localisées, ou « noyaux de population », se forment dans certaines régions, où le sex-ratio est de trois à quatre femelles pour un mâle[4]. Des études génétiques indiquent que les femelles se partagent le territoire en groupes (« noyaux de population ») d'individus apparentés, tandis que les mâles ont tendance à émigrer de leur groupe natal[3]. Les chercheurs ont montré que les femelles de cette espèce peuvent conserver des distances plus courtes et des liens plus étroits avec les autres femelles que pour d'autres espèces de microcèbes, du fait de leur régime alimentaire opportuniste et, dans le cas des populations de Kirindy, de la pratique de la torpeur saisonnière[31].
Communication
| Cris du Microcèbe mignon | |
| Cri d'alerte du Microcèbe mignon | |
| Cri pour indiquer son territoire | |
Des difficultés à utiliser ces médias ? | |
|---|---|
Les vocalisations et l'odorat sont les principaux modes de communication de cette espèce. Les territoires sont marqués par l'odeur de l'urine et des fèces[2]. Les vocalisations sont complexes et très aigus (allant de 10 à 36 kHz), parfois au-delà de ce que peut entendre l'oreille humaine (0,02 à 20 kHz)[2] - [32]. Ces différents cris sont utilisés pour appeler un partenaire, communiquer à distance, alerter ses congénères ou indiquer une situation de détresse[2].
Comme d'autres microcèbes, le Microcèbe mignon utilise ce qui a été décrit comme un sifflement harmonieux dont la fréquence est plus basse et la durée plus courte que celui de son proche parent, le Microcèbe roux. En outre, il a été constaté que les différents types de vocalisations émises par le Microcèbe mignon peuvent dépendre de son environnement. Dans les forêts sèches plus ouvertes qu'il affectionne particulièrement, les trilles sont plus fréquentes et efficaces car elles ont une meilleure portée et sont moins susceptibles d'être masquées par le vent, tandis que les appels chirp du Microcèbe roux sont plus adaptés aux forêts tropicales fermées, son habitat de prédilection[33].
Comme pour les autres mammifères sociaux, les appels diffèrent suivant le sexe et l'identité de l'individu. Des dialectes différents ont également été observés d'une communauté à l'autre. Le mâle émet un trille qui fait partie de sa parade nuptiale et qui ressemble à un chant d'oiseau du fait de la séquence ordonnée de syllabes de 0,3 à 0,9 seconde aux fréquences variées (entre 13 et 35 kHz), pouvant être répétée jusqu'à 1,5 fois par minute. Chaque population à son propre trille qui est distinct de celui des communautés voisines, et chaque mâle produit un trille propre au sein d'une même population. Ces appels ne sont pas induits par la génétique. Pendant leurs jeux, les jeunes mâles produisent leurs premières trilles, qui présentent un degré élevé de variabilité. Des recherches ont montré que les mâles que l'on changeait de lieu modifiaient consciemment leurs vocalisations pour que celles-ci ressemblent à celles de leurs voisins. Cela peut réduire l'agressivité des animaux entre eux et favoriser l'acceptation sociale pour les mâles lorsqu'ils émigrent de leur groupe natal une fois matures[32].
Comme les microcèbes sont des espèces cryptiques, et donc très difficiles à voir, leurs appels aident les individus à choisir un partenaire de son espèce. Cette signalisation différenciée et ce système de reconnaissance favorise la cohésion de l'espèce malgré l'isolement qui précède l'accouplement, et permet aux chercheurs de distinguer et identifier les espèces facilement[34].
Reproduction
Les accouplements sont de type polygames, un mâle pouvant s'accoupler avec plusieurs femelles et une femelle avec plusieurs mâles. Les mâles établissent une hiérarchie entre eux avant la saison des amours, bien que certaines études n'ont pas observer une quelconque agressivité des mâles ou une concurrence pour une femelle. Les mâles en captivité deviennent très agressifs et forment des hiérarchies strictes. Ces mâles captifs peuvent atteindre des taux plasmatiques de testostérone parmi les plus hauts de tous les mammifères, et la simple odeur d'un mâle dominant peut faire diminuer le niveau de testostérone et inhiber sexuellement un mâle subordonné[11]. Pendant la saison de reproduction, les testicules des mâles voient leur taille considérablement augmenter[3], cela pour se donner un avantage dans la compétition spermatique puisque les femelles s'accouplent avec plusieurs mâles. Des études sur le Microcèbe mignon ont montré que la période optimale pour la fécondation se situe au début des chaleurs de la femelle[35]. Pendant la période de reproduction, la mortalité des mâles devient supérieure à celle des femelles, alors qu'elles sont comparables le reste de l'année[25].
Bien que le Microcèbe mignon affiche un comportement polygame, des études ont montré que les femelles font une sélection indirecte du père de leur progéniture. En effet, les femelles s'accouplent avec un à sept mâles jusqu'à onze fois au cours de leur seule nuit de réceptivité, et empêchent un même mâle de monopoliser l'accouplement. Ceux qui y parviennent sont les plus grands et les plus lourds, et ils ont donc plus de chances de féconder la femelle. Toutefois en multipliant les accouplement avec des mâles différents, les femelles augmentent la diversité génétique parmi leur progéniture, souvent issue de plusieurs pères[36].
Le Microcèbe mignon présente un dimorphisme sexuel au niveau de sa masse corporelle, qui fluctue suivant la saison. Le poids des mâles augmente avant la saison de reproduction, ce qui semble être un avantage pour trouver une femelle réceptive en œstrus, et leur permet de supporter des périodes de torpeur moins longues. L'étude a révélé que cela s'explique par le fait que les mâles présentent une activité continue pendant la saison sèche alors que les femelles hibernent. Ainsi, le dimorphisme sexuel en termes de poids est dépendant des conditions environnementales et peut donc varier selon la saison, la zone géographique, la population et le comportement spécifique des individus[37].
Les femelles sont réceptives pendant 45 à 55 jours entre septembre et octobre, et l'œstrus dure entre un et cinq jours[3] - [5] - [2]. Les femelles préviennent qu'elles sont en œstrus par des appels distinctifs et une odeur caractéristique[5]. La gestation dure 54 à 68 jours[2] avec une moyenne de soixante jours, et la femelle donne généralement naissance à deux ou trois petits de 5 g chacun[3] - [4] - [5] - [2]. Les petits naissent dans un nid de feuilles ou un trou d'arbre en novembre, avant le début de la saison des pluies[5]. Le sevrage a lieu après 25 jours[5], et les nourrissons sont soit laissés dans le nid, soit transportés dans la bouche de leur mère et déposés sur une branche tandis qu'elle s'alimente[5] - [11]. Les jeunes microcèbes ne s'accrochent pas à la fourrure de leur mère. Ils sont indépendants à l'âge de deux mois[4] - [5], tandis que la maturité sexuelle est atteinte entre 10 et 29 mois pour les femelles et entre sept et 19 mois chez les mâles[4] - [2]. Les femelles apparentées restent étroitement liées par la suite, tandis que les mâles se dispersent loin de leur région natale[2].
Dans la nature, la durée de vie du Microcèbe mignon ne dépasse par cinq ans, bien que certains spécimens captifs ont vécu jusqu'à quinze ans et cinq mois[2]. Une étude du CNRS sur des individus en captivité a montré qu'une alimentation équilibrée et moins riche en calories que la normale ralentit globalement le vieillissement et diminue l'apparition de maladie ce qui leur permet de vivre plus longtemps. La quantité de matière grise a en revanche légèrement diminuée dans certaines zones du cerveau sans qu'une baisse des performances cognitives ou physiques n'ait été mesurée[38].
Il arrive aux femelles Microcèbe mignon d'élever leurs petits en commun. La femelle transfère régulièrement sa progéniture dans le nid d'autres femelles, qui s'en occupe comme de sa propre progéniture, sans faire de distinction. Même si cela peut demander beaucoup d'énergie pour une femelle en lactation, cela peut être bénéfique finalement pour assurer la survie des jeunes au sein de groupes étroitement liés, où le risque de mortalité est élevé. Une étude qui a eu lieu sur trois saisons de reproduction a montré que les femelles forment de tels groupes essentiellement quand il y a un manque de perchoirs appropriés à la confection de nids. Un nid commun est par ailleurs plus facile à défendre, et les petits dépensent moins d'énergie pour leur thermorégulation comme ils sont plus nombreux. Par ailleurs, l'adoption de jeunes dont la mère est morte par une femelle apparentée est très utile dans une espèce où le taux de mortalité des adultes est élevé[39].
Étymologie
Le Microcèbe mignon doit le nom de son genre, Microcebus, aux termes grecs mikros qui signifie « petit », et kebos qui signifie « singe ». La version latine de kebos, cebus, est un suffixe commun dans les noms d'espèces de primates, et est employé malgré le fait que le Microcèbe mignon est un lémurien, et non un singe. Le nom spécifique, murinus, signifie « comme une souris » et dérive du mot latin mus signifiant souris, auquel est adjoint le suffixe -inus qui signifie « comme »[40]. Cela fait référence à sa petite taille et sa couleur gris souris.
Le Microcèbe mignon est connu localement sous plusieurs noms en malgache, en fonction de la région. Autour de Tolanaro (Fort Dauphin), il est appelé pondiky. Dans la partie nord de son aire de répartition, il est connu comme tsidy. Autour de Morondava, on l'appelle koitsiky, titilivaha et vakiandry[3] - [4]. Dans de nombreux cas, ces noms malgaches sont également utilisés pour d'autres espèces de microcèbes visuellement indiscernables qui vivent dans la même aire de répartition[20].
Taxonomie
Le Microcèbe mignon est un lémurien, une sorte de primate, et appartient à l'ordre des Strepsirrhini et l'infraordre des Lemuriformes[41]. Parmi les Lémuriformes, il appartient à la famille des Cheirogaleidae, qui contient les microcèbes, les lémurs nains, les mirzas, les allocèbes et les Phaner. Le genre Microcebus inclut les plus petits primates au monde[41] - [3] - [5] - [2]. Les analyses phylogénétiques de séquences d'ADN de diverses espèces de lémuriens laissent à penser que l'espèce la plus étroitement liée au Microcèbe mignon est le Microcèbe gris-roux (M. griseorufus)[42].
Décrit pour la première fois en 1777 par l'illustrateur anglais John Frederick Miller[41], M. murinus est restée longtemps la seule espèce de son genre, et le nom utilisé pour tous les microcèbes de Madagascar entre la première révision taxonomique majeure en 1931 et une importante étude menée en 1972 sur ces animaux. Cette étude élève au rang d'espèce le Microcèbe roux, M. rufus, autrefois considéré comme une sous-espèce[21]. Lors de cette révision, le Microcèbe mignon a été considéré comme le microcèbe qui occupait les régions sèches du nord, de l'ouest et du sud de Madagascar, tandis que le Microcèbe roux occupait la forêt tropicale à l'est. Plus récemment, la compréhension scientifique de la distribution et de la diversité des microcèbes s'est améliorée et une taxonomie beaucoup plus complexe a été révélée[5]. D'autres études sur le terrain, des tests génétiques, et des révisions taxonomiques tout au long des années 1990 et 2000 ont permis la découverte de nombreuses nouvelles espèces de microcèbes, et le genre comprend désormais au moins 17 espèces cryptiques[43] - [44] - [45] - [46].
Statut de sauvegarde

Le Microcèbe mignon a été inscrit à l'Annexe 1 de la Convention on International Trade in Endangered Species (CITES) en 1975[47], le déclarant comme menacé d'extinction et interdisant le commerce international de spécimens à l'exception des usages non commerciaux, comme la recherche scientifique[48]. En 2008 l'espèce est répertoriée dans la liste rouge de l'UICN comme une espèce de Préoccupation mineure (LC) avec une population qui a tendance à décliner.
Les plus grandes menaces sont la perte de son habitat du fait de l'agriculture sur brûlis et du pâturage du bétail, ainsi que la capture pour le commerce des animaux de compagnie dans les parties nord et sud de son aire de répartition. Bien que cette espèce peut vivre dans les forêts secondaires, des études ont montré que cet l'habitat de qualité moindre affecte défavorablement ses populations car il trouve moins de trous d'arbres, et a donc moins de possibilités pour économiser son énergie en tombant en torpeur, ce qui fait augmenter le stress et la mortalité[4] - [3]. Une étude a révélé neuf espèces de parasites dans les fèces du Microcèbe mignon vivant dans des forêts dégradées et fragmentées. Dans des forêts de bonne qualité mais de taille très réduite, ainsi que dans des forêts très dégradées, le Microcèbe mignon présente en effet une prévalence plus élevée de nématodes et de protozoaires parasites que ceux des grandes forêts de bonne qualité[49]. Des études menées à la fin des années 1960 et 1970 ont montré que la forte exploitation forestière entre 1968 et 1970 s'était traduite par une diminution du poids des microcèbes, qui utilisaient de plus petits arbres pour faire leurs nids, et une diminution de la taille des groupes de femelles faisant leurs nids en commun (sept contre quinze auparavant)[4]. Par ailleurs, bien que la torpeur quotidienne peuvent aider à économiser de l'énergie et préserver des ressources en période de pénurie alimentaire modérée, les pénuries alimentaires prolongées provoquées par le changement climatique pourrait créer trop de stress et de graves répercussions sur la capacité de survie de l'espèce[50] - [51].
Le Microcèbe mignon est considéré comme l'un des petits mammifères endémiques de Madagascar les plus abondants, et on le trouve dans sept parcs nationaux, cinq réserves spéciales, la réserve privée de Berenty, et d'autres forêts protégées privées au sein de la Zone de conservation de Mandena[3].
Cette espèce de microcèbe se reproduit très bien en captivité, même si elle n'est pas souvent présente dans les zoos, au contraire d'autres lémuriens plus grands. En 1989, plus de 370 individus sont détenus par quatorze institutions de l'International Species Information System (ISIS) ou non aux États-Unis et en Europe, dont 97 % sont nés en captivité[4]. En , 167 ont été enregistrés dans 29 institutions de l'ISIS, dont le Duke Lemur Center[4] - [24].
Notes et références
- (en) Murray Wrobel, 2007. Elsevier's dictionary of mammals: in Latin, English, German, French and Italian. Elsevier, 2007. (ISBN 0444518770), 9780444518774. 857 pages. Rechercher dans le document numérisé
- (en) R.M. Nowak, Walker's Primates of the World, Baltimore/London, Johns Hopkins University Press, , 224 p. (ISBN 0-8018-6251-5), p. 66–67, 126.
- (en) R. Mittermeier et al., Chapter 1: Origin of the lemurs, 104–107 p..
- (en) C. Harcourt et J. Thornback, Lemurs of Madagascar and the Comoros. The IUCN Red Data Book, Gland (Switzerland)/Cambridge, IUCN, , 240 p. (ISBN 2-88032-957-4), p. 32–38
- (en) N. Garbutt, Mammals of Madagascar, A Complete Guide, A & C Black, , 86–88 p. (ISBN 978-0-300-12550-4).
- (en) John G. Fleagle, Primate Adaptation and Evolution, San Diego/London/Boston, Academic Press, , 2e éd., 596 p. (ISBN 0-12-260341-9), p. 86.
- (en) K.M. Muldoon, D.D. de Blieuxb, E.L. Simons et P.S. Chatrath, « The Subfossil Occurrence and Paleoecological Significance of Small Mammals at Ankilitelo Cave, Southwestern Madagascar », Journal of Mammalogy, vol. 90, no 5, , p. 1111–1131 (DOI 10.1644/08-MAMM-A-242.1).
- (en) R. A. Mittermeier, I. Tattersall, W. R. Konstant, D. M. Meyers et R. B. Mast, Lemurs of Madagascar, Washington, D.C., Conservation International, , 1re éd., 356 p. (ISBN 1-881173-08-9, OCLC 32480729), p. 34.
- (en) F. Ankel-Simons, Primate Anatomy : an introduction, Amsterdam, Academic Press, , 3e éd., 724 p. (ISBN 978-0-12-372576-9 et 0-12-372576-3), p. 591.
- (en) B. Dutrillaux et Y. Rumpler, « Chromosome banding analogies between a prosimian (Microcebus murinus), a platyrrhine (Cebus capucinus), and man », American Journal of Physical Anthropology, vol. 52, , p. 133–137 (PMID 6768303, DOI 10.1002/ajpa.1330520116).
- (en) R. Sussman, Primate Ecology and Social Structure Volume 1 : Lorises, Lemurs and Tarsiers, Needham Heights, Mass., Pearson Custom Publishing, , 107–148 p. (ISBN 0-536-02256-9)
- (en) R. Rakotondravony et U. Radespiel, « Varying patterns of coexistence of two mouse lemur species (Microcebus ravelobensis and M. murinus) in a heterogeneous landscape », American Journal of Primatology, vol. 71, no 11, , p. 928–938 (PMID 19676112, DOI 10.1002/ajp.20732)
- (en) M. Dammhahn et P.M. Kappeler, « Small-scale coexistence of two mouse lemur species (Microcebus berthae and M. murinus) within a homogeneous competitive environment », Oecologia, vol. 157, no 3, , p. 473–483 (PMID 18574599, PMCID 2515545, DOI 10.1007/s00442-008-1079-x)
- (en) C.Q. Choi, « Cannibalism Seen in Gray Mouse Lemur », Science Now,
- (en) M. Eberle et P.M. Kappele, « Mutualism, Reciprocity, or Kin Selection? Cooperative Rescue of a Conspecific From a Boa in a Nocturnal Solitary Forager the Gray Mouse Lemur », American Journal of Primatology, vol. 70, no 4, , p. 410–414 (PMID 17972271, DOI 10.1002/ajp.20496, lire en ligne).
- (en) D. Sündermann, M. Scheumann et Z. Zimmermann, « Olfactory predator recognition in predator-naïve gray mouse lemurs (Microcebus murinus) », Journal of Comparative Psychology, vol. 122, no 2, , p. 146–155 (PMID 18489230, DOI 10.1037/0735-7036.122.2.146).
- (en) M.L. Luhrs, M. Dammhahn, P.M. Kappeler et C. Fichtel, « Spatial memory in the grey mouse lemur (Microcebus murinus) », Animal Cognition, vol. 12, no 4, , p. 599–609 (PMID 19263100, PMCID 2698973, DOI 10.1007/s10071-009-0219-y, lire en ligne [PDF])
- (en) M. Piep, U. Radespiel, E. Zimmermann, S. Schmidt et B.M. Siemers, « The sensory basis of prey detection in captive-born grey mouse lemurs, Microcebus murinus », Animal Behaviour, vol. 73, no 3, , p. 871–878 (DOI 10.1016/j.anbehav.2007.07.008)
- (en) M. Dammhahn et P.M. Kappeler, « Comparative Feeding Ecology of Sympatric Microcebus berthae and M. murinus », International Journal of Primatology, vol. 29, no 6, , p. 1567–1589 (DOI 10.1007/s10764-008-9312-3)
- (en) R. Mittermeier et al., Mouse lemurs, p. 91–128
- (en) P.M. Kappeler et R.M. Rasoloarison, The Natural History of Madagascar, Chicago (Ill.), University of Chicago Press, , 1709 p. (ISBN 0-226-30306-3), p. 1310–1315.
- (en) U. Radespiel, Lemurs : Ecology and Adaptation, New York, Springer, , 450 p. (ISBN 978-0-387-34585-7), « Chapter 10: Ecological Diversity and Season Adaptations of Mouse Lemurs (Microcebus spp.) », p. 211–234
- (en) J. Schmid et J.U. Ganzhorn, « Optional strategies for reduced metabolism in gray mouse lemurs », Naturwissenschaften, vol. 96, no 6, , p. 737–741 (PMID 19277596, DOI 10.1007/s00114-009-0523-z, Bibcode 2009NW.....96..737S)
- « ISIS Species Holdings, Microcebus murinus », International Species Information System (ISIS), (consulté le )
- (en) C. Kraus, E. Eberle et P.M. Kappeler, « The costs of risky male behaviour: sex differences in seasonal survival in a small sexually monomorphic primate », Proc. R. Soc. B, vol. 275, no 1643, , p. 1635–1644 (PMID 18426751, PMCID 2602817, DOI 10.1098/rspb.2008.0200)
- (en) M. Perret, « Energetic Advantage of Nest-Sharing in a Solitary Primate, the Lesser Mouse Lemur (Microcebus murinus) », Journal of Mammalogy, vol. 49, no 4, , p. 1093–1102
- (en) J. Ganzhorn et J. Schmid, « Different Population Dynamics of Microcebus murinus in Primary and Secondary Deciduous Dry Forests of Madagascar », International Journal of Primatology, vol. 19, no 5, , p. 785–796 (DOI 10.1023/A:1020337211827)
- (en) R. Mittermeier et al., Chapter 1: Origin of the lemurs, 23–26 p.
- (en) A.D. Yoder et Z. Yang, « Divergence dates for Malagasy lemurs estimated from multiple gene loci : geological and evolutionary context », Molecular Ecology, vol. 13, (PMID 15012754, DOI 10.1046/j.1365-294X.2004.02106.x, lire en ligne)
- (en) J.R. Ali et M. Huber, « Mammalian biodiversity on Madagascar controlled by ocean currents », Nature, vol. 463, (PMID 20090678, DOI 10.1038/nature08706, Bibcode 2010Natur.463..653A, présentation en ligne)
- (en) M. Dammhahn et P.M. Kappeler, « Scramble or contest competition over food in solitarily foraging mouse lemurs (Microcebus spp.): New insights from stable isotopes », American Journal of Physical Anthropology, vol. 141, no 2, , p. 181–189 (PMID 19591211, DOI 10.1002/ajpa.21129)
- (en) D. Macdonald, « Primates », The Encyclopedia of Mammals, The Brown Reference Group plc, , p. 319 (ISBN 0-681-45659-0)
- (en) E. Zimmermann, E. Vorobieva, D. Wrogemann et T. Hafen, « Use of vocal fingerprinting for specific discrimination of gray (Microcebus murinus) and rufous mouse lemurs (Microcebus rufus) », International Journal of Primatology, vol. 21, no 9, , p. 837–852 (DOI 10.1023/A:1005594625841)
- (en) P. Braune, S. Schmidt et E. Zimmermann, « Acoustic divergence in the communication of cryptic species of nocturnal primates (Microcebus ssp.) », BMC Biology, vol. 6, , p. 19 (PMID 18462484, PMCID 2390514, DOI 10.1186/1741-7007-6-19, lire en ligne)
- (en) M. Eberle, M. Perret et P.M. Kappeler, « Sperm Competition and Optimal Timing of Matings in Microcebus murinus », International Journal of Primatology, vol. 28, no 6, , p. 1267–1278 (DOI 10.1007/s10764-007-9220-y).
- (en) M. Eberle et P. Kappeler, « Selected polyandry: female choice and inter-sexual conflict in a small nocturnal solitary primate (Microcebus murinus) », Behavioral Ecology and Sociobiology, vol. 57, no 1, , p. 91–100 (DOI 10.1007/s00265-004-0823-4).
- (en) J. Schmid et P.M. Kappeler, « Fluctuating sexual dimorphism and differential hibernation by sex in a primate, the gray mouse lemur (Microcebus murinus) », Behavioral Ecology and Sociobiology, vol. 43, no 2, , p. 125–132 (DOI 10.1007/s002650050474).
- (en) Fabien Pifferi, Jérémy Terrien, Julia Marchal et Alexandre Dal-Pan, « Caloric restriction increases lifespan but affects brain integrity in grey mouse lemur primates », Communications Biology, vol. 1, no 1, (ISSN 2399-3642, DOI 10.1038/s42003-018-0024-8, lire en ligne, consulté le ).
- (en) M. Eberle et P. Kappeler, « Family insurance: kin selection and cooperative breeding in a solitary primate (Microcebus murinus) », Behavioral Ecology and Sociobiology, vol. 60, no 4, , p. 582–588 (DOI 10.1007/s00265-006-0203-3).
- (en) T. Palmer, Index generum mammalium : a list of the genera and families of mammals, U. S. Government Printing, (lire en ligne), p. 421, 435
- (en) Don E Wilson et DeeAnn M Reeder, Mammal species of the world : a taxonomic and geographic reference (ISBN 978-0-8018-8221-0 et 0-8018-8221-4, lire en ligne), « Microcebus murinus », p. 113
- (en) E. Louis Jr., S. Engberg, S. McGuire, M. McCormick, R. Randriamampionona, J. Ranaivoarisoa, C. Bailey, R. Mittermeier et R. Lei, « Revision of the Mouse Lemurs, Microcebus (Primates, Lemuriformes), of Northern and Northwestern Madagascar with Descriptions of Two New Species at Montagne d'Ambre National Park and Antafondro Classified Forest », Primate Conservation, vol. 23, , p. 19–38 (DOI 10.1896/052.023.0103, lire en ligne).
- (en) R. Mittermeier, J. Ganzhorn, W. Konstant, K. Glander, I. Tattersall, C. Groves, A. Rylands, A. Hapke et J. Ratsimbazafy, « Lemur Diversity in Madagascar », International Journal of Primatology, vol. 29, no 6, , p. 1607–1656 (DOI 10.1007/s10764-008-9317-y).
- (en) P. Braune, S. Schmidt et E. Zimmermann, « Acoustic divergence in the communication of cryptic species of nocturnal primates (Microcebus ssp.) », BMC Biology, vol. 6, , p. 1–10 (PMID 18462484, PMCID 2390514, DOI 10.1186/1741-7007-6-19, lire en ligne [PDF]).
- (en) G. Olivieri, E. Zimmermann, B. Randrianambinina, S. Rassoloharijaona, D. Rakotondravony, K. Guschanski et U. Radespiel, « The ever-increasing diversity in mouse lemurs: three new species in north and northwestern Madagascar », Molecular Phylogenetics and Evolution, vol. 43, , p. 309–327 (PMID 17197200, DOI 10.1016/j.ympev.2006.10.026).
- (en) E.E. Louis, Jr., S.E. Engberg, S.M. McGuire, M.J. McCormick, R. Randriamampionona, J.F. Ranaivoarisoa, C.A. Bailey, R.A. Mittermeier et R. Lei, « Revision of the Mouse Lemurs, Microcebus (Primates, Lemuriformes), of Northern and Northwestern Madagascar with Descriptions of Two New Species at Montagne d'Ambre National Park and Antafondro Classified Forest », Primate Conservation, vol. 23, , p. 19–38 (DOI 10.1896/052.023.0103, lire en ligne [PDF]).
- (en) « UNEP-WCMC Species Database: CITES-Listed Species, Microcebus murinus », United Nations Environment Programme – World Conservation Monitoring Centre, (consulté le ).
- (en) « The CITES Appendices », Convention on International Trade in Endangered Species (consulté le ).
- (en) M. Raharivololona et J. Ganzhorn, « Gastrointestinal parasite infection of the Gray mouse lemur (Microcebus murinus) in the littoral forest of Mandena, Madagascar: Effects of forest fragmentation and degradation. », Madagascar Conservation & Development, vol. 4, no 2, , p. 103–112 (DOI 10.4314/134).
- (en) S. Giroud, M. Perret, P. Stein, J. Goudable, F. Aujard, C. Gilbert, J.P. Robin, Y.L. Maho et A. Zahariev, « The Grey Mouse Lemur Uses Season-Dependent Fat or Protein Sparing Strategies to Face Chronic Food Restriction », PLoS ONE, vol. 5, no 1, , e8823 (PMID 20098678, PMCID 2809095, DOI 10.1371/journal.pone.0008823, Bibcode 2010PLoSO...5.8823G).
- (en) S. Giroud, S. Blanc, F. Aujard, F. Bertrand, C. Gilbert et M. Perret, « Chronic food shortage and seasonal modulations of daily torpor and locomotor activity in the grey mouse lemur (Microcebus murinus) », The American Journal of Physiology – Regulatory, Integrative and Comparative Physiology, vol. 294, no 6, , R1958–R1967 (PMID 18434438, DOI 10.1152/ajpregu.00794.2007, lire en ligne).
Liens externes
- (en) Référence Animal Diversity Web : Microcebus murinus (consulté le )
- (en) Référence Brainmuseum : Microcebus murinus (consulté le )
- (en) Référence Catalogue of Life : Microcebus murinus (J. F. Miller, 1777) (consulté le )
- (en) Référence CITES : espèce Microcebus murinus (J. F. Miller, 1777) (+ répartition sur Species+) (consulté le )
- (fr) Référence CITES : taxon Microcebus murinus (sur le site du ministère français de l'Écologie) (consulté le )
- (fr+en) Référence ITIS : Microcebus murinus (J. F. Miller, 1777) (consulté le )
- (en) Référence Mammal Species of the World (3e éd., 2005) : Microcebus murinus J. F. Miller, 1777 (consulté le )
- (en) Référence NCBI : Microcebus murinus (taxons inclus) (consulté le )
- (en) Référence Paleobiology Database : Microcebus murinus Miller 1777 (consulté le )
- (en) Référence uBio : site déclaré ici indisponible le 7 avril 2023
- (en) Référence UICN : espèce Microcebus murinus (J. F. Miller, 1777) (consulté le )