Iodothyronine désiodase
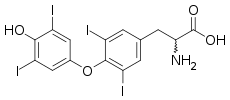
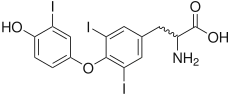
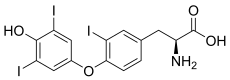
Une iodothyronine désiodase est une oxydoréductase qui catalyse la désiodation d'un dérivé iodé de la thyronine, ou iodothyronine, c'est-à-dire de la thyroxine, de la triiodothyronine ou de la 3,3',5'-triiodothyronine, abrégées respectivement T4, T3 et rT3 (T3 inverse).
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
Deux enzymes
Il existe essentiellement deux iodothyronine désiodases qui jouent un rôle déterminant dans l'action des hormones thyroïdiennes :
- la thyroxine 5'-désiodase (EC ) catalyse la désiodation de la thyroxine (T4) en triiodothyronine (T3), qui est la véritable hormone thyroïdienne, quatre fois plus active que la T4 ;
- la thyroxine 5-désiodase (EC ) catalyse d'une part la désiodation de la thyroxine (T4) en une forme inactive dite « T3 inverse » (rT3) correspondant à la 3,3',5'-triiodothyronine, et d'autre part la désiodation de la triiodothyronine (T3) en 3,3'-diiodothyronine (T2), également inactive.
Ces deux enzymes ont donc une action opposée vis-à-vis de l'activation de l'hormone thyroïdienne, la première activant la prohormone T4 en hormone thyroïdienne T3 tandis que la seconde convertit la T4 et la T3 respectivement en rT3 et T2, qui sont inactives.
Trois types d'enzymes
Ces deux enzymes correspondent en réalité à trois types d'enzymes, qui se distinguent par leur cinétique enzymatique et leur localisation dans la cellule :
- l'iodothyronine désiodase de type 1 (D1) est une thyroxine 5'-désiodase située dans la membrane plasmique de cellules du foie, des reins, de la thyroïde et, dans une moindre mesure, de l'hypophyse ;
- l'iodothyronine désiodase de type 2 (D2) est une thyroxine 5'-désiodase située dans la membrane du réticulum endoplasmique notamment des cellules de l'hypophyse, de la thyroïde, des muscles squelettiques, du tissu adipeux brun, du myocarde (artères coronaires) et du système nerveux central ;
- l'iodothyronine désiodase de type 3 (D3) est la thyroxine 5-désiodase, située dans la membrane plasmique de cellules du placenta, du fœtus et du système nerveux central, ainsi que dans les hémangiomes.
La D1 et la D2 sont deux isozymes qui ont toutes deux pour effet d'activer la thyroxine en triiodothyronine, mais avec une cinétique enzymatique différente. La D1 est impliquée dans la surproduction de T3 dans l'hyperthyroïdie mais sa fonction exacte dans l'organisme est moins bien comprise que celle de la D2 et de la D3[1] - [2]. La D2 produit l'essentiel du stock de T3 à partir de T4 tandis que la D3 désactive à la fois la T3 et la T4, de sorte que ces deux enzymes sont importantes dans l'homéostasie en régulant le taux sérique et cytoplasmique de T3. La D2 joue également un rôle important dans la thermogenèse au sein du tissu adipeux brun en accélérant la β-oxydation des acides gras et en découplant l'oxydation phosphorylante, ce qui a pour effet de générer de la chaleur plutôt que de l'ATP au sein des mitochondries.
Structure
Les trois types d'iodothyronine désiodases, qui correspondent à deux types d'enzymes, possèdent des séquences en acides aminés (structure primaire) très variables, dans lesquelles moins de la moitié des acides aminés sont invariants ; ils partagent en revanche un certain nombre de traits communs :
- leur masse varie entre 29 et 33 kDa[2] ;
- ce sont des protéines membranaires dimériques ayant un segment transmembranaire N-terminal et une grosse tête globulaire au niveau de laquelle se trouve un site actif situé au creux d'un repliement TRX ;
- ce site actif contient de la sélénocystéine[3] - [4] - [5] et deux résidus d'histidine[2] - [6] ;
- la sélénocystéine est codée par un codon UGA, correspondant normalement au codon-STOP opale dans le code génétique, mais la présence d'un élément SECIS en aval de ce codon induit l'expression de ce dernier en sélénocystéine plutôt qu'une terminaison de la transcription.
Les iodothyronine désiodases sont donc des sélénoprotéines[7], à la différence de la iodotyrosine désiodase (EC ), qui agit quant à elle sur la monoiodotyrosine (MIT) et la diiodotyrosine (DIT). Des expériences induisant une mutation de la D1 au niveau du codon UGA on montré une perte totale de fonctionnalité si ce codon est remplacé par le codon-STOP UAA (ocre), et une perte de 90 % de la fonctionnalité si ce codon est remplacé par UGU, qui code la cystéine[8].
Cible thérapeutique
Le propylthiouracile, un antithyroïdien de synthèse inhibe la D1, expliquant son efficacité thérapeutique. L'amiodarone inhibe également cet enzyme[9].
Notes et références
- (en) Antonio C. Bianco et Brian W. Kim, « Deiodinases: implications of the local control of thyroid hormone action », Journal of Clinical Investigation, vol. 116, no 10, , p. 2571–2579 (lire en ligne) DOI 10.1172/JCI29812
- (en) Balázs Gereben, Ann Marie Zavacki, Scott Ribich, Brian W. Kim, Stephen A. Huang, Warner S. Simonides, Anikó Zeöld et Antonio C. Bianco, « Cellular and Molecular Basis of Deiodinase-Regulated Thyroid Hormone Signaling », Endrocrine Reviews, vol. 29, no 7, , p. 898-938 (lire en ligne) DOI 10.1210/er.2008-0019
- (en) Josef Köhrle, « The Selenoenzyme Family of Deiodinase Isozymes Controls Local Thyroid Hormone Availability », Reviews in Endocrine and Metabolic Disorders, vol. 1, nos 1-2, , p. 49-58 (lire en ligne) DOI 10.1023/A:1010012419869
- (en) Josef Köhrle, « Local activation and inactivation of thyroid hormones: the deiodinase family », Molecular and Cellular Endocrinology, vol. 151, nos 1-2, , p. 103-119 (lire en ligne) DOI 10.1016/S0303-7207(99)00040-4
- (en) Josef Köhrle, « The deiodinase family: selenoenzymes regulating thyroid hormone availability and action », Cellular and Molecular Life Sciences, vol. 57, nos 13-14, , p. 1853-1863 (lire en ligne) DOI 10.1007/PL00000667
- (en) Carlos Valverde-R, Walburga Croteau, Gary J. LaFleur Jr., Aurea Orozco et Donald L. St. Germain, « Cloning and Expression of a 5′-Iodothyronine Deiodinase from the Liver of Fundulus heteroclitus », Endocrinology, vol. 138, no 2, , p. 642-648 (endo.endojournals.org/content/138/2/642) DOI 10.1210/en.138.2.642
- Voir Carence alimentaire en sélénium
- (en) Maria J. Berry, Laila Banu et P. Reed Larsen, « Type I iodothyronine deiodinase is a selenocysteine-containing enzyme », Nature, vol. 349, , p. 438-440 (lire en ligne) DOI 10.1038/349438a0
- Koenig RJ, Regulation of type 1 iodothyronine deiodinase in health and disease, Thyroid, 2005;15:835–840