Thyroxine 5-désiodase
La thyroxine 5-désiodase est une oxydoréductase qui catalyse la désiodation de la thyroxine, ou prohormone thyroïdienne T4, et de la triiodothyronine, ou hormone thyroïdienne T3, respectivement en 3,3',5'-triiodothyronine (« T3 inverse » ou rT3) et 3,3'-diiodothyronine (T2), qui sont inactives.
| IUBMB | Entrée IUBMB |
|---|---|
| IntEnz | Vue IntEnz |
| BRENDA | Entrée BRENDA |
| KEGG | Entrée KEGG |
| MetaCyc | Voie métabolique |
| PRIAM | Profil |
| PDB | RCSB PDB PDBe PDBj PDBsum |
| GO | AmiGO / EGO |
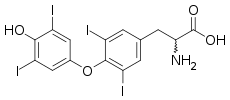
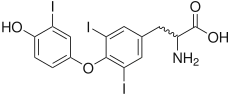
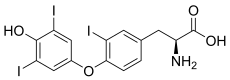
Tout comme la thyroxine 5'-désiodase, l'autre iodothyronine désiodase, la thyroxine 5-désiodase est une sélénoprotéine, c'est-à-dire qu'elle contient du sélénium sous la forme d'un acide aminé protéinogène assez rare, la sélénocystéine[1] - [2] - [3]. Le site actif se trouve au sein d'un repliement TRX et contient de la sélénocystéine et deux résidus d'histidine[4] - [5]. La sélénocystéine est codée par un codon UGA, correspondant normalement au codon-STOP opale dans le code génétique, mais la présence d'un élément SECIS en aval de ce codon induit l'expression de ce dernier en sélénocystéine plutôt qu'une terminaison de la transcription.
La thyroxine 5-désiodase est une protéine membranaire dimérique, avec un segment transmembranaire N-terminal et une grosse tête globulaire dans laquelle se trouve le site actif. Elle est présente dans la membrane plasmique de cellules du placenta, du fœtus et du système nerveux central ainsi que dans les hémangiomes, où elle a pour effet d'inactiver les hormones thyroïdiennes T3 (triiodothyronine) et T4 (thyroxine) en les désiodant respectivement en T2 (3,3'-diiodothyronine) et rT3 (3,3',5'-triiodothyronine).
Les taux de thyroxine 5-désiodase dans les tissus sont plus élevés au début du développement des vertébrés et tendent à décroître avec l'âge, tandis que les taux de thyroxine 5'-désiodase connaissent des pics lors des changements morphologiques significatifs, de sorte que la thyroxine 5-désiodase protégerait les tissus des conséquences d'une trop grande exposition à la T3[6].
Le taux de thyroxine 5-désiodase dans un cœur sain est généralement bas mais tend à augmenter dans la cardiomyopathie avec pour conséquence de réduire la production d'énergie et la consommation d'oxygène[4].
Notes et références
- (en) Josef Köhrle, « The Selenoenzyme Family of Deiodinase Isozymes Controls Local Thyroid Hormone Availability », Reviews in Endocrine and Metabolic Disorders, vol. 1, nos 1-2, , p. 49-58 (lire en ligne) DOI 10.1023/A:1010012419869
- (en) Josef Köhrle, « Local activation and inactivation of thyroid hormones: the deiodinase family », Molecular and Cellular Endocrinology, vol. 151, nos 1-2, , p. 103-119 (lire en ligne) DOI 10.1016/S0303-7207(99)00040-4
- (en) Josef Köhrle, « The deiodinase family: selenoenzymes regulating thyroid hormone availability and action », Cellular and Molecular Life Sciences, vol. 57, nos 13-14, , p. 1853-1863 (lire en ligne) DOI 10.1007/PL00000667
- (en) Balázs Gereben, Ann Marie Zavacki, Scott Ribich, Brian W. Kim, Stephen A. Huang, Warner S. Simonides, Anikó Zeöld et Antonio C. Bianco, « Cellular and Molecular Basis of Deiodinase-Regulated Thyroid Hormone Signaling », Endrocrine Reviews, vol. 29, no 7, , p. 898-938 (lire en ligne) DOI 10.1210/er.2008-0019
- (en) Carlos Valverde-R, Walburga Croteau, Gary J. LaFleur Jr., Aurea Orozco et Donald L. St. Germain, « Cloning and Expression of a 5′-Iodothyronine Deiodinase from the Liver of Fundulus heteroclitus », Endocrinology, vol. 138, no 2, , p. 642-648 (endo.endojournals.org/content/138/2/642) DOI 10.1210/en.138.2.642
- (en) DONALD L. ST. GERMAIN et VALERIE ANNE GALTON, « The Deiodinase Family of Selenoproteins », Thyroid, vol. 7, no 4, , p. 655-668 (lire en ligne) DOI 10.1089/thy.1997.7.655