Holobionte
Un holobionte (du grec holo, « tout », et bios, « vie »), ou supraorganisme[6], est un assemblage d'espèces hôtes (animal, végétal, fongique…) et d'autres espèces (généralement plus petites comme les micro-organismes) vivant à l'intérieur de cet organisme, sur son enveloppe ou à proximité[7].
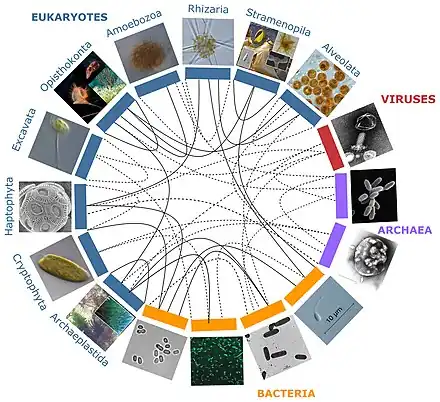
Les lignes pleines désignent des holobiontes étudiés, et les pointillées sont des exemples d'interactions potentielles[1].


Ce terme a été créé pour désigner l'entité bio-écologique constituée d'une multitude de symbiontes aux stratégies évolutives individuelles différentes, parfois antagonistes, parfois complémentaires[8].
Quand il existe des interactions biotiques de type symbiose, l'holobionte tend à être considéré comme une « unité fonctionnelle », par exemple en agroécologie. Il tend, dans tous les cas, à être de plus en plus considéré comme l'unité écologique scientifiquement pertinente pour la biologie, et/ou pour l'évolution[7].
Histoire du concept d'holobionte
Contexte historique
Le concept d'holobionte s'inscrit dans celui de l'holisme, une notion philosophique ancienne, proposée, semble-t-il pour la première fois, par Aristote 400 ans avant Jésus-Christ[9].
L'approche holistique stipule que les systèmes doivent être étudiés dans leur intégralité, en mettant l'accent sur les interconnexions/interrelations entre leurs différents composants et entre le système et son environnement, plutôt que sur ses seules parties individuelles[10].
De tels systèmes, notamment quand ils sont complexes ont des propriétés émergentes, qui résultent du comportement d'un système qui est « plus que la somme de ses parties ». Le siècle des Lumières a introduit une approche nouvelle, réductionniste : la pensée dominante était alors celle d'une « science de la dissection » était de se concentrer sur la plus petite composante d'un système comme moyen de le comprendre[1].
L'idée d'holisme a commencé à regagner en popularité dans le domaine de la biologie quand la théorie de l'endosymbiose a été proposée pour la première fois, par Konstantin Mereschkowski, en 1905, puis développée par Ivan Wallin en 1925. Toujours acceptée aujourd'hui, cette théorie postule une origine unique pour les cellules eucaryotes par assimilation symbiotique de procaryotes qui ont d'abord formé des mitochondries et plus tard des plastes (ces derniers, via plusieurs évènements symbiotiques indépendants) par phagocytose[11]. Ces évènements symbiotiques ancestraux et fondateurs, qui ont permis la complexité métabolique et cellulaire de la vie eucaryote, se sont très probablement déroulés dans l'océan[12] - [11].
Malgré l'acceptation générale de la théorie de l'endosymbiose, les termes « holobiose » et/ou « holobionte » ne sont cependant pas immédiatement entré dans la langue vernaculaire scientifique. Ce concept a été initialement (1943) introduit par le biologiste théoricien allemand Adolf Meyer-Abich[13], puis, apparemment indépendamment, par la docteur en microbiologie Lynn Margulis dans son livre de 1991 Symbiosis as a Source of Evolutionary Innovation[14].
Le concept a évolué depuis les formulations originales[15]. Lynn Margulis en 1990, a proposé que l'évolution ait principalement fonctionné par des sauts évolutifs axés sur la symbiose, quand des organismes arrivaient à fusionner en de nouvelles formes qu'elle a dénommées « holobiontes », et seulement secondairement par des changements mutationnels graduels[14] - [16].
Le concept d'holobionte n'a que progressivement été coopté par les biologistes des coraux. Il faut attendre plus d'une décennie pour que les coraux et leurs endosymbiotes, les Zooxanthelles (algues dinoflagellées) deviennent l'un des exemples les plus emblématiques d'holobionte trouvés dans la nature ; la plupart des coraux sont en effet incapables de survivre à long terme sans les produits de la photosynthèse fournis par leurs algues endosymbiotiques. En 2002, Forest Rohwer et ses collaborateurs ont été les premiers à utiliser[17] le mot holobionte pour décrire une unité de sélection au sens utilisé par Lynn Margulis pour les coraux[18], où l'holobionte était constitué du polype cnidaire (hôte), des algues Zooxanthelles, de divers ectosymbiontes (algues endolithiques, procaryotes, microchampignons et autres eucaryotes unicellulaires) et virus[1].
Les holobiontes comprennent aujourd'hui l'hôte, le microbiome (on parle aussi de flore commensale), le virome et tout autre organisme qui contribue d'une manière ou d'une autre au fonctionnement de l'ensemble[19] - [20] (La somme des virus présents dans un holobionte est appelée « virome »)[21].
Les holobiontes les plus étudiés ont d'abord été ceux des coraux constructeurs de récifs (qui jouent un rôle écologique et climatique majeur, en tant que puits de carbone notamment) et celui de l'être humains[22] - [23].
La recherche s'est depuis également intéressée au microbiote de la rhizosphère des plantes et à celui de l'intestin des animaux d'élevages. Ce sont devenus des modèles prédominants, qui sont en train de conduit à de profonds changement de paradigme dans l'agronomie (agroécologie), l'alimentation animale et les sciences médicales et vétérinaires[24] - [25] - [26].
Dans les habitats terrestres comme dans les habitats aquatiques, les interactions au sein et entre les holobiontes telles que l'induction de défenses chimiques, l'acquisition améliorée de nutriments, de vitamines et autres facteurs de croissance, ou encore la formation de biofilms sont médiées par des médiateurs qui sont des signaux chimiques ou biochimiques circulant dans l'environnement (infochemicals pour les anglophones)[27].
Deux différences majeures concernent cependant les systèmes terrestres et aquatiques :
- les propriétés physico-chimiques de l'eau y entraînent une connectivité et une signalisation chimiques plus élevées entre les macro- et micro-organismes permettent dans les environnements aquatiques ou humides. Dans les écosystèmes marins, les flux de carbone semblent également être des modes trophiques plus rapides et plus flexibles, conduisant à une plus grande plasticité des interactions fonctionnelles entre les holobiontes[28]. De plus, les barrières aux dispersions de propagules et messages biochimiques sont généralement moindres dans l'eau que dans les écosystèmes terrestres émergés, et elles sont moidres encore dans l'océan mondial que dans les réseaux de lacs, étangs, mares et zones humides, écologiquement plus fragmentés[29]. Ceci explique des changements plus rapides dans la communauté microbienne des holobiontes marins et certains impacts environnementaux aggravés de la fragmentation écologique des paysages.
- la diversité phylogénétique multi-échelle, ou à de larges échelles taxonomiques (c'est-à-dire aux niveaux supra-royaume, royaume et phylum) est plus élevée dans les domaines aquatiques que sur terre, une grande partie de la diversité aquatique restant à découvrir[30] - [31], en particulier les virus marins qui jouent probablement un rôle majeur dans les équilibres écologiques marins[19] - [32] - [33] - [34] - [1].
Ces dernières années ont vu émerger des outils de plus en plus puissants et moins coûteux permettant de caractériser les communautés microbiennes (séquençage à haut débit y compris du génome entier, analyse de l'ADN environnemental…), qui ont dopé les savoirs en écologie microbienne et notamment sur l'évolution des relations microbes-hôtes.
Implications conceptuelles et philosophiques

La théorie de la co-évolution postule que les hôtes et leur microbiote ont coévolué. Pour l'approche « réductionniste» (partie haute de la figure), les micro-organismes sont pathogènes, neutres ou symbiotes. La coévolution hôte-microbiote associé peut être qualifiée d'antagoniste (à gauche de la figure) ou mutualiste (à droite). Les données récentes orientent la biologie des organismes vers des approches plus holistiques (théorie des coévolutions, dans la partie inférieure de la figure) : l'hôte et son microbiote fonctionnent comme une seule entités (dite holobionte), laquelle coévoluerait comme une seule entité. L'état pathologique de l'holobionte serait une « dysbiose » (microbiote anormalement faible et instable) ; contrairement à l'état sain (« eubiose », avec diversité et stabilité du microbiote). Le flux dynamique de micro-organismes d'une génération à l'autre et d'un hôte à l'autre et vers l'environnement, inclus dans le concept One Health, sous-tend l'approche holistique dans la coévolution.
Depuis quelques décennies, tout comme celui de « microbiote », le concept d'« holobionte » modifie notre perception de ce qu'est un individu : il pousse à repenser l'individualité non plus comme la somme de l'ensemble des organes et des fonctions d'un individu, mais en lui intégrant aussi tous les composants vivants qui l'habite et le constituent (le microbiote et plus largement l'holobionte, avec du point de vue génétique son corolaire : l'hologénome)[35].
En termes de philosophie de l'environnement, selon Marine Biget (2021), c'est un changement de paradigme faisant qu'une « nouvelle révolution “copernicienne” semble s'initier avec un changement de la vision anthropo- et plante-centrée, au profit d'une vision holobionte-centrée, une vision holistique »[35].
Composants de l'holobionte
Hôte : Le membre hôte d'un holobionte est généralement un eucaryote multicellulaire, tel qu'une plante ou un animal (humain compris)[36]. Les hôtes les plus étudiés à ce jour comprennent par exemple les humains[37], les coraux[22] et les pins[38].
Vocabulaire, sémantique
- Les composants d'un holobionte sont des espèces individuelles (ou « biontes ») ;
- Le génome combiné de tous les biontes est l'hologénome ;
- Les micro-organismes habitant l'extérieur et l'intérieur de l'hôte (animaux, végétaux ou champignons multicellulaires) constituent son microbiote (ex. : microbiote de l'organisme humain, qui comprend notamment le microbiote cutané humain, en partie partagé avec le microbiote des muqueuses, lequel comprend notamment le microbiote intestinal, vaginal…) ;
- le mot biote (Biota en latin scientifique)[39] désigne le taxon de plus haut niveau, regroupant tous les êtres vivants[40] ;
- Le microbiome comprend des bactéries[19], des cyanophycées, des archées[41], des champignons microscopiques (ex. : champignons mycorhiziens arbusculaires (AMF) actifs dans les racines des plantes[42] - [20] et des protistes microscopiques[19].
Holobionte versus superorganisme
Les holobiontes sont distincts des superorganismes en ce que ces derniers se composent toujours de nombreux individus (principalement de la même espèce), et ce terme est couramment appliqué aux insectes eusociaux[6] - [43]. Une colonie de fourmis peut être décrite comme un superorganisme, alors qu'une fourmi individuelle et ses bactéries, champignons, etc. sont un holobionte[36].
Il existe encore une certaine controverse autour de ces termes, et ils ont été utilisés de manière interchangeable dans certaines publications.
Le phénotype holobionte
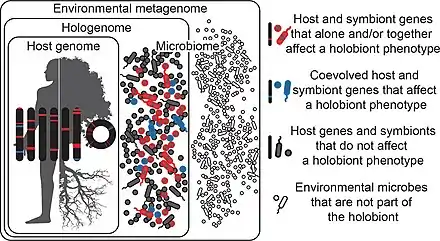
Il existe un phénotype holobionte, caractérisé par l'ensemble de tous ses microbes symbiotiques[15].
Dans le diagramme ci-contre, les microbes symbiotes qui affectent le phénotype d'un holobionte et qui ont co-évolué avec l'hôte sont colorés en bleu[15] ;
Ceux qui affectent le phénotype de l'holobionte mais n'ont pas co-évolué avec l'hôte sont colorés en rouge.
Ceux qui n'affectent pas du tout le phénotype de l'holobionte sont colorés en gris[15] ; Ces microbes peuvent être transmis verticalement ou horizontalement, peuvent être acquis de l'environnement et peuvent être constants ou inconstants chez l'hôte[15].
Les microbes dessinés en blanc, sont ceux qui dans l'environnement ne font pas partie de l'holobionte.
Il s'ensuit que le phénotype d'un holobionte peut changer dans le temps et dans l'espace, à mesure que les microbes entrent et sortent de l'holobionte[15].
L'hologénome « encapsule » les génomes de l'hôte et de tous ses microbes à un moment donné, les génomes et les gènes individuels tombant dans les trois mêmes catégories fonctionnelles de bleu, rouge et gris.
Remarque : les holobiontes et les hologénomes sont des entités, alors que la coévolution ou l'évolution des interactions hôte-symbiote sont des processus[15].
Histoire évolutive
Elle est encore mal connue, mais ancienne.
La première association connue entre deux micro-organismes semble avoir eu lieu il y a environ 1,45 milliard d'années, quand un procaryote (ancêtre de nos mitochondries) et un archéon ont fusionné pour donner les premiers eucaryotes (Roberts, 2017).
Un second évènement évolutif, aurait été, environ un milliard d'années plus tard, la fusion d'un eucaryote avec une bactérie photosynthétique (on parle aujourd'hui de plastide) préfigurant les premiers ancêtres de nos plantes[44] - [45].
La totalité des espèces végétales aujourd'hui connues sont associées à une communauté diversifiée de microbes.
Enjeux en termes de protection de la nature
La protection d'une espèce peut parfois exiger celle de son holobionte ; en effet, il n'y a plus de doutes sur le fait que les micro-organismes symbiotes sont essentiels à la biologie et à l'écologie de l'hôte en lui fournissant des vitamines, de l'énergie et des nutriments (inorganiques ou organiques), en participant aux mécanismes de défense ou en pilotant l'évolution de l'hôte[46] - [23].
Holobionte végétal
Une littérature scientifique importante existe sur les holobiontes végétaux car ces derniers se montrent très importants dans le domaine de la nutrition des végétaux (par exemple pour la captation de l'azote de l'air, via des symbioses bactériennes), pour la protection des végétaux, pour la résilience des plantes et la mise en œuvre de l'agroécologie.
Les communautés microbiennes associées aux plantes ont en effet un impact majeur sur les deux composants clés de la forme physique des plantes, de leur nutrition et de leur survie[20] ; ces communautés sont façonnées par la biodisponibilité des nutriments et par certains mécanismes de défense des plantes[42].
On a récemment découvert un nombre croissant de microbes associés aux plantes, notamment sur le rhizoplan (surface du tissu racinaire), de la rhizosphère (périphérie des racines), mais aussi de l'endosphère (intérieur du tissu végétal) et la phylosphère (surface totale hors sol)[10].
Des plantes sans racines comme les mousses ont aussi un microbiome important, par exemple étudié chez la sphaigne (dont l'holobionte intègre des bactéries méthanotrophes, phototrophes et fixatrices d'azote, dont les métabolites profitent à l'hôte qui fournit des services écosystémiques de premier ordre pour l'eau et en tant que puits et stock de carbone dans le monde en particulier dans les zones humides nordiques (tourbières de pentes et +tourbières de la toundra et de la taïga…)[47].
Le concept théorique d'holobionte, suggérait qu'une fraction importante du génome du microbiome avec le génome de l'hôte est transmise d'une génération à l'autre, pouvant ainsi propager, vers les générations suivantes, dans le temps et l'espace, les propriétés uniques de l'holobionte10.1186/s40168-018-0457-9. Des études ont montré que c'est effectivement le cas pour divers types de propagules, y compris via une « transmission verticale », c'est-à-dire via la graine. Des preuves de ce processus ont été récemment données, montrant que la majorité, jusqu'à 95 %, du microbiome des graines est mal traduite d'une génération à l'autre[48].
En 2021, une étude a par exemple montré que le gland de chêne contient un échantillon du microbiome parental, qui est « diversifié et distribué de manière non aléatoire dans le gland » et que quand ce gland est mis en culture dans un environnement sans microbes, « la composition microbienne de la phylosphère est diverse et ressemble fortement à la composition trouvée dans l'embryon, tandis que les racines et le péricarpe présentent chacun une communauté microbienne moins diversifiée et distincte », démontrant « un niveau élevé de diversité microbienne et de partition spatiale de la communauté fongique et bactérienne dans les graines et les semis, indiquant l'hérédité, la différenciation des niches et des voies de transmission divergentes pour l'établissement des communautés racinaires et phylosphères »[48].
Dans le cadre des approches plus holistique du vivant, et plus spécifiquement de la gestion des cultures et des sols, l'holobionte végétal est relativement bien étudié en tant qu'« unité fonctionnelle » chez diverses espèces cultivées (ex. : légumineuses, céréales, vigne[35]). L'écologue Marine Biget (2021) a testé et démontré la validité du concept d'holobionte et son intérêt dans l'étude de l'assemblage des communautés microbiennes de l'endosphère racinaire de la Vigne. Elle a montré que le recrutement actif et déterminé de microorganismes par les racines de la vigne est dominé par le porte-greffe et confirme l'importance de la dimension microbiologique de la notion de terroir[35].
Des phylums bactériens connus pour faire partie de l'holobionte de végétaux sont Actinomycetota, Bacteroidota, Bacillota et Pseudomonadota[19]. Par exemple, les fixateurs d'azote tels que Azotobacter (Pseudomonadota) et Bacillus (Bacillota) améliorent considérablement les performances des plantes[19].
Parmi les espèces que l'on sait avoir une importance majeur dans l'holobionte des végétaux figurent des champignons des phylums Ascomycota, Basidiomycota, Glomeromycota et Mucormycotina qui colonisent les tissus végétaux en fournissant divers services à la plante hôte, qui en échange leur offre un habitat et des nutriments[19].
Les champignons mycorhiziens arbusculaires (Glomeromycota, par exemple), sont communs à tous les groupes de plantes, chez lesquelles ils améliorent l'acquisition des nutriments, la résistance aux stress thermiques et hydriques (une qualité importante dans le contexte du dérèglement climatique) et la résistance aux phytopathogènes[49]. À titre d'exemple : les espèces d'Epichloë (Ascomycota) font partie de l'holobionte de la fétuque des prés et offrent une résistance aux herbivores en produisant les alcaloïdes de l'ergot, qui provoquent l'ergotisme chez les mammifères[50].
Au début des années 2020, on connait moins bien les protistes de l'holobionte végétal, et la recherche a surtout été jusque là orientées vers les agents pathogènes, mais on connait des associations plantes-protistes commensalistes, par exemple avec des Phytomonas (Trypanosomatidae)[51].
Holobiontes marins
Les coraux constructeurs de récifs et de futures roches calcaires, puits de carbone et habitat pour une grande partie de la biodiversité océanique sont des holobiontes qui incluent notamment le corail lui-même (un invertébré eucaryote de la classe Anthozoa), des dinoflagellés photosynthétiques appelés zooxanthelles (Symbiodinium) et des bactéries et virus associés[22].
Des schémas co-évolutifs existent pour les communautés microbiennes coralliennes et la phylogénie corallienne[52].
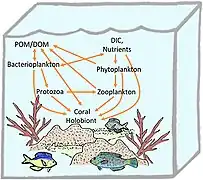 Holobionte corallien[53].
Holobionte corallien[53]. Holobionte d'herbier marin[10].
Holobionte d'herbier marin[10].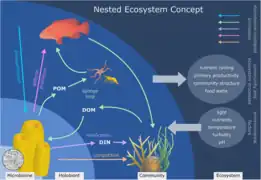 Holobionte d'éponge marine[54].
Holobionte d'éponge marine[54].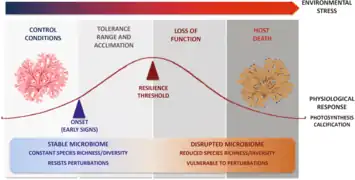 Effet du changement climatique sur l'holobionte et son hôte[55].
Effet du changement climatique sur l'holobionte et son hôte[55].
Effets des facteurs de stress sur l'holobionte
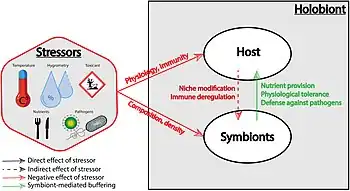
Les facteurs de stress peuvent directement influer sur la physiologie et l'immunité de l'hôte, ainsi que sur la composition et la densité de sa communauté symbiotique. Un stress sur les symbiotes, par exemple induit par des biocides ou pesticides, peut aussi affecter négativement l'hôte.
En situation de bon état écologique, l'équilibre relatif des espèces de l'holobionte peut fortement amortir les facteurs de stress via l'apport de nutriments, la tolérance physiologique et la défense contre les ennemis naturels de l'hôte.
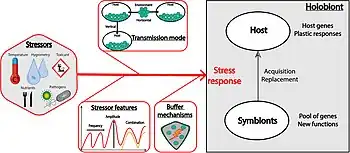
La réponse de l'holobionte aux facteurs de stress est difficile à prévoir, car elle peut beaucoup varier en fonction du contexte (et de nombreux facteurs peuvent être sous sélection, dont les gènes de résistance de l'hôte et les mécanismes de plasticité face aux modifications de l'environnement, mais aussi l'acquisition de symbiotes qui peuvent former un pool de gènes avec de nouvelles fonctions.
Parmi les facteurs clés susceptibles de préférentiellement sélectionner l'hôte ou les symbiotes pour s'adapter aux facteurs de stress figurent :
- les caractéristiques du facteur de stress (fréquence, durée, intensité…), mais aussi sa combinaison avec d'autres facteurs de stress (cumum de stress différents pouvant conduire à un effet additif, synergique ou parfois à des effets antagonistes ;
- le mode de transmission des symbiotes ;
- la spécificité et l'efficacité du mécanisme source d'effet tampon ;
- le bilan coûts/avantages[56].
Holobiomique
Le terme « holobiomique » (Holobiomics pour les anglophones) est composé des éléments grecs όλος / hólos, « tout, entier, total », et βίος / bíos, « vie », se terminant par -ome (biome) ; et le suffixe -omique (-ομική, féminin), qui identifie les sous-domaines de la biologie moderne qui visent à la caractérisation et à la quantification de l'intégralité d'éléments individuels similaires afin de tirer des conclusions sur la structure, la fonction et la dynamique d'un système.
Ce mot désigne l'étude scientifique des communautés d'holobiomes, étude qui se concentre généralement sur les interconnexions entre les composants des holobiomes, dans le contexte des conditions environnementales du lieu et du moment.
L'holobiomique vise à étudier les holobiontes d'un (éco-)système, leurs propriétés et les interactions des partenaires (symbiotiques ou non) dans leur globalité (approche écologique dite holistique). Pour ce faire, l'holobiomique combine notamment des techniques de biologie moléculaire[57], d'écologie[58] et de modélisation[59].
Controverse

En 2016, Douglas et Werren ont contesté l'hypothèse que « l'holobionte (hôte plus son microbiome) et son hologénome constitutif (la totalité des génomes de l'holobionte) soient réellement une « unité de sélection », et que cette unité aurait des propriétés similaires à un organisme individuel »[60].
Selon eux, « le concept d'hologénome est inutile pour l'étude des interactions de l'hôte avec les micro-organismes résidents car il se concentre sur un niveau de sélection (l'holobionte) et, par conséquent, il s'intéresse aux caractéristiques coopératives et intégratives des systèmes hôte-microbe en oubliant d'autres types d'interactions, dont l'antagonisme entre les micro-organismes et les conflits entre l'hôte et les partenaires microbiens »[60].
Pour valider le concept d'holobionte d'un point de vue évolutif, de nouvelles approches théoriques sont nécessaires qui reconnaissent les différents niveaux auxquels la sélection naturelle peut opérer dans le contexte des interactions microbiome-hôte.
Par exemple, la sélection naturelle pourrait se produire au niveau de l'holobionte lorsqu'une association transgénérationnelle entre des hôtes spécifiques et des génotypes de symbiotes peut être maintenue[61].
Depuis, dans le domaine des végétaux cultivés, des preuves expérimentales de la validité du concept d'holobionte ont été publiées[35] ; et on commence à mieux comprendre les dynamiques des assemblages d'espèces formant le microbiote des plantes (microbiote endosphérique racinaire notamment) et ses variations, qui se produisent sous le contrôle d'une part de facteurs liés au génome et à l'âge de la plante, et d'autre part en fonction de facteurs environnementaux, très liés au climat saisonniers notamment dans les régions où la saisonnalité est marquée[35].
Apports du concept d'holobionte
Ce concept a entraîné un déplacement de l'accent mis sur les symbioses impliquant un partenaire microbien et un seul hôte (ex. : calamar et Aliivibrio luminescent, légumineuse et Rhizobium, puceron et Buchnera), vers un intérêt accru pour la symbiose dans des consortiums multipartenaires complexes (ex. : système intestinal d'animaux invertébrés marins, épiphytes de plantes et d'algues, interactions microbe-microbe dans le sol, biomes aquatiques…)[61].
De plus, on se rend compte que même les symbioses binaires plutôt bien étudiées et réputées bien comprises telles qu'entre pucerons et Buchnera sont plus complexes qu'on ne le pensait, avec un certain nombre de symbiotes facultatifs contribuant à la résistance aux parasites[62], à l'expansion de l'utilisation des plantes hôtes[63] et à l'adaptation à la température[61] - [64].
Notes et références
- (en) Simon M. Dittami, Enrique Arboleda, Jean-Christophe Auguet et Arite Bigalke, « A community perspective on the concept of marine holobionts: current status, challenges, and future directions », PeerJ, vol. 9, , e10911 (ISSN 2167-8359, PMID 33665032, PMCID PMC7916533, DOI 10.7717/peerj.10911, lire en ligne, consulté le )
- (en) Katja Schröder et Thomas C. G. Bosch, « The Origin of Mucosal Immunity: Lessons from the Holobiont Hydra », mBio, vol. 7, no 6, (ISSN 2161-2129, e-ISSN 2150-7511, PMID 27803185, PMCID PMC5090036, DOI 10.1128/mBio.01184-16, lire en ligne, consulté le )
- (en) Thomas C.G. Bosch, « Understanding complex host-microbe interactions in Hydra », Gut Microbes, vol. 3, no 4, , p. 345–351 (ISSN 1949-0976, e-ISSN 1949-0984, PMID 22688725, PMCID PMC3463492, DOI 10.4161/gmic.20660, lire en ligne, consulté le )
- (en) Andrea P. Murillo-Rincon, Alexander Klimovich, Eileen Pemöller et Jan Taubenheim, « Spontaneous body contractions are modulated by the microbiome of Hydra », Scientific Reports, vol. 7, no 1, (ISSN 2045-2322, PMID 29162937, PMCID PMC5698334, DOI 10.1038/s41598-017-16191-x, lire en ligne, consulté le )
- Tim Lachnit, Torsten Thomas et Peter Steinberg, « Expanding our Understanding of the Seaweed Holobiont: RNA Viruses of the Red Alga Delisea pulchra », Frontiers in Microbiology, vol. 6, (ISSN 1664-302X, PMID 26779145, PMCID PMC4705237, DOI 10.3389/fmicb.2015.01489, lire en ligne, consulté le )
- (en) Merry Youle, Nancy Knowlton, Forest Rohwer et Jeffrey Gordon, « Superorganisms and Holobionts: Looking for a term for the functional entity formed by a macrobe and its associated symbiotic microbes and viruses? The term is “holobiont” », Microbe Magazine, vol. 8, no 4, , p. 152–153 (ISSN 1558-7452 et 1558-7460, DOI 10.1128/microbe.8.152.1, lire en ligne, consulté le )
- Marc-André Selosse, « Au-delà de l’organisme, l’holobionte », Pour la science, no 469 « Le nouveau monde des microbes », , p. 80-84 (ISSN 0153-4092, disponible sur Internet Archive).
- « Tous holobiontes ! Et si l’être humain était un méta-organisme plutôt qu’une entité unique ? », Le Monde, (lire en ligne)
- Aristote, Métaphysique, Z.17, 1041b11–33.
- (en) Kelly Ugarelli, Seemanti Chakrabarti, Peeter Laas et Ulrich Stingl, « The Seagrass Holobiont and Its Microbiome », Microorganisms, vol. 5, no 4, , p. 81 (ISSN 2076-2607, PMID 29244764, PMCID PMC5748590, DOI 10.3390/microorganisms5040081, lire en ligne, consulté le )
- (en) John M. Archibald, « Endosymbiosis and Eukaryotic Cell Evolution », Current Biology, vol. 25, no 19, , R911–R921 (DOI 10.1016/j.cub.2015.07.055, lire en ligne, consulté le )
- (en) William Martin, John Baross, Deborah Kelley et Michael J. Russell, « Hydrothermal vents and the origin of life », Nature Reviews Microbiology, vol. 6, no 11, , p. 805–814 (ISSN 1740-1526 et 1740-1534, DOI 10.1038/nrmicro1991, lire en ligne, consulté le )
- (en) Jan Baedke, Alejandro Fábregas‐Tejeda et Abigail Nieves Delgado, « The holobiont concept before Margulis », Journal of Experimental Zoology Part B: Molecular and Developmental Evolution, vol. 334, no 3, , p. 149–155 (ISSN 1552-5007 et 1552-5015, DOI 10.1002/jez.b.22931, lire en ligne, consulté le )
- (en) Lynn Margulis et René Fester, Symbiosis as a Source of Evolutionary Innovation: Speciation and Morphogenesis, MIT Press, (ISBN 978-0-262-13269-5, lire en ligne)
- (en) Kevin R. Theis, Nolwenn M. Dheilly, Jonathan L. Klassen et Robert M. Brucker, « Getting the Hologenome Concept Right: an Eco-Evolutionary Framework for Hosts and Their Microbiomes », mSystems, vol. 1, no 2, (ISSN 2379-5077, PMID 27822520, PMCID PMC5069740, DOI 10.1128/mSystems.00028-16, lire en ligne, consulté le )
- (en) Maureen A. O’Malley, « From endosymbiosis to holobionts: Evaluating a conceptual legacy », Journal of Theoretical Biology, vol. 434, , p. 34–41 (DOI 10.1016/j.jtbi.2017.03.008, lire en ligne, consulté le )
- (en) F Rohwer, V Seguritan, F Azam et N Knowlton, « Diversity and distribution of coral-associated bacteria », Marine Ecology Progress Series, vol. 243, , p. 1–10 (ISSN 0171-8630 et 1616-1599, DOI 10.3354/meps243001, lire en ligne, consulté le )
- (en) Eugene Rosenberg, Omry Koren, Leah Reshef et Rotem Efrony, « The hologenome theory disregards the coral holobiont: reply from Rosenberg et al. », Nature Reviews Microbiology, vol. 5, no 10, , p. 826–826 (ISSN 1740-1526 et 1740-1534, DOI 10.1038/nrmicro1635-c2, lire en ligne, consulté le )
- (en) L A De Weger, C I van der Vlugt, A H Wijfjes et P A Bakker, « Flagella of a plant-growth-stimulating Pseudomonas fluorescens strain are required for colonization of potato roots », Journal of Bacteriology, vol. 169, no 6, , p. 2769–2773 (ISSN 0021-9193 et 1098-5530, PMID 3294806, PMCID PMC212183, DOI 10.1128/jb.169.6.2769-2773.1987, lire en ligne, consulté le )
- (en) Philippe Vandenkoornhuyse, Achim Quaiser, Marie Duhamel et Amandine Le Van, « The importance of the microbiome of the plant holobiont », New Phytologist, vol. 206, no 4, , p. 1196–1206 (ISSN 0028-646X et 1469-8137, DOI 10.1111/nph.13312, lire en ligne, consulté le )
- Juris A. Grasis, « The Intra-Dependence of Viruses and the Holobiont », Frontiers in Immunology, vol. 8, (ISSN 1664-3224, PMID 29170664, PMCID PMC5684104, DOI 10.3389/fimmu.2017.01501, lire en ligne, consulté le )
- (en) Nancy Knowlton et Forest Rohwer, « Multispecies Microbial Mutualisms on Coral Reefs: The Host as a Habitat », The American Naturalist, vol. 162, no S4, , S51–S62 (ISSN 0003-0147 et 1537-5323, DOI 10.1086/378684, lire en ligne, consulté le )
- Kramer et Bressan 2015.
- (en) Davide Bulgarelli, Klaus Schlaeppi, Stijn Spaepen et Emiel Ver Loren van Themaat, « Structure and Functions of the Bacterial Microbiota of Plants », Annual Review of Plant Biology, vol. 64, no 1, , p. 807–838 (ISSN 1543-5008 et 1545-2123, DOI 10.1146/annurev-arplant-050312-120106, lire en ligne, consulté le ).
- (en) Andrew B. Shreiner, John Y. Kao et Vincent B. Young, « The gut microbiome in health and in disease: », Current Opinion in Gastroenterology, vol. 31, no 1, , p. 69–75 (ISSN 0267-1379, DOI 10.1097/MOG.0000000000000139, lire en ligne, consulté le ).
- (en) Denis Faure, Jean-Christophe Simon et Thierry Heulin, « Holobiont: a conceptual framework to explore the eco-evolutionary and functional implications of host-microbiota interactions in all ecosystems », New Phytologist, vol. 218, no 4, , p. 1321–1324 (DOI 10.1111/nph.15199, lire en ligne, consulté le )
- (en) Mahasweta Saha, Elisa Berdalet, Ylenia Carotenuto et Patrick Fink, « Using chemical language to shape future marine health », Frontiers in Ecology and the Environment, vol. 17, no 9, , p. 530–537 (ISSN 1540-9295 et 1540-9309, DOI 10.1002/fee.2113, lire en ligne, consulté le )
- (en) A. Mitra, K. J. Flynn, J. M. Burkholder et T. Berge, « The role of mixotrophic protists in the biological carbon pump », Biogeosciences, vol. 11, no 4, , p. 995–1005 (ISSN 1726-4189, DOI 10.5194/bg-11-995-2014, lire en ligne, consulté le )
- (en) Scott C. Burgess, Marissa L. Baskett, Richard K. Grosberg et Steven G. Morgan, « When is dispersal for dispersal? Unifying marine and terrestrial perspectives: When is dispersal for dispersal? », Biological Reviews, vol. 91, no 3, , p. 867–882 (DOI 10.1111/brv.12198, lire en ligne, consulté le )
- (en) Colomban de Vargas, Stéphane Audic, Nicolas Henry et Johan Decelle, « Eukaryotic plankton diversity in the sunlit ocean », Science, vol. 348, no 6237, (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.1261605, lire en ligne, consulté le )
- (en) Luke R. Thompson, Jon G. Sanders, Daniel McDonald et Amnon Amir, « A communal catalogue reveals Earth’s multiscale microbial diversity », Nature, vol. 551, no 7681, , p. 457–463 (ISSN 0028-0836 et 1476-4687, PMID 29088705, PMCID PMC6192678, DOI 10.1038/nature24621, lire en ligne, consulté le )
- (en) Mathias Middelboe et Corina Brussaard, « Marine Viruses: Key Players in Marine Ecosystems », Viruses, vol. 9, no 10, , p. 302 (ISSN 1999-4915, PMID 29057790, PMCID PMC5691653, DOI 10.3390/v9100302, lire en ligne, consulté le )
- (en) Ann C. Gregory, Ahmed A. Zayed, Nádia Conceição-Neto et Ben Temperton, « Marine DNA Viral Macro- and Microdiversity from Pole to Pole », Cell, vol. 177, no 5, , p. 1109–1123.e14 (PMID 31031001, PMCID PMC6525058, DOI 10.1016/j.cell.2019.03.040, lire en ligne, consulté le )
- (en) Guillermo Dominguez-Huerta, Ahmed A. Zayed, James M. Wainaina et Jiarong Guo, « Diversity and ecological footprint of Global Ocean RNA viruses », Science, vol. 376, no 6598, , p. 1202–1208 (ISSN 0036-8075 et 1095-9203, DOI 10.1126/science.abn6358, lire en ligne, consulté le )
- Marine Biget, « La vigne comme holobionte : validité du concept, dynamique temporelle, déterminants environnementaux et application à la définition du terroir microbiologique », theses.fr, Rennes 1, (lire en ligne [PDF], consulté le )
- (en) Seth R. Bordenstein et Kevin R. Theis, « Host Biology in Light of the Microbiome: Ten Principles of Holobionts and Hologenomes », PLOS Biology, vol. 13, no 8, , e1002226 (ISSN 1545-7885, PMID 26284777, PMCID PMC4540581, DOI 10.1371/journal.pbio.1002226, lire en ligne, consulté le )
- (en) Maarten van de Guchte, Hervé M. Blottière et Joël Doré, « Humans as holobionts: implications for prevention and therapy », Microbiome, vol. 6, no 1, (ISSN 2049-2618, PMID 29716650, PMCID PMC5928587, DOI 10.1186/s40168-018-0466-8, lire en ligne, consulté le )
- (en) Stéphane Hacquard et Christopher W. Schadt, « Towards a holistic understanding of the beneficial interactions across the Populus microbiome », New Phytologist, vol. 205, no 4, , p. 1424–1430 (ISSN 0028-646X et 1469-8137, DOI 10.1111/nph.13133, lire en ligne, consulté le )
- « Biota - Classification - Systema Naturae 2000 » [archive du ], sur sn2000.taxonomy.nl, (consulté le )
- (en) Référence The Taxonomicon : Biota (consulté le )
- (en) M. Amine Hassani, Paloma Durán et Stéphane Hacquard, « Microbial interactions within the plant holobiont », Microbiome, vol. 6, no 1, , p. 58 (ISSN 2049-2618, PMID 29587885, PMCID PMC5870681, DOI 10.1186/s40168-018-0445-0, lire en ligne, consulté le )
- (en) Carmen Sánchez-Cañizares, Beatriz Jorrín, Philip S Poole et Andrzej Tkacz, « Understanding the holobiont: the interdependence of plants and their microbiome », Current Opinion in Microbiology, vol. 38, , p. 188–196 (DOI 10.1016/j.mib.2017.07.001, lire en ligne, consulté le )
- (en) William Morton Wellcome Library, The social insects : their origin and evolution, London : K. Paul, Trench, Trubner ; New York : Harcourt, Brace, (lire en ligne)
- L. Sagan, « On the origin of mitosing cells », Journal of Theoretical Biology, vol. 14, no 3, , p. 255–274 (ISSN 0022-5193, PMID 11541392, DOI 10.1016/0022-5193(67)90079-3, Bibcode 1967JThBi..14..225S, lire en ligne, consulté le )
- (en) Michael W. Gray, « Lynn Margulis and the endosymbiont hypothesis: 50 years later », Molecular Biology of the Cell, vol. 28, no 10, , p. 1285–1287 (ISSN 1059-1524, e-ISSN 1939-4586, PMID 28495966, PMCID PMC5426843, DOI 10.1091/mbc.e16-07-0509, lire en ligne, consulté le )
- (en) Eugene Rosenberg et Ilana Zilber-Rosenberg, « Microbes Drive Evolution of Animals and Plants: the Hologenome Concept », mBio, vol. 7, no 2, (ISSN 2161-2129 et 2150-7511, PMID 27034283, PMCID PMC4817260, DOI 10.1128/mBio.01395-15, lire en ligne, consulté le )
- (en) Joel E. Kostka, David J. Weston, Jennifer B. Glass et Erik A. Lilleskov, « The Sphagnum microbiome: new insights from an ancient plant lineage », New Phytologist, vol. 211, no 1, , p. 57–64 (ISSN 0028-646X et 1469-8137, DOI 10.1111/nph.13993, lire en ligne, consulté le )
- (en) Ahmed Abdelfattah, Michael Wisniewski, Leonardo Schena et Ayco J. M. Tack, « Experimental evidence of microbial inheritance in plants and transmission routes from seed to phyllosphere and root », Environmental Microbiology, vol. 23, no 4, , p. 2199–2214 (ISSN 1462-2912 et 1462-2920, PMID 33427409, DOI 10.1111/1462-2920.15392, lire en ligne, consulté le )
- Naheeda Begum, Cheng Qin, Muhammad Abass Ahanger et Sajjad Raza, « Role of Arbuscular Mycorrhizal Fungi in Plant Growth Regulation: Implications in Abiotic Stress Tolerance », Frontiers in Plant Science, vol. 10, (ISSN 1664-462X, PMID 31608075, PMCID PMC6761482, DOI 10.3389/fpls.2019.01068, lire en ligne, consulté le )
- (en) Philippe Guerre, « Ergot Alkaloids Produced by Endophytic Fungi of the Genus Epichloë », Toxins, vol. 7, no 3, , p. 773–790 (ISSN 2072-6651, PMID 25756954, PMCID PMC4379524, DOI 10.3390/toxins7030773, lire en ligne, consulté le )
- (en) Arne Schwelm, Julia Badstöber, Simon Bulman et Nicolas Desoignies, « Not in your usual Top 10: protists that infect plants and algae: Protists in plant pathology », Molecular Plant Pathology, vol. 19, no 4, , p. 1029–1044 (PMID 29024322, PMCID PMC5772912, DOI 10.1111/mpp.12580, lire en ligne, consulté le )
- (en) F. Joseph Pollock, Ryan McMinds, Styles Smith et David G. Bourne, « Coral-associated bacteria demonstrate phylosymbiosis and cophylogeny », Nature Communications, vol. 9, no 1, (ISSN 2041-1723, PMID 30467310, PMCID PMC6250698, DOI 10.1038/s41467-018-07275-x, Bibcode 2018NatCo...9.4921P, lire en ligne, consulté le )
- Janelle R. Thompson, Hanny E. Rivera, Collin J. Closek et Mónica Medina, « Microbes in the coral holobiont: partners through evolution, development, and ecological interactions », Frontiers in Cellular and Infection Microbiology, vol. 4, (ISSN 2235-2988, PMID 25621279, PMCID PMC4286716, DOI 10.3389/fcimb.2014.00176, lire en ligne, consulté le )
- (en) L. Pita, L. Rix, B. M. Slaby et A. Franke, « The sponge holobiont in a changing ocean: from microbes to ecosystems », Microbiome, vol. 6, no 1, (ISSN 2049-2618, PMID 29523192, PMCID PMC5845141, DOI 10.1186/s40168-018-0428-1, lire en ligne, consulté le )
- (en) Giselle S. Cavalcanti, Priya Shukla, Megan Morris et Bárbara Ribeiro, « Rhodoliths holobionts in a changing ocean: host-microbes interactions mediate coralline algae resilience under ocean acidification », BMC Genomics, vol. 19, no 1, (ISSN 1471-2164, PMID 30249182, PMCID PMC6154897, DOI 10.1186/s12864-018-5064-4, lire en ligne, consulté le )
- (en) Alexis Bénard, Fabrice Vavre et Natacha Kremer, « Stress & Symbiosis: Heads or Tails? », Frontiers in Ecology and Evolution, vol. 8, (ISSN 2296-701X, DOI 10.3389/fevo.2020.00167, lire en ligne, consulté le )
- (en) Michael Poulsen, Haofu Hu, Cai Li et Zhensheng Chen, « Complementary symbiont contributions to plant decomposition in a fungus-farming termite », Proceedings of the National Academy of Sciences, vol. 111, no 40, , p. 14500–14505 (ISSN 0027-8424 et 1091-6490, PMID 25246537, PMCID PMC4209977, DOI 10.1073/pnas.1319718111, Bibcode 2014PNAS..11114500P, lire en ligne, consulté le )
- (en) Alain Paquette et Christian Messier, « The effect of biodiversity on tree productivity: from temperate to boreal forests: The effect of biodiversity on the productivity », Global Ecology and Biogeography, vol. 20, no 1, , p. 170–180 (DOI 10.1111/j.1466-8238.2010.00592.x, lire en ligne, consulté le )
- (en) Maren Ziegler, Víctor M Eguíluz, Carlos M Duarte et Christian R Voolstra, « Rare symbionts may contribute to the resilience of coral–algal assemblages », The ISME Journal, vol. 12, no 1, , p. 161–172 (ISSN 1751-7362, e-ISSN 1751-7370, PMID 29192903, PMCID PMC5739009, DOI 10.1038/ismej.2017.151, lire en ligne, consulté le )
- (en) Angela E. Douglas et John H. Werren, « Holes in the Hologenome: Why Host-Microbe Symbioses Are Not Holobionts », mBio, vol. 7, no 2, (ISSN 2161-2129 et 2150-7511, PMID 27034285, PMCID PMC4817262, DOI 10.1128/mBio.02099-15, lire en ligne, consulté le )
- Suhelen Egan, Takema Fukatsu et M. Pilar Francino, « Opportunities and Challenges to Microbial Symbiosis Research in the Microbiome Era », Frontiers in Microbiology, vol. 11, (ISSN 1664-302X, PMID 32612581, PMCID PMC7308722, DOI 10.3389/fmicb.2020.01150, lire en ligne, consulté le )
- (en) Kerry M. Oliver, Jacob A. Russell, Nancy A. Moran et Martha S. Hunter, « Facultative bacterial symbionts in aphids confer resistance to parasitic wasps », Proceedings of the National Academy of Sciences, vol. 100, no 4, , p. 1803–1807 (ISSN 0027-8424 et 1091-6490, PMID 12563031, PMCID PMC149914, DOI 10.1073/pnas.0335320100, Bibcode 2003PNAS..100.1803O, lire en ligne, consulté le )
- (en) Tsutomu Tsuchida, Ryuichi Koga et Takema Fukatsu, « Host Plant Specialization Governed by Facultative Symbiont », Science, vol. 303, no 5666, , p. 1989 (ISSN 0036-8075 et 1095-9203, PMID 15044797, DOI 10.1126/science.1094611, lire en ligne, consulté le )
- (en) Clytia B. Montllor, Amy Maxmen et Alexander H. Purcell, « Facultative bacterial endosymbionts benefit pea aphids Acyrthosiphon pisum under heat stress: Aphid symbionts and heat stress », Ecological Entomology, vol. 27, no 2, , p. 189–195 (DOI 10.1046/j.1365-2311.2002.00393.x, lire en ligne, consulté le )
Voir aussi
Bibliographie
![]() : document utilisé comme source pour la rédaction de cet article.
: document utilisé comme source pour la rédaction de cet article.
- (en) Suhelen Egan, Tilmann Harder, Catherine Burke, Peter Steinberg, Staffan Kjelleberg et Torsten Thomas, « The seaweed holobiont: understanding seaweed–bacteria interactions », FEMS Microbiology Reviews, vol. 37, no 3 « Molecular Insights into Environmental Microbes », , p. 462-476 (ISSN 0168-6445, e-ISSN 1574-6976, PMID 23157386, DOI 10.1111/1574-6976.12011, S2CID 23382193).
- (en) Ricardo Guerrero, Lynn Margulis et Mercedes Berlanga, « Symbiogenesis: the holobiont as a unit of evolution », International Microbiology, vol. 16, no 3, , p. 133-143 (ISSN 1139-6709, e-ISSN 1618-1905, PMID 24568029, DOI 10.2436/20.1501.01.188, S2CID 7092078).
- [Kramer et Bressan 2015] (en) Peter Kramer et Paola Bressan, « Humans as Superorganisms: How Microbes, Viruses, Imprinted Genes, and Other Selfish Entities Shape Our Behavior », Perspectives on Psychological Science, vol. 10, no 4, , p. 464-481 (ISSN 1745-6916, e-ISSN 1745-6924, PMID 26177948, DOI 10.1177/1745691615583131
 , JSTOR 44290098, lire en ligne [PDF]).
, JSTOR 44290098, lire en ligne [PDF]). 
- (en) Deborah C. A. Leite, Joana F. Salles, Emiliano N. Calderon, Jan D. van Elsas et Raquel S. Peixoto, « Specific plasmid patterns and high rates of bacterial co‐occurrence within the coral holobiont », Ecology and Evolution, vol. 8, no 3, , p. 1818-1832 (e-ISSN 2045-7758, PMID 29435256, PMCID PMC5792611, DOI 10.1002/ece3.3717, S2CID 3314114, lire en ligne [PDF]).
- (en) Lauren A. Richardson, « Evolving as a holobiont », PLOS Biology, vol. 15, no 2, (ISSN 1544-9173, e-ISSN 1545-7885, PMID 28245221, PMCID PMC5330447, DOI 10.1371/journal.pbio.2002168, lire en ligne [PDF]).
Articles connexes
Liens externes
- « Voie Lactée, Holobionte et mignonnerie animale » [audio], La Méthode scientifique, sur radiofrance.fr, .
- Rémi Sussan, « Tous holobiontes ! Et si l’être humain était un méta-organisme plutôt qu’une entité unique ? », sur lemonde.fr, .